

探讨高浓电解液阴离子对Li+活度和嵌入反应动力学影响机理
描述
研究背景
锂离子电池(LIBs)的电化学反应发生在电极/电解液界面,这些反应的动力学显著影响LIBs的倍率性能。锂离子在界面处发生插层和脱出,包括溶剂化和脱溶剂化。Ogumi和Abe等人的研究结果表明,Li+的脱溶是电荷转移反应在电极/电解液界面上的决速步骤(RDS)。
界面电荷转移反应的活化能与Li+离子和溶剂之间的相互作用相关,因此, Li+与溶剂间弱的相互作用有利于减少界面处的活化能,提高界面反应的速率。此外,美国陆军实验室的许康等人研究表明,由电解液的还原分解产物形成的石墨负极表面的固体电解液界面(SEI)也影响了石墨/电解液界面上Li+的插层动力学。因此,电解液组成对LIBs中的界面动力学至关重要。
近年来,含有超过3mol/L锂盐的高浓电解液(HCE)因其独特的物理化学和电化学性质而逐渐受到研究人员的青睐。与1mol/L锂盐的传统电解液相比, HCE中的Li+插层反应速率更快。通常,在Li盐浓度高于3mol/L的HCE中,由于溶剂变少,Li+离子会与更多的阴离子配位以满足其配位数。作者以前报道过HCE的Li+配位结构和物理化学特性受到阴离子物种的显着影响。然而,阴离子种类对电极/电解液界面上电荷转移动力学影响的机理仍不明朗。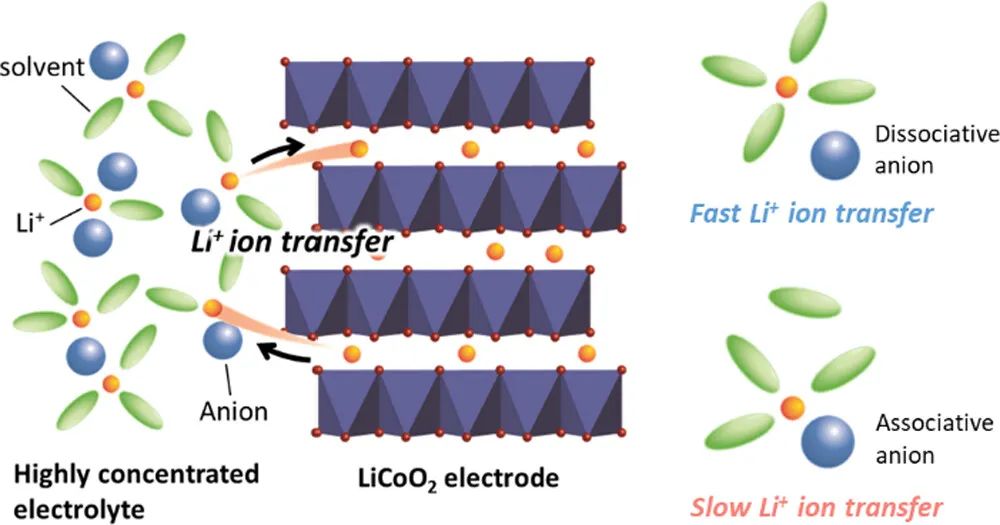
内容图(TOC)
成功简介
因此,Kaoru Dokko等人研究了阴离子对以碳酸丙烯酯(PC)为溶剂的高浓电解液中Li+溶剂化结构和电化学性能的影响。首先选取了5种常见的锂盐:六氟磷酸锂(LiPF6)、双(氟磺酰基)酰胺锂(LiFSA)、双(三氟甲磺酰基)胺锂(LiTFSA)、高氯酸锂(LiClO4)、四氟硼酸锂(LiBF4)和三氟甲磺酸锂(LiOTf)(图1)。
在这项研究中,作者使用拉曼光谱分析了HCE的液体结构。使用concentration cell评估了HCEs中Li+的活度。最后,作者使用EIS研究了LiCoO2电极的Li+嵌入/脱嵌动力学。该工作以“Anionic Effects on Li-Ion Activity and Li-Ion Intercalation Reaction Kinetics in Highly Concentrated Li Salt/Propylene Carbonate Solutions”为题发表在The Journal of Physical Chemistry C上
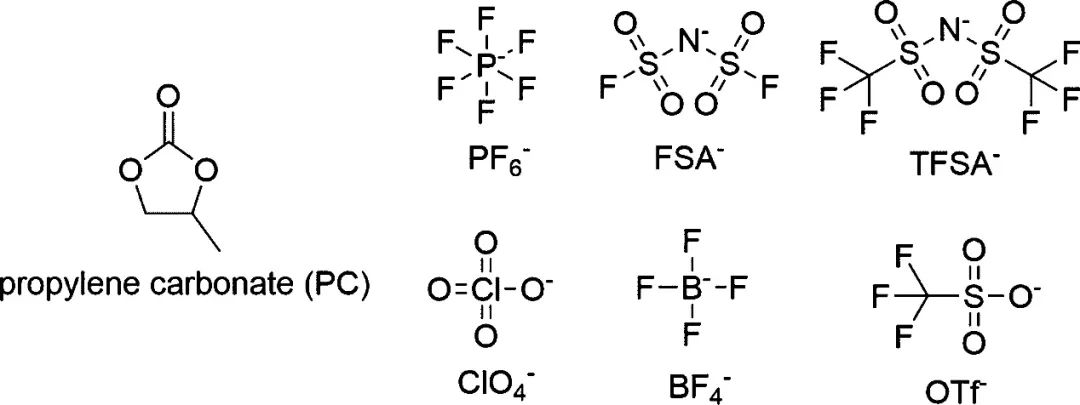
图1. PC和Li盐的阴离子的化学结构。
研究亮点
随着HCEs中阴离子的Lewis碱性降低,Li+与阴离子之间的离子缔合减弱,游离PC的浓度降低,导致Li+的活度系数更高。
在HCEs中使用具有弱Lewis碱性的阴离子的Li盐有利于在LiCoO2/电解液界面上实现快速的电荷转移动力学。
LiCoO2电极的稳定性可以使用具有弱Lewis碱性的阴离子HCE来改善。
图文导读
Li+在高浓PC电解液中的溶剂化结构
用拉曼光谱研究了不同浓度下PC电解液的液体结构。图2显示了680–780 cm–1范围内 纯PC和锂盐/PC电解液的拉曼光谱。纯PC在712 cm–1处出现峰值,这是对称环变形模式产生。当将Li盐添加到PC中时,在~722 cm–1处出现一个新的峰,对应于与Li+离子配位的PC分子。游离和配位PC的拉曼带强度提供了关于电解液的液体结构的信息。
图2. 拉曼光谱显示了在30°C下含有(a)LiPF6、(b)LiFSA、(c)LiTFSA、(d)LiClO4、(e)LiBF4和(f)LiOTf盐的PC的对称环变形模式。
图3显示了对应于阴离子振动带的Li盐/PC电解液的拉曼光谱。每个阴离子振动带对Li+和电解液中相应阴离子之间的相互作用敏感。对于[LiClO4]/[PC]≤1/6的混合物,在~934 cm–1处观察到ClO4–阴离子的对称拉伸模式的峰,这是溶剂分离离子对(SSIP)中游离ClO4–的特征;这意味着[LiClO4]/[PC]≤1/6的混合物中的Li+离子被PC分子溶剂化。
图3.(a)LiPF6(PF6对称拉伸)、(b)LiFSA(S═O拉伸),(c)LiTFSA(CF3弯曲与S–N拉伸耦合)、(d)LiClO4(ClO4对称拉伸)、(e)LiBF4(BF4对称拉伸)和(f)LiOTf(SO3对称拉伸)。在~722、778、960和1227 cm–1处由*表示的峰值分别对应于PC的对称环变形、环变形、碳酸盐对称拉伸振动和碳酸盐不对称拉伸振动模式。
锂金属的电极电势
为了评估电解液溶液中Li+离子的活度,测量了 Li 金属的电极电势。在锂金属的沉积/溶解过程中,Li+的溶剂化和去溶剂化发生在电极/电解液界面。因此,锂金属在非水电解液溶液中的电化学反应可描述如下:
电极电势用能斯特方程表示如下
图4. 30°C时,Li/Li+电极电位与PC电解液中Li盐浓度的关系图。参比电极为1 mol/L LiTFSA/PC中的Li/Li+。
即使Li沉积/溶解反应发生在Li金属/SEI界面,锂金属的电极电势也由本体电解液溶液的组成决定。图4显示了使用浓度池测量的各种锂盐/PC电解液中Li金属的电极电势。使用Concentration cell [Li|1M LiTFSA/PC||x M Li盐/PC|Li]测试了样品溶液中Li金属的电极电势。
LiCoO2薄膜表面的电化学
作者研究了Li盐/PC电解液中的盐浓度和阴离子种类对LiCoO2薄膜电极电化学反应的影响。作者选择LiCoO2薄膜作为电极,以避免添加剂(如聚合物粘合剂和碳导电剂)的影响。图5a显示了LiCoO2薄膜电极在[LiClO4]/[PC]=1/10电解液中的循环伏安图。在大约3.9V处观察到主要的氧化还原峰,这代表Li+在LiCoO2的层状结构中的脱出或嵌入。
图5.(a)[LiClO4]/[PC]=1/10和(b)[LiCl4]/[PC]=1/3电解液中LiCoO2薄膜电极下以1 mV s–1的扫描速率CV图。
在摩尔比为[LiClO4]/[PC]=1/3的HCE中,还观察到LiCoO2的可逆Li+嵌入/脱出反应(图5b)。与[LiClO4]/[PC]=1/10电解液中相比,[LiClO3]/[PC]=1/3电解液中主要氧化还原峰的峰间距和伏安图的峰电流密度分别较大和较低。这可能是由于前一种电解液的离子电导率(0.58 mS/cm)低于后一种电解液(5.59 mS/cm)。在[LiClO4]/[PC]=1/3电解液的情况下,抑制了循环时峰值电流密度的恶化,表明LiCoO2电极的稳定性随着盐浓度的增加而提高。稍后将进一步讨论Li盐浓度对LiCoO2电极稳定性的影响。
为了研究LiCoO2/电解液界面的电荷转移反应动力学,进行了EIS测试。图6显示了不同电极电势下[LiClO4]/[PC]=1/10电解液中LiCoO2薄膜电极的Nyquist 图。在高频范围(>1kHz)中观察到小半圆,其不随电极电势的变化而变化,这可能归因于多晶LiCoO2膜中的电子电阻以及Au和LiCoO2之间的接触电阻。
图6.(a) LiCoO2薄膜电极(在[LiClO4]/[PC]=1/10电解液中在不同电极电位下的Nyquist 图。(b)放大的Nyquist图。
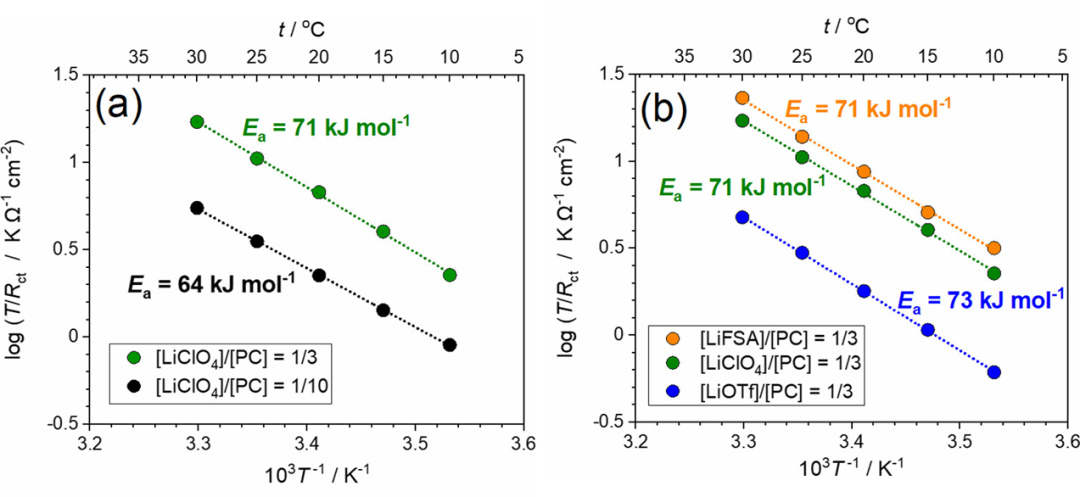
作者还研究了LiCoO2/电解液界面处Rct的温度依赖性。图7显示了Li盐/PC电解液中电极电位为4.0 V时T/Rct的Arrhenius图。值得注意的是,在该温度范围内,[LiClO4]/[PC]=1/3电解液的Rct低于[LiClO4]/[PC]=1/10电解液的。Li+嵌入到部分脱锂LizCoO2中的反应可以表示如下:
图7. 在(a)[LiClO4]/[PC]=1/n(n=3,10)和(b)[LiX]/[PC]=1/3(X=FSA,ClO4,OTf)电解液中,LiCoO2薄膜电极在4.0 V下的T/Rct的Arrhenius图。
Li+插层反应的交换电流密度i0与Rct成反比,可描述如下:
其中k0是标准速率常数,asolid是部分脱锂LiCoO2中Li+的活度,α是转移系数(0<α<1)。作者可以假设在4.0V的交流阻抗测量期间,部分脱锂的LiCoO2中Li+的活度没有变化。为了简单起见,Li+的活度(aLi+)假设如下,即无论Li盐浓度如何,自由溶剂的活度都不变(asolvent=1)(即,忽略电解液中溶剂活度的盐浓度依赖性)。转移系数α通常约为0.5。式4表明,i0随着电解液中Li+离子活度(aLi+)(即Li盐浓度)的增加而增加。标准速率常数k0表示如下:
其中A是指数前因子,ΔG*是活化的标准吉布斯能。文献中报道,Li+嵌入反应的RDS是Li+在电极/电解液界面处的脱溶过程。因此,假设ΔG*主要来源于破坏Li+和溶剂之间的离子-偶极相互作用所需的活化势垒。假设aLi+在测量的温度范围内不变,可以使用以下方程从Arrhenius图(图7a)估计Li+嵌入反应的表观活化能Ea(app):
其中A′是指数前因子。然而,Ea(app)不等于ΔG*(见下文)。[LiClO4]/[PC]=1/10电解液的Ea(app)值估计为64 kJ mol–1,与之前报道的值相当。根据1/Rct的Arrhenius图估计的表观活化能为62 kJ/mol,这与图7a所示的值没有显著差异。[LiClO4]/[PC]=1/3 HCE的Ea(app)值估计为71 kJ/mol,大于[LiClO4]/[PC]=1/10低浓度电解液(LCE)的Ea值,与之前报道的值相当。Abe报道了固体电解质/液态电解液和碳质电极/电解液界面的Ea(app)在3-5 M的高盐浓度范围内增加。他们推测,界面处Li+阴离子离子对的裂解需要比HCE中Li+离子脱溶更大的ΔG*。
除了活化吉布斯能ΔG*之外,电解液粘度(η)也对电极/电解液界面处的电荷转移动力学有显著影响。Uchimoto等人报道了LiMn2O4在恒温下的Li+插层反应的Rct和η之间的线性关系。他们基于溶剂动力学理论解释了这一点。如果溶剂动力学理论对Li+插层反应有效,则方程5中的指数前因子A将包括溶剂的纵向弛豫时间τL,并表示如下:
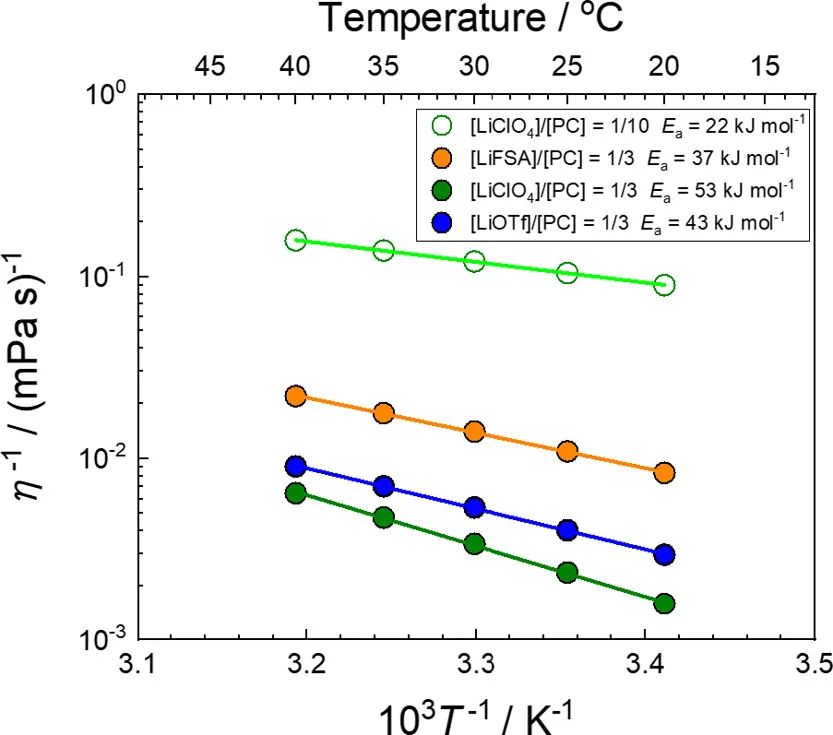
其中B=AτL。纵向弛豫时间τL与η大致成正比。(64)图8显示了基于PC的LCE和HCE的流动性(粘度的倒数,η–1)的阿伦尼乌斯图。LCE具有比HCE更高的流动性(即更低的粘度)。在[Li盐]/[PC]=1/3 HCE中, LiFSA的电解液表现出最高的流动性(图8),这也可以解释其高1/Rct(图7b)。LiOTf基电解液的流动性高于LiClO4基电解液;然而,前者的1/Rct低于后者,可能是因为前者中Li+的活度系数较低(图4)。随着Li盐浓度的增加,电解液溶液的流动性降低,而Li+活度增加。aLi+和η–1之间的折衷可以提供具有最大1/Rct值的电解液。
图8. 组成为[LiFSA]/[PC]=1/3、[LiClO4]/[PC]=1/n(n=3,10)和[LiOTf]/[PC]=1/3的电解液的流动性(η–1)的阿伦尼乌斯图。
尽管高浓电解液流动性的温度依赖性在宽温度范围内遵循Vogel–Fulcher–Tammann方程,在20–40°C的窄温度范围内,流动性与1/T成线性比例。流动性的表观活化能Ea(η–1)使用以下方程估算:
其中η0–1是指数前因子。如图8所示,[Li盐]/[PC]=1/3 HCE的Ea(η–1)值远高于[LiClO4]/[PC]=1/10 LCE的值。考虑到τL的温度依赖性,方程式7可改写如下:
其中τ0–1是τL–1的Arrhenius方程中的指数前因子,Ea(τL–1)是τL–1的活化能。假设在测量温度范围内,τL与η成比例,则Ea(τL–1)等于Ea(η–1)。然而,随着Li盐浓度从[LiClO4]/[PC]=1/10增加到[LiClO4]/[PC]=1/3,Ea(app)的增加仅为7 kJ/mol(图7a),而Ea(η–1)的增加为31 kJ/mol(图8)。
总结与展望
作者研究了阴离子的Lewis碱性对LiCoO2薄膜电极在高浓PC电解液中的界面电荷转移动力学的影响。随着HCEs中阴离子的Lewis碱性降低,Li+与阴离子之间的离子缔合减弱,游离PC的浓度降低,导致Li+的活度系数更高。EIS显示,LiCoO2/电解液界面(Rct)处的电荷转移电阻随着电解液中Li+离子活度的增加而降低。
随着Li盐浓度的增加,游离PC的峰值强度降低,结合PC的峰值增加。对于[Li盐]/[PC]=1/3的HCE和高度解离的盐,如LiPF6和LiFSA,结合PC的峰值强度远高于游离PC,这表明大多数PC分子与Li+离子配位,而游离PC分子几乎不存在。相反,对于具有高度缔合盐(如LiBF4和LiOTf)的HCE,游离PC的峰值强度与结合PC的峰值相当或大于结合PC的强度,表明这些溶液中存在大量游离PC分子。
根据文献,由于阴离子各自的Lewis碱性,离子缔合的顺序为LiPF6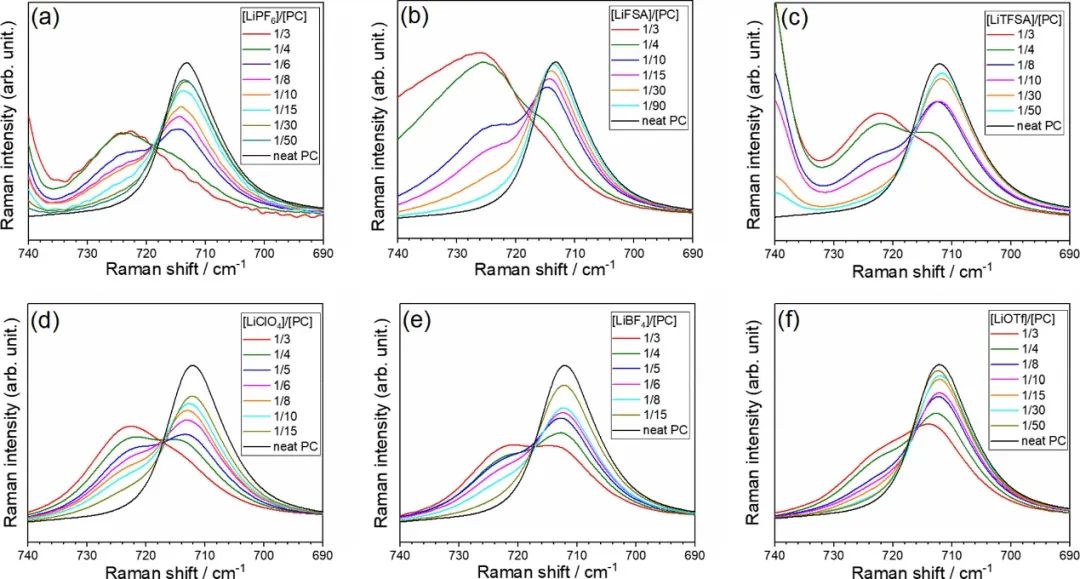
随着LiClO4的摩尔分数增加到[LiClO4]/[PC]=1/3,在~940 cm–1处的肩峰变得更加突出,这表明ClO4–阴离子直接与Li+离子相互作用形成接触离子对(CIP)。尽管在基于LiPF6、LiFSA和LiTFSA的电解液中,SSIP和CIP中涉及的阴离子的拉曼光谱带重叠,但随着Li盐摩尔分数的增加,每个光谱带向更高的波数移动,这表明Li+离子和阴离子之间的相互作用变得更强。
换句话说,无论阴离子种类如何,溶剂和阴离子都与HCE中的Li+离子竞争配位。由于Li+在非水电解液溶液中的配位数通常为4–5,电解液中的PC溶剂的量([Li盐]/[PC]=1/3的摩尔比)不足以满足该配位数。因此,Li+离子与阴离子配位并形成CIPs。
在[LiBF4]/[PC]=1/3和[LiOTf]/[PC]=1/3的混合物的拉曼光谱中,BF4-和OTf-的强峰分别出现在约775和约1050 cm-1处,表明形成了离子聚集体(AGG),其中阴离子与一个以上的Li+离子配位。这表明更多缔合阴离子与多个Li+离子强烈相互作用,一定量的PC从Li+的第一溶剂化鞘中移除,导致电解液中游离PC的分数增加。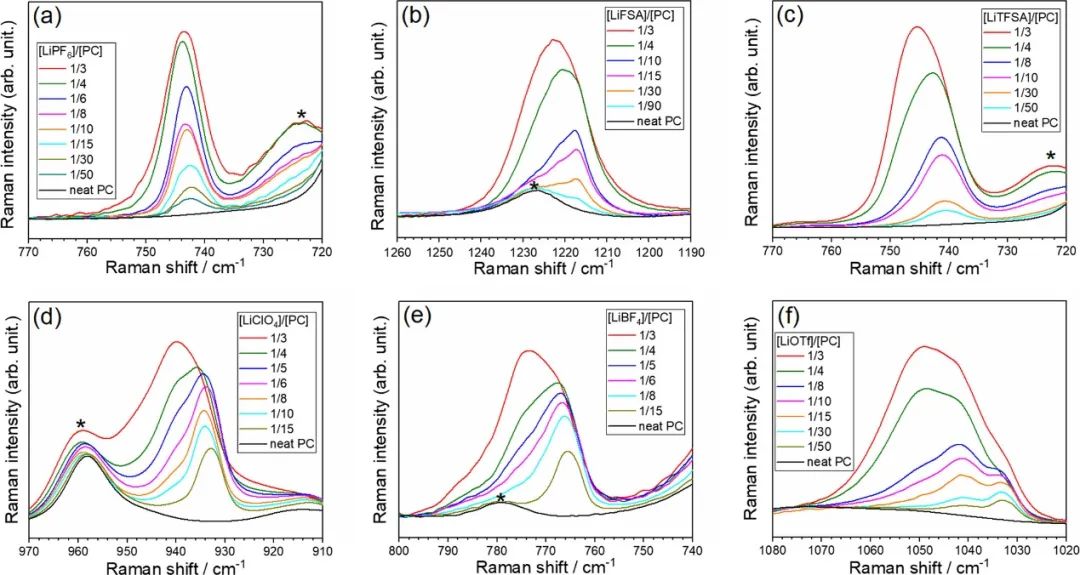
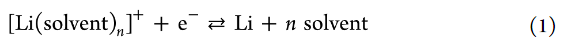

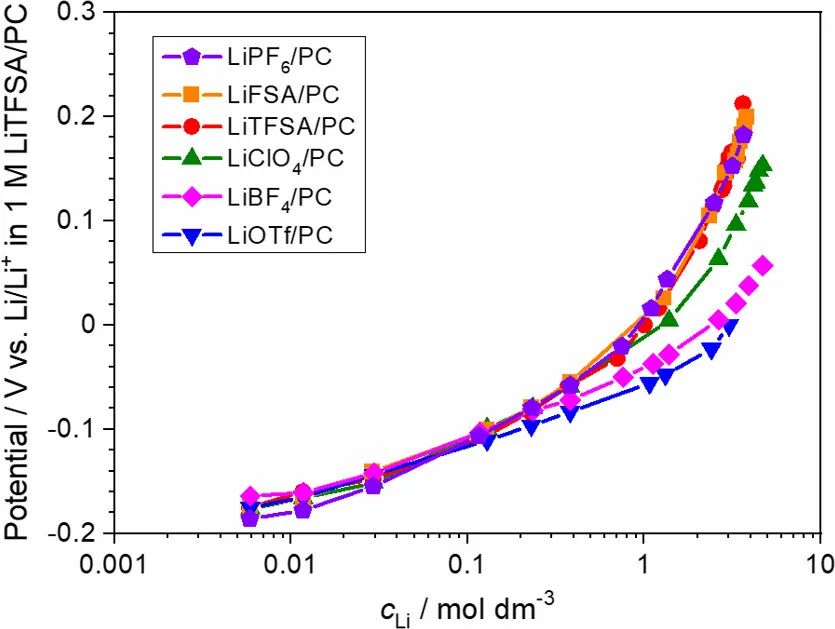
在含有过量溶剂的稀释电解液溶液(≤0.1M)中,Li金属的电极电势随log cLi线性增加,而与阴离子种类无关(图4)。该结果表明,恒定溶剂活度的假设(即,a溶剂=1)对于稀电解液是有效的。在0.01–0.1 M的浓度范围内,Li电极电势与log cLi的斜率为50–60 mV/ decade,与阴离子种类无关,这与单电子反应的理论值(60 mV/decade)非常一致。
然而,对于高浓电解液(>1M和[Li盐]/[PC]>1/8),Li电极电势随着盐浓度的增加而非线性增加log cLi和Li电极电势之间的非线性关系可归因于Li+的活度系数(γ+)的增加(其中aLi+=γ+cLi)或自由溶剂活度的降低。实际上,如拉曼光谱所示,游离溶剂的浓度(或活度)随着盐浓度的增加而降低(图2)。
然而,在传统的电解液理论中,假设溶剂的活度不变(即,a溶剂=1),与盐浓度无关。如果作者假设无论盐浓度如何,溶剂的活度总是1(即忽略电解液中溶剂活度的盐浓度依赖性),则在>1M Li盐浓度下,Li+的活度系数应随着cLi的增加而增加。
Li的电极电势与log cLi的曲线斜率随浓度范围超过1M的阴离子而变化。这里,作者注意到阴离子配位能力的顺序与离子缔合强度有关,即PF6–
强配位阴离子优先与Li+相互作用,在高浓电解液中形成CIPs和AGG(图3)。这可能导致具有强配位阴离子的高浓电解液中Li+的活度系数相对较低。即Li+的活度系数与阴离子的配位能力成反比。
在4.07和4.17V处出现两个小峰,这归因于CoO2框架中有序和无序Li+离子排列之间的相变。在1 mV s–1的扫描速率下,约3.9 V的主要氧化还原峰的峰相隔距离较小(约40 mV)然而,在循环时,峰值距离增加,峰值电流减少,表明在循环期间发生了LiCoO2多晶膜的开裂。在本研究中使用的电池配置的情况下,没有向LiCoO2电极施加机械压力。因此,如果在电化学反应期间膜发生破裂,则LiCoO2薄膜和Au衬底之间的电接触可能部分恶化,导致一定数量的晶粒电失活。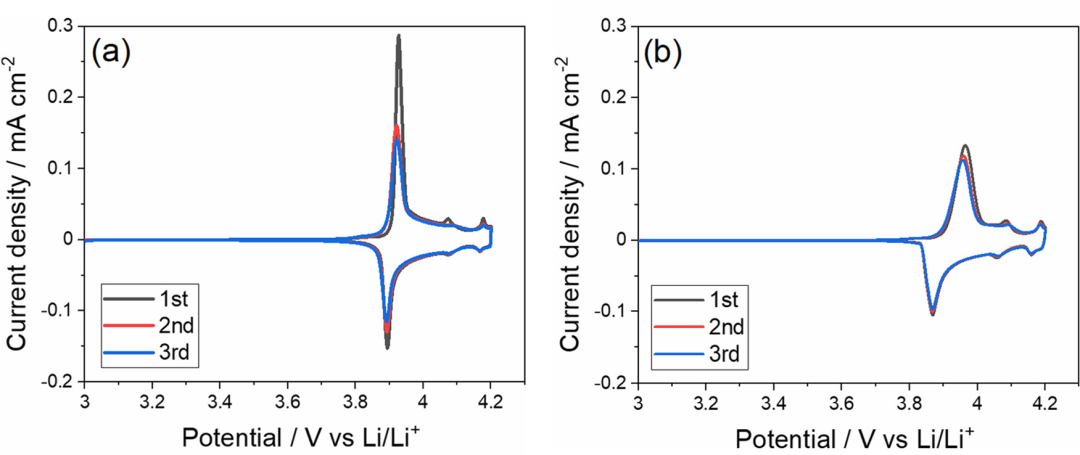
在3.4V的开路电位下,薄膜在<1kHz的频率范围内表现出电容行为(图6a)。当电极电位高于3.8V时,在低频区域中出现第二半圆形。该半圆的直径随着电极电势的变化而变化,并在4.0V时达到最小值(图6b)。因此,此半圆归因于LiCoO2/电解液界面处的电荷转移反应。然后,通过拟合图6a中所示的等效电路来评估电荷转移电阻(Rct),其中Rb是本体电解液的离子电阻,RHF是LiCoO2薄膜中的电子电阻,CPE是恒定相位元件,Zw是Warburg阻抗,CL是薄膜的Li+嵌入电容。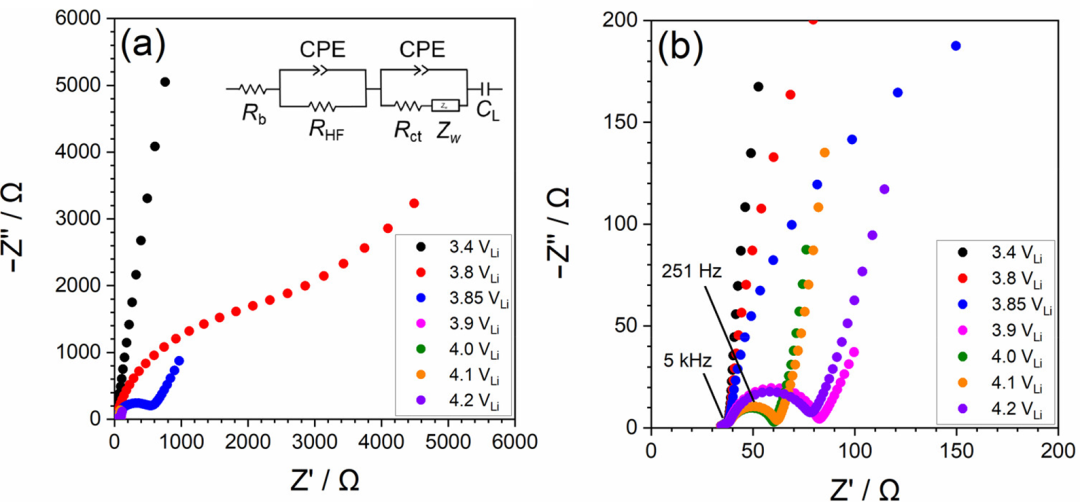
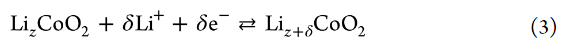
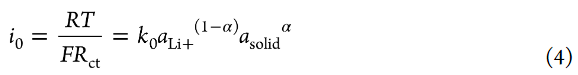

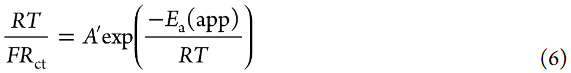
然而,这里出现了一个问题,即在所研究的电解液中,Li+和ClO4之间的吸引力是否比Li+和PC之间的吸引力强。古特曼供体数(DN)是Lewis碱性的描述符;PC的DN为15.1 kcal mol–1,而ClO4的DN为8.44 kcal/mol。由于PC是比ClO4更强的Lewis碱,Lewis酸性Li+离子主要被LCE中的PC分子溶剂化,如拉曼光谱所示(图2)。在HCE中,如[LiClO4]/[PC]=1/3,PC和ClO4-都与Li+离子配位。如果Li+和阴离子之间的复合物形成是HCEs中Ea(app)增加的主要原因,则Ea(pp)预计会根据阴离子种类而变化。
为了证实这一假设,作者研究了含有不同Li盐、LiFSA、LiClO4和LiOTf的[Li盐]/[PC]=1/3电解液中Rct的温度依赖性。如前所述,阴离子的配位能力按以下顺序增加:FSA–
在30°C下测得的Rct值顺序为FSA–
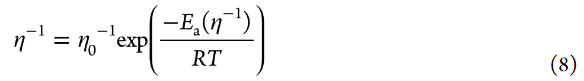
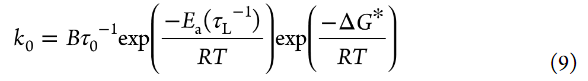
这种差异可能是由于其他因素的温度依赖性。先前的文献表明,电解液中Li+和阴离子之间的关联随着温度的升高而增强。高温下Li+和阴离子之间的增强关联降低了Li+的活度系数(见上文),从而降低了Ea(app)值。此外,溶液中的阴离子种类影响Li+活度系数的温度依赖性。因此,除了ΔG*,还有τL的温度依赖性和Li+的活度系数影响HCE中的Ea(app)。
因此,在HCEs中使用具有弱Lewis碱性的阴离子的高度解离的Li盐有利于在LiCoO2/电解液界面上实现快速的电荷转移动力学。此外,游离PC的浓度影响电解液中部分脱锂的LiCoO2电极的稳定性。在含有较高浓度游离PC的电解液中,部分脱锂的LiCoO2电极的Rct和Li+嵌入电容(CL)分别随时间增加和减少,而在含有较低浓度游离PC电解液中Rct增长和CL衰减减慢。因此,LiCoO2电极的稳定性可通过具有弱Lewis碱性的阴离子来改善。
审核编辑:刘清
-
锂离子电池电解液有机溶剂的发展趋势2013-06-17 5840
-
锂离子电池电解液超全面介绍 有何神秘之处?2017-02-22 6987
-
电解液——锂电池的‘血液’2018-08-07 5921
-
锂离子电池电解液是什么?2009-10-27 14653
-
锂离子电池电解液研究进展2009-10-30 1611
-
锂离子电池材料之电解液(详细篇)2009-11-03 20019
-
锂离子电池电解液概况2011-11-08 822
-
电池老化对锂离子电池内部Li的分布影响2017-09-15 936
-
锂离子电池结构组成与电解液在锂离子电池充放电过程中的行为研究2017-09-18 1390
-
电解液宽温性能的影响因素和宽温电解液研究进展2020-10-21 12280
-
通过调节电解液化学成分实现高倍率和稳定的低温LMB2022-12-28 1652
-
稀释剂调节局部高浓电解液助力高电压锂金属电池2022-12-29 3419
-
吴憨子:动力电池电解液产业链与温度传感器2023-04-07 1017
-
电解液与SEI的关系?电解液对SEI的影响?2023-11-10 1482
-
锂电池电解液如何影响电池质量?锂电池电解液成分优势是什么?2024-01-11 2497
全部0条评论

快来发表一下你的评论吧 !

