

用于细胞互作正向遗传筛选的SPEAC-seq平台
描述
大脑内胶质细胞之间的相互作用异常会导致神经疾病,如多发性硬化症(MS)及其自身免疫性脑脊髓炎(EAE)。表征星形胶质细胞-小胶质细胞相互作用是重要的治疗靶点之一。然而,目前的方法并不能直接反映细胞互作与分子水平变化的相关性,并且难以检测由表面或分泌因子介导瞬时的细胞互作,因此检测方法亟需改进。
正向遗传筛选平台,例如基于CRISPR-Cas9系统的平台,虽然是鉴定基因的强大工具,但无法进行高通量共培养和受扰动单细胞的筛选,限制了它们在研究细胞互作中的应用。用于研究细胞互作的正向遗传筛选平台需要能够在受控微环境中建立由表面或分泌因子介导的细胞互作,同时需要能够检测由这些互作产生的现象,并确定这些变化是否由特定CRISPR-Cas9诱导。
近期,来自哈佛医学院的Francisco J. Quintana团队在Science上发表了题为“Droplet-based forward genetic screening of astrocyte–microglia cross-talk”的文章,展示了一种基于液滴微流控技术的高通量平台“SPEAC-seq”,可以用于细胞互作的正向遗传筛选。
研究人员首先将两种细胞用微流体进行共封包形成油包液滴并在试管中共培养,接着经三色光学器件和介电泳微流控分选仪筛选出成功封包细胞对的液滴,用于后续细胞互作的研究。随后使用具有细胞渗透性的荧光染料进行多重标记,用于加样和检测液滴中的细胞对。图1F显示了优化液滴分选参数后,分离出的报告基因激活的细胞对,初步检测到与激活的巨噬细胞配对的NF-kB标记的星形胶质细胞中,EGFP表达的上调。以上说明研究人员成功建立了基于油包液滴的共培养体系。
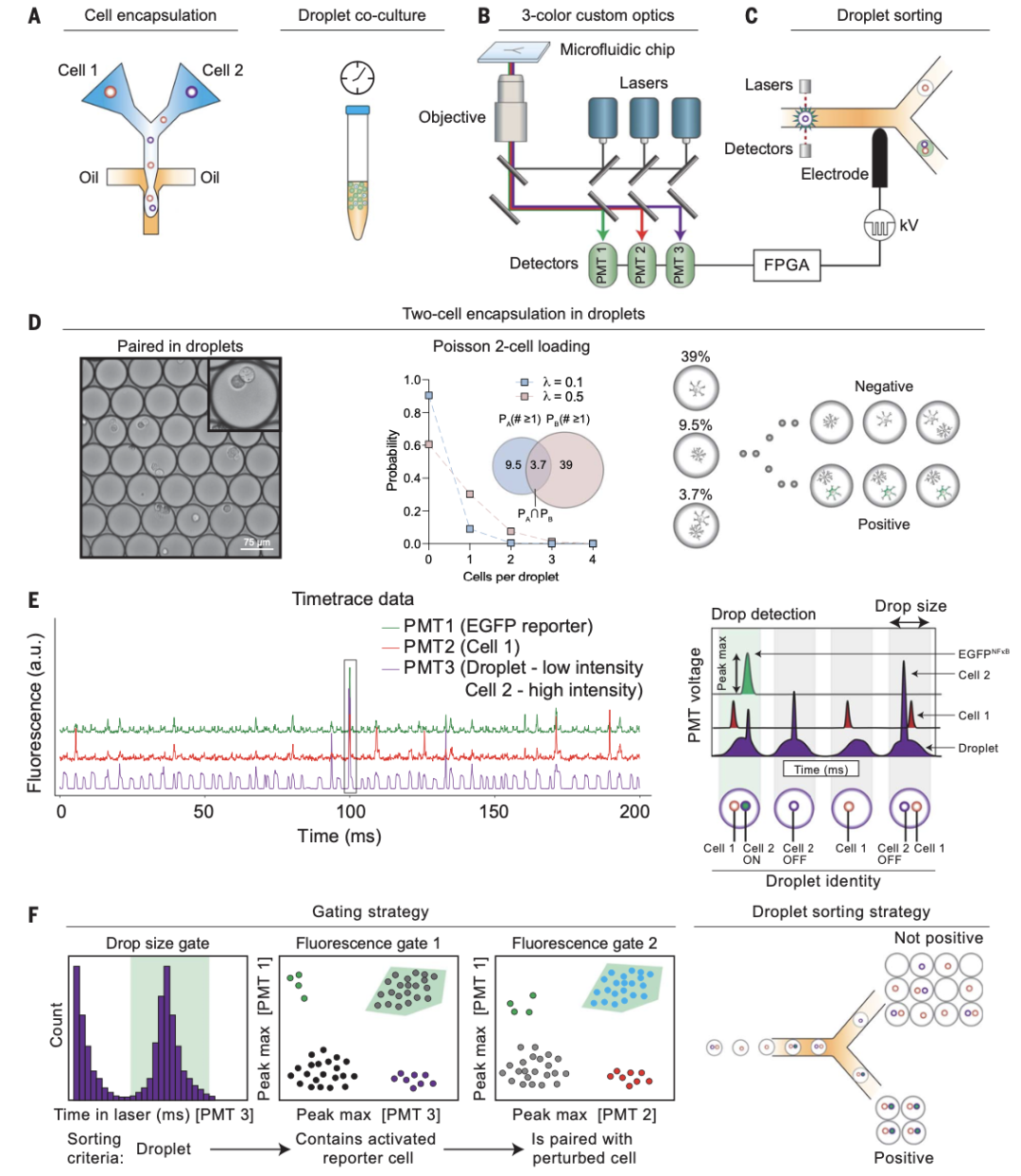
图1 基于液滴微流控技术的细胞互作筛选平台示意图
接下来,研究人员将基于液滴的共培养系统与CRISPR-Cas9基因编辑技术相结合,建立了SPEAC-seq平台,用于检测细胞互作的正向遗传筛选,并将其应用于鉴定参与抑制星形胶质细胞中NF-kB激活的小胶质细胞分泌的细胞因子。研究人员使用全基因组CRISPR-Cas9文库转导原代小鼠小胶质细胞,并使用嘌呤霉素筛选出稳定转导的小胶质细胞,并将其与NF-kB报告的星形胶质细胞共封装24小时,然后分选含有由小胶质细胞和EGFP+星形胶质细胞组成的活细胞对的液滴。
通过基因组DNA聚合酶链反应(PCR)扩增和深度测序从少量分选的液滴中分选出了稳定掺入小胶质细胞基因组DNA的单向导RNA(sgRNA) 序列,用于分析针小胶质细胞中负调节星形胶质细胞NF-kB因子的sgRNA,最终得到了1061个候选分子的列表。对正液滴分数的分析发现了已知的NF-kB信号转导负调节因子,包括异生物质代谢、核受体激活和NRF2信号转导,分选到的液滴数量和检测到的引导RNA序列的数量高度一致。图2G显示了用生信分析发现了SPEAC-seq检测到的抑制星形胶质细胞NF-kB激活的途径。
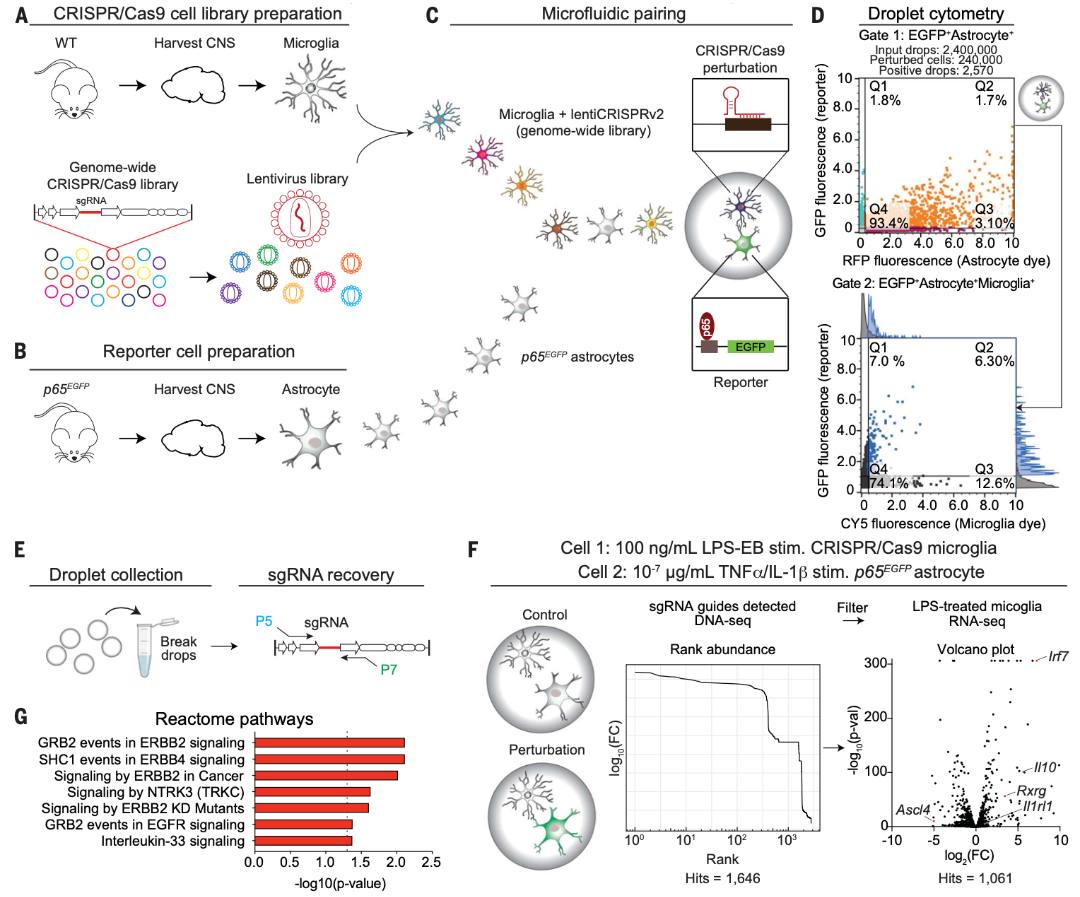
图2 SPEAC-seq鉴定小胶质细胞中抑制星形胶质细胞促炎反应的因子
为了进一步评估SPEAC-seq发现的每个候选通路在炎症环境下的调节作用,研究人员应用了一种细胞类型特异性的体内Perturb-seq方法。研究人员设计了慢病毒载体共表达四种sgRNA,这些sgRNA靶向星胶特异的Cas9开放阅读框中的barcode,分别对应Egfr、Gfra2、Lag3、Oprl1这四种星胶受体。小鼠自身免疫性脑脊髓炎(EAE)造模后,用流式分选出EGFP阳性的星胶胶质细胞进行SPEAC-seq检测。
结果显示,表达Egfr、Gfra2、Lag3或Oprl1的sgRNA的星形胶质细胞NF-kB转录激活增加,Egfr靶向导致IL-1b/TNFa信号通路的激活最强,从而促进NF-kB转导的与EAE和MS相关的星形胶质细胞反应。双调蛋白可在中风期间导致外周和中枢神经系统的炎症,这表明它是在对创伤和/或炎症的反应中被诱导产生的。
确实,EAE诱导后17天检测到小胶质细胞中Areg表达增加。与SPEAC-seq数据一致,Egfr在星形胶质细胞中的表达水平高于在小胶质细胞中的表达水平。以上结果说明了在EAE模型中,小胶质细胞分泌的AREG通过星胶EGFR受体抑制星胶的促炎反应。
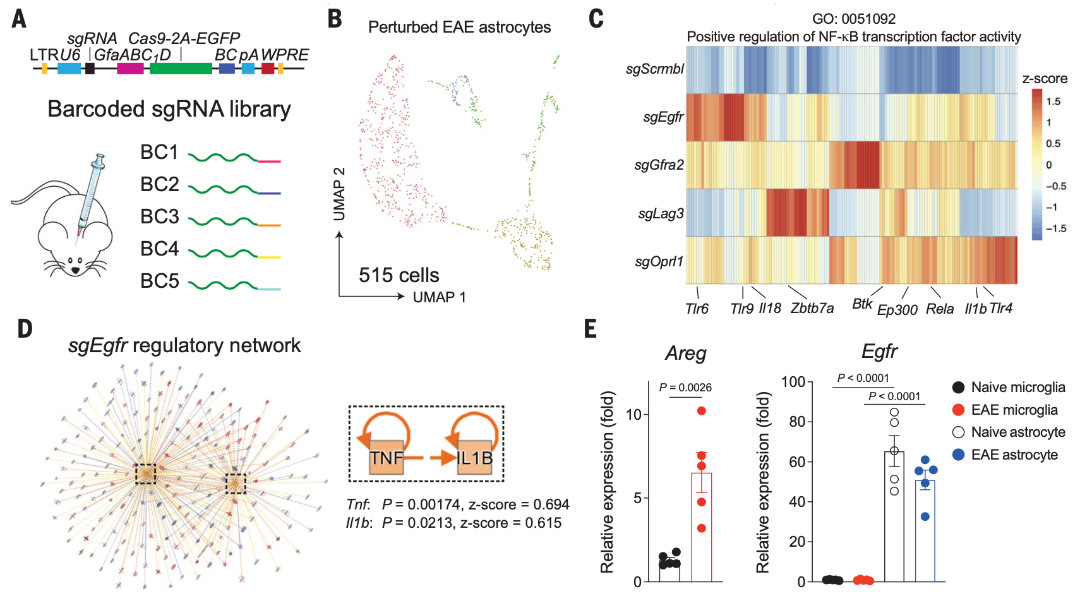
图3 小胶质细胞分泌的AREG抑制星形胶质细胞促炎反应
最后,研究人员想探索EAE期间,什么病理因素可诱导小胶质细胞Areg的表达。已有研究表明IL-33是EAE的抑制剂,Areg表达的诱导剂。IL-33是组织损伤后细胞释放的一种警报素。为了确定IL-33是否调节AREG介导的小胶质细胞-星形胶质细胞互作,研究人员首先重新分析了RABID-seq数据集,并确定了在EAE峰值期间与Areg+和Areg-小胶质细胞相关的小胶质细胞-星形胶质细胞相互作用,提示了EAE期间星胶分泌的IL-33信号是调节Areg+小胶质细胞的上游因子。为了验证这种RABID-seq预测,研究人员在体外用重组IL-33刺激原代小胶质细胞,检测到小胶质细胞Areg/AREG表达增加。这些发现表明星胶产生的IL-33诱导的小胶表达Areg,然后抑制星胶的促炎作用这样的一个负反馈调节。
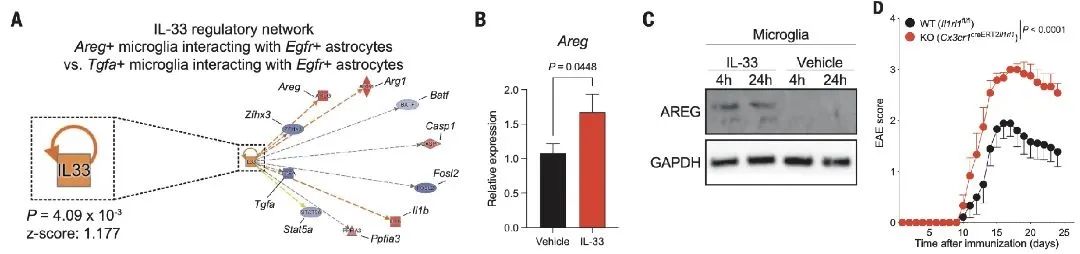
图4 IL-33-ST2信号通路控制星形胶质细胞-小胶质细胞互作
此外,研究人员还在MS患者病变中检测到IL33+GFAP+细胞和AREG+小胶质细胞增加,以及小胶质细胞ST2(IL-33 受体)介导的丝裂原活化蛋白激酶信号增加,以上结果表明了星胶来源的IL-33可促进ST2+小胶细胞中AREG的表达。
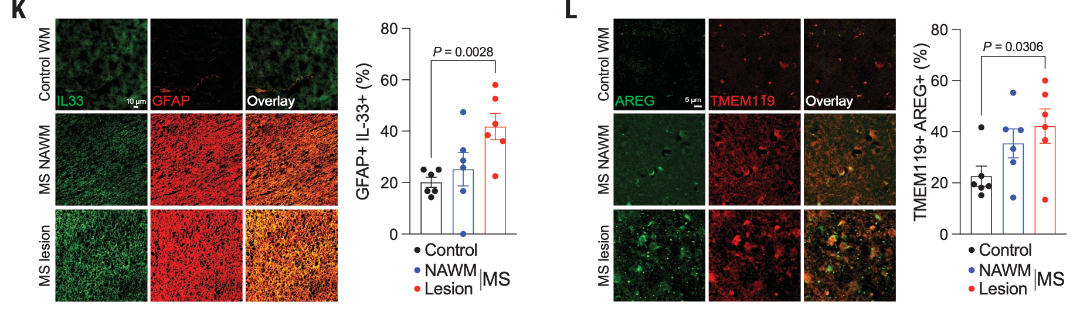
图5 免疫染色检测MS患者CNS样本中的IL33+星形胶质细胞
综上所述,该研究基于液滴微流控技术建立了可以用于检测细胞互作的SPEAC-seq平台,它能够进行正向遗传筛选以识别细胞通讯机制,并确定了一个由小胶质细胞-星形胶质细胞相互作用驱动的调节负反馈回路,该相互作用由双调蛋白和IL33-ST2信号介导,抑制了星形胶质细胞NF-kB驱动的炎症反应,可能是导致EAE和MS的原因之一。SPEAC-seq可以与表观基因组或转录组的全基因组分析相结合,以研究它们通过细胞间相互作用的调控,或与抗体或小分子barcode文库,用于识别细胞间通讯的治疗靶点。
审核编辑:刘清
-
Aigtek高电压放大器微流控细胞筛选测试2025-01-20 713
-
基于双极性电极阵列的微流控芯片,可实现细胞可控、非接触三维旋转2024-03-07 3253
-
如何利用微图案化芯片实现高通量细胞筛选中程序化药物添加2023-10-12 1854
-
一种基于液滴微流控的高通量单细菌细胞RNA测序法介绍2023-09-19 2877
-
PyTorch教程10.7之用于机器翻译的编码器-解码器Seq2Seq2023-06-05 733
-
可用于单细胞分析的选择性液滴提取微流控装置2023-04-10 1698
-
单细胞测序技术实现高通量多重药物筛选2022-12-05 2361
-
基于单细胞与空间转录组数据评估细胞间互作分析算法2022-11-03 1972
-
Live seq允许单细胞的时间转录组记录2022-08-22 1615
-
如何调节表观遗传状态和细胞重编程2022-08-08 1733
-
筛选胰岛细胞技术仍停留在1970年!哈佛研究打破僵局2020-06-01 2425
-
微流控芯片单细胞克隆形成抑制实验用于乳腺癌干细胞特异性药物筛选2019-06-20 6380
-
韩国研究团队开发药物筛选芯片,8小时内识别抗生素的协同相互作用2019-04-25 3696
-
离体培养下的遗传与变异2009-02-17 858
全部0条评论

快来发表一下你的评论吧 !

