

影响库伦效率的新因素—锂离子交换速率
描述
01
导读
尽管锂金属负极有望满足锂离子电池对能量密度的需求,但它还没有实现长循环寿命。良好的SEI在调节电解质和电极之间的Li+交换方面起着关键作用,但这种影响的量化一直不清楚,迄今为止Li+交换和库伦效率(CE)之间的关系还没有明确阐明。
02
成果简介
近期,相关工作以“Beneficial vs. Inhibiting Passivation by the Native Lithium Solid Electrolyte Interphase Revealed by Electrochemical Li+ Exchange”为题发表在Energy & Environmental Science上。该工作利用电化学阻抗谱和伏安法,探究了天然SEIs在一系列电解质(CE范围为78.0%至>99%)中的自洽Li+交换值。结果发现CE与SEI的Li+交换速率呈正相关。此外,在高CE电解质中,SEI Li+的交换速率在循环过程中增加,在某些情况下增加了一个数量级,超过10 mA/cm2,而对于低CE电解质,它们仍然保持在低水平(<1 mA/cm2)。
03
关键创新
Li+交换速率与Li电镀/剥离CE成正相关。
04
核心内容解读
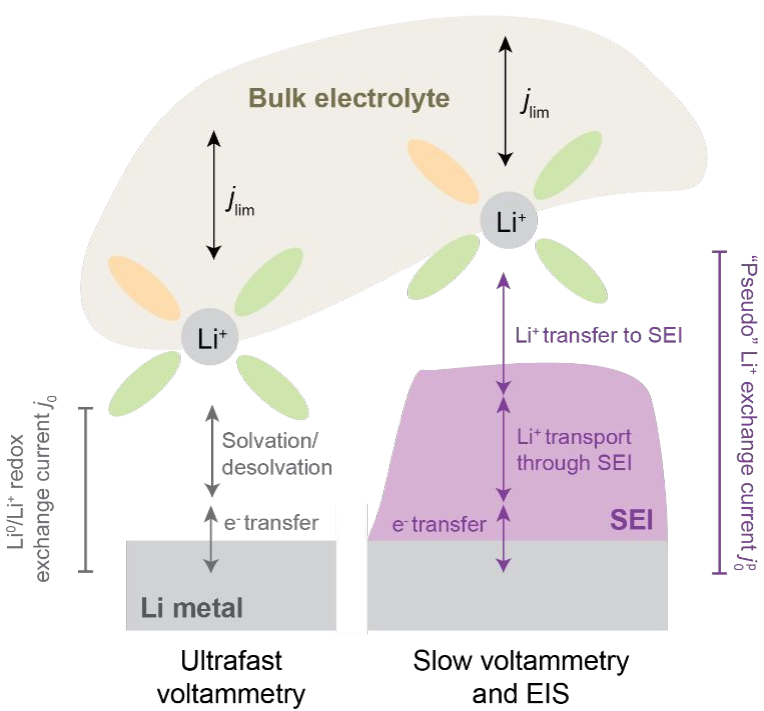
图1. 不存在(左)和存在(右)SEI 情况下,Li0/Li+氧化还原从本体电解质到Li金属电极的过程。
本研究采用慢扫速(1 mV/s)循环伏安法(CV)和电化学阻抗谱(EIS)系统地量化了Li负极上的Li+交换(图1),并在“赝”交换电流jp0的框架下解释了测量的交换速率,它代表了电极上Li+交换总速率。事实上,赝交换电流jp0揭示了Li+交换的瞬态演化。结果发现jp0在不同电解质之间有很大差异,且与CE具有明确的正相关关系。
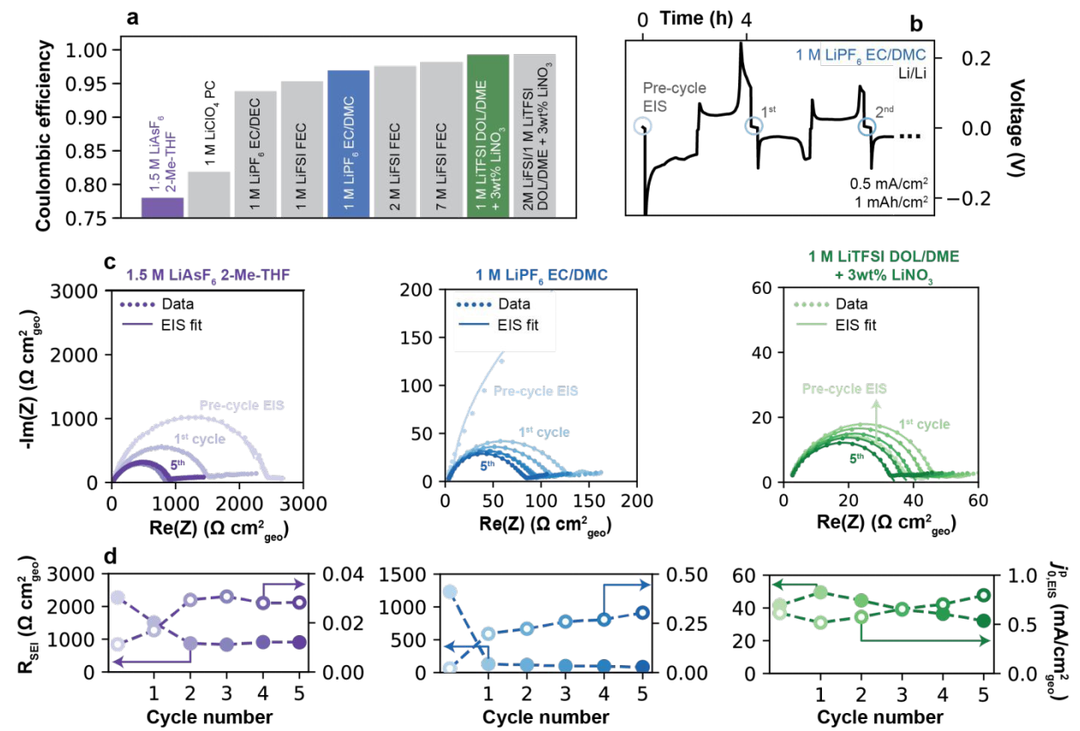
图2.(a)不同电解质的CE。(b)在1M LiPF6 EC/DMC中,Li/Li电池在0.5mA/cm2@1mAh/cm2下的恒流电镀/剥离曲线。(c)在三种电解质(1.5 M LiAsF6 2-Me-THF、1 M LiPF6 EC/DMC和1 M LiTFSI DOL/DME+3wt%LiNO3)中循环前后的奈奎斯特图。(d)通过拟合(c)中的EIS光谱获得SEI电阻和赝交换电流密度,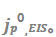
用阻抗谱法测量Li+交换
本工作选择了具有代表性的电解质进行分析(图2a),包括1.5 M LiAsF6 in 2-Me-THF(CE=78.0%),1 M LiClO4 in PC(81.9%),1 M LiPF6 in EC/DEC(93.8%),1 M LiFSI in FEC(95.3%)或1 M LiPF6 in EC/DMC(96.9%),2 M和7 M LiFSI in FEC(CE分别为97.5%和98.2%),以及1 M LiTFSI in DOL/DME和2 M LiFSI/1 M LiTFSI in DOL/DME,每种电解质都含有3wt%的LiNO3(CE分别为99.0%和99.3%)。首先在对称Li/Li电池中使用EIS分析来测量Li+交换电流。图2b显示,电池组装后,在OCV下静置5小时,并进行初始阻抗谱测量。接下来,进行电镀/剥离循环,随后重复该过程。图2c显示了三种代表性电解质在五次这样循环中的EIS数据。5次循环后,不同电解质的RSEI幅度变化显著(图2d),1.5 M LiAsF6 in 2Me-THF最高(第5次循环时为512.6 Ω cm2),其次是1 M LiPF6 in EC/DMC(47.6 Ω cm2)和1 M LiTFSI DOL/DME+3%LiNO3(18.3 Ω cm2)。这三种电解质的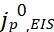 值分别显示出0.03、0.30和0.79 mA/cm2的增加趋势。
值分别显示出0.03、0.30和0.79 mA/cm2的增加趋势。
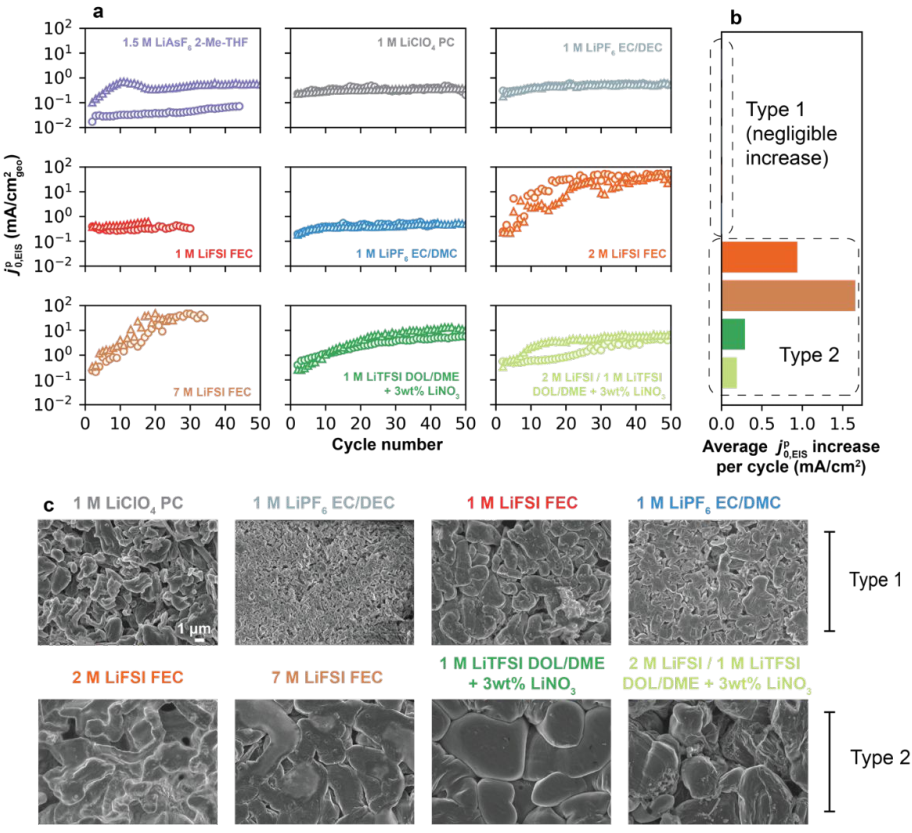
图3.(a)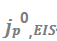 随不同电解质中恒流循环圈数(0.5mA/cm²@1mAh/cm²)的变化。(b)
随不同电解质中恒流循环圈数(0.5mA/cm²@1mAh/cm²)的变化。(b)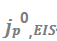 每个循环的平均变化。(c)在每种电解质中5次循环后Li的形貌。
每个循环的平均变化。(c)在每种电解质中5次循环后Li的形貌。
图3a显示了每种电解质在50次循环中的高频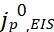 在1型电解质中,
在1型电解质中,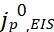 在50次循环中保持稳定,如1.5 M LiAsF6 2-Me-THF、1 M LiClO4 PC、1 M LiPF6 EC/DEC、1 M Li FSI FEC和1 M LiPF6 EC-DMC。然而,在2型电解质(如2M LiFSI FEC、7M LiFSI-FEC、1M LiTFSI DOL/DME+3wt%LiNO3、2M LiFSI 1M LiTFI DOL/DME+3wt%LiNO3)中,
在50次循环中保持稳定,如1.5 M LiAsF6 2-Me-THF、1 M LiClO4 PC、1 M LiPF6 EC/DEC、1 M Li FSI FEC和1 M LiPF6 EC-DMC。然而,在2型电解质(如2M LiFSI FEC、7M LiFSI-FEC、1M LiTFSI DOL/DME+3wt%LiNO3、2M LiFSI 1M LiTFI DOL/DME+3wt%LiNO3)中,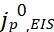 随循环显著增加。这些
随循环显著增加。这些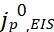 的变化如图3b所示。1型电解质的CE较低,其具有多孔和高纵横比的Li沉积形态(图3c),而2型电解质均呈现致密的Li沉积形貌。
的变化如图3b所示。1型电解质的CE较低,其具有多孔和高纵横比的Li沉积形态(图3c),而2型电解质均呈现致密的Li沉积形貌。
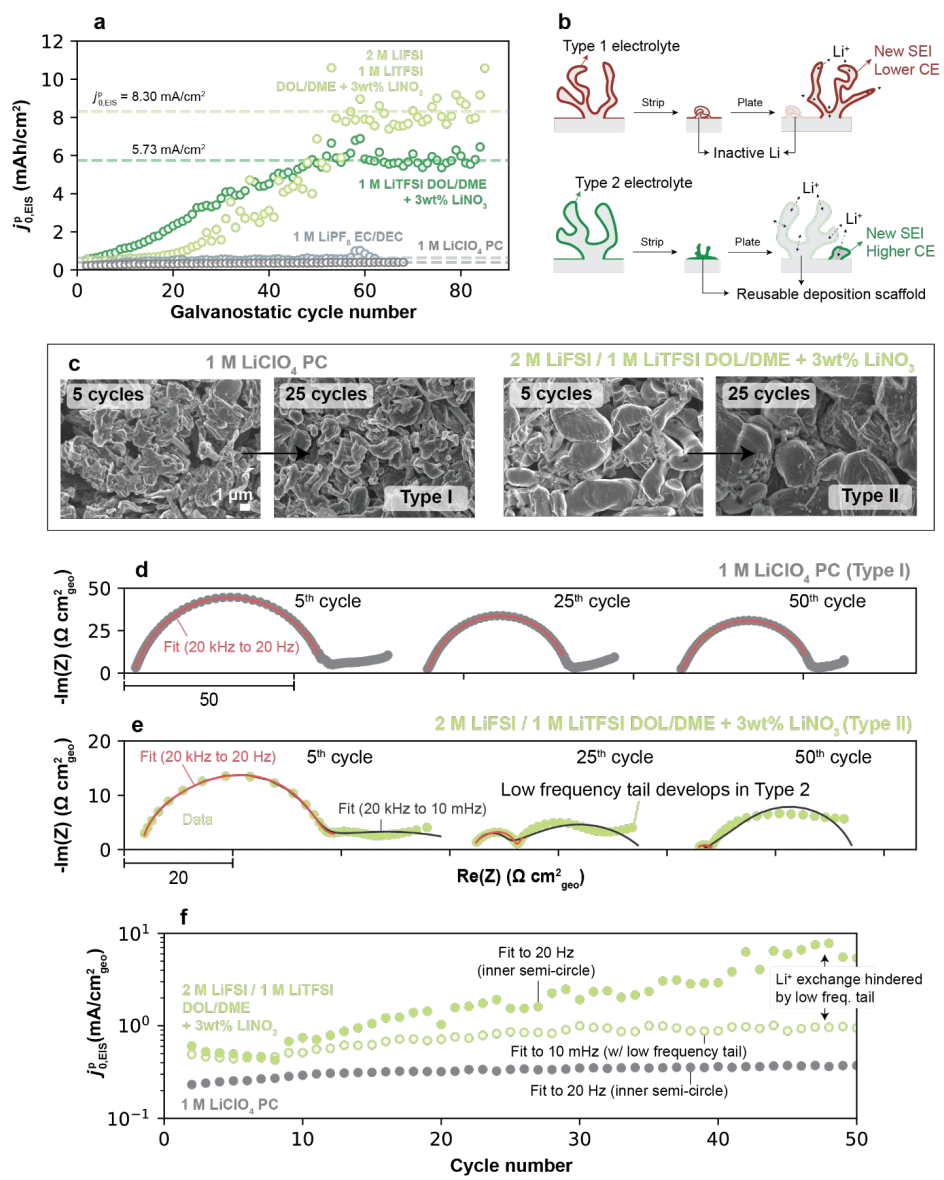
图4.(a)不同电解质中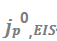 随循环次数的变化。1型和2型电解质中(b)锂沉积机制和(c)5次和25次循环后获得的电镀Li形貌。(d)1型(1M LiClO4 PC)和(e)2型电解质(2M LiFSI/1M LiTFSI DOL/DME+3wt%LiNO3)中EIS光谱的演变。(f)1型和2型电解质的Li+交换率随循环的变化。
随循环次数的变化。1型和2型电解质中(b)锂沉积机制和(c)5次和25次循环后获得的电镀Li形貌。(d)1型(1M LiClO4 PC)和(e)2型电解质(2M LiFSI/1M LiTFSI DOL/DME+3wt%LiNO3)中EIS光谱的演变。(f)1型和2型电解质的Li+交换率随循环的变化。
对于DOL/DME基电解质,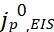 在约10圈进一步增加,最终稳定在约60圈(图4a)。然而,与低CE电解质(1M LiClO4 PC)相比,该稳定值高得多。这可能是因为在低CE电解质中,残留的SEI具有低的Li+交换值,因此在随后的循环中对新沉积Li的优先成核几乎没有优势(图4b)。由于SEI没有被有效地重新利用,因此随后的Li电镀需要在每个循环上重新建立SEI,从而导致较低的CE。而在高CE电解质中,来自先前循环的SEI残留物对于Li电镀可以保持活性。图4c显示,即使在长循环后,2型电解质的Li形貌仍然保持致密,而1型电解质出现高度多孔的Li。在循环过程中,1型电解质的EIS光谱基本保持不变,并以单个半圆的形式持续存在(例如,1M LiClO4 PC,图4d)。而2型电解质显示出更动态的阻抗响应(图4e)。在初始循环阶段,出现高频半圆,带有一个小的低频尾巴。在随后的循环中,这个半圆的幅度显著降低。此外,最初的低频尾巴发展成了一个更大的半圆。当考虑尾巴演变时,
在约10圈进一步增加,最终稳定在约60圈(图4a)。然而,与低CE电解质(1M LiClO4 PC)相比,该稳定值高得多。这可能是因为在低CE电解质中,残留的SEI具有低的Li+交换值,因此在随后的循环中对新沉积Li的优先成核几乎没有优势(图4b)。由于SEI没有被有效地重新利用,因此随后的Li电镀需要在每个循环上重新建立SEI,从而导致较低的CE。而在高CE电解质中,来自先前循环的SEI残留物对于Li电镀可以保持活性。图4c显示,即使在长循环后,2型电解质的Li形貌仍然保持致密,而1型电解质出现高度多孔的Li。在循环过程中,1型电解质的EIS光谱基本保持不变,并以单个半圆的形式持续存在(例如,1M LiClO4 PC,图4d)。而2型电解质显示出更动态的阻抗响应(图4e)。在初始循环阶段,出现高频半圆,带有一个小的低频尾巴。在随后的循环中,这个半圆的幅度显著降低。此外,最初的低频尾巴发展成了一个更大的半圆。当考虑尾巴演变时,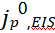 低于未考虑该特征的情况(图4f),表明低频特征在发展过程中可能通过额外的机制阻碍Li+交换,部分抵消了高频下SEI阻抗的下降。
低于未考虑该特征的情况(图4f),表明低频特征在发展过程中可能通过额外的机制阻碍Li+交换,部分抵消了高频下SEI阻抗的下降。
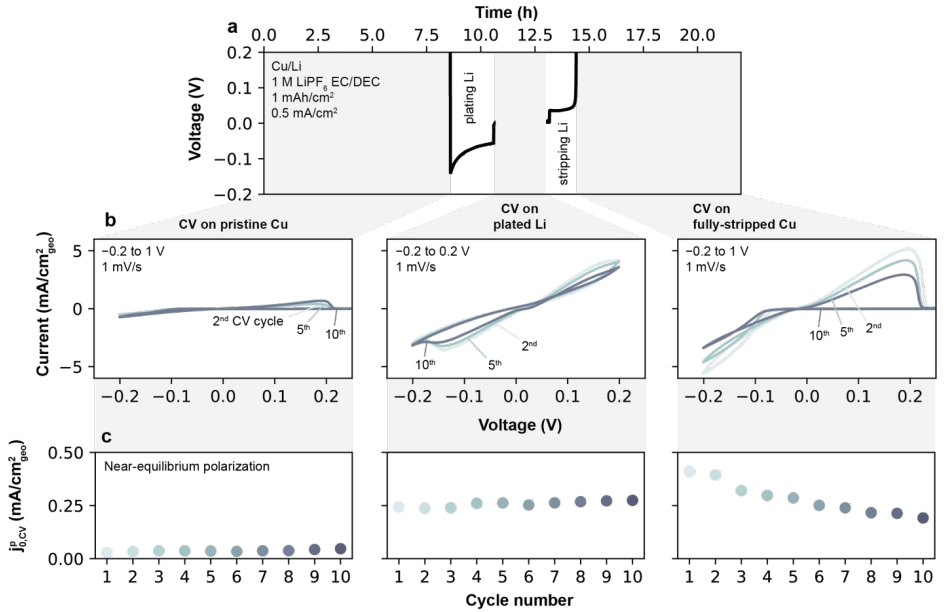
图5.(a)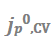 随电极条件(在Cu或电镀Li上)的变化。(b)不同基底上的代表性CV扫描,其中
随电极条件(在Cu或电镀Li上)的变化。(b)不同基底上的代表性CV扫描,其中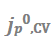 在每次反向扫描时获得。(c)
在每次反向扫描时获得。(c)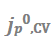 随CV循环数的变化。
随CV循环数的变化。
循环伏安法测定Li+交换
图5a显示,在-0.2V和1V之间以1mV/s的速度在Cu/Li扣式电池中进行11次连续的CV循环,在每次扫描结束时发生Cu的完全剥离。单个CV扫描为赝Li+交换电流提供了一个数据点,称之为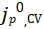 在1M LiPF6 EC/DEC电解质中,原始Cu上的电流-电压曲线(图5b)显示出金属沉积到惰性基底上的行为。负扫时,首先在Cu上镀Li,需要约100 mV的过电位。在反向扫描中,Li继续被镀在Cu上,直到电压超过平衡电位(E0),之后Li从Cu中剥离。在这些条件下,由于在正扫期间预先镀有Li,Cu/Li电池表现为对称电池,因此显示出对称的电势-电流关系。
在1M LiPF6 EC/DEC电解质中,原始Cu上的电流-电压曲线(图5b)显示出金属沉积到惰性基底上的行为。负扫时,首先在Cu上镀Li,需要约100 mV的过电位。在反向扫描中,Li继续被镀在Cu上,直到电压超过平衡电位(E0),之后Li从Cu中剥离。在这些条件下,由于在正扫期间预先镀有Li,Cu/Li电池表现为对称电池,因此显示出对称的电势-电流关系。
在反扫的低电镀/剥离过电位窗口(<20mV)下,阳极和阴极电流较小(<0.2mA/cm2),并且电流对过电位表现出线性响应。通过该方法确定的原始、镀Li和完全剥离的Cu集流体的Li+交换如图5c所示。在1M LiPF6 EC/DEC中,原始Cu电极的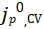 很低(0.02mA/cm2),但在Li被镀在电极上之后显著增加并稳定到平均0.26mA/cm2。在Li被剥光之后,与原始Cu电极相比,
很低(0.02mA/cm2),但在Li被镀在电极上之后显著增加并稳定到平均0.26mA/cm2。在Li被剥光之后,与原始Cu电极相比,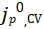 保持更类似于镀Li电极的电流。总之,这些结果证实了Li电镀行为强烈依赖于表面处理及其历史。
保持更类似于镀Li电极的电流。总之,这些结果证实了Li电镀行为强烈依赖于表面处理及其历史。
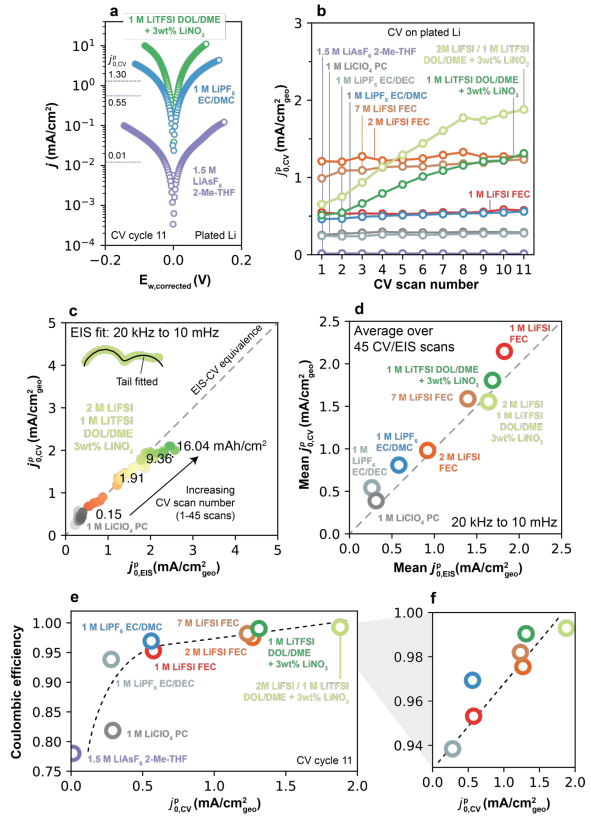
图6.(a)通过在1 mAh/cm2的电镀Li上以1 mV/s的CV测量选定电解质的Tafel图。(b)所有电解质中沉积锂上的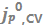 随CV扫描数的变化。(c)通过CV和EIS测量的Li+交换之间的等效性。(d)所有电解质的平均
随CV扫描数的变化。(c)通过CV和EIS测量的Li+交换之间的等效性。(d)所有电解质的平均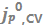 和
和 (e)本研究中的电解质CE-
(e)本研究中的电解质CE-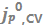 的关系。(f)(e)在较高CE范围内的放大图。
的关系。(f)(e)在较高CE范围内的放大图。
在平衡电压附近更陡的j-Ew,corrected关系表明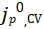 更高。对于所有电解质,j-Ew,corrected关系显示了在高过电位下的典型Tafel行为,即线性Ew,corrected-logj行为。所有电解质的
更高。对于所有电解质,j-Ew,corrected关系显示了在高过电位下的典型Tafel行为,即线性Ew,corrected-logj行为。所有电解质的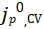 随CV扫描数的变化如图6b所示。第一次扫描的
随CV扫描数的变化如图6b所示。第一次扫描的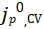 值范围从非常低(1.5M LiAsF6 2-Me-THF的0.01mA/cm2)到2M LiFSI FEC的1.21mA/cm2。在低CE电解质中,
值范围从非常低(1.5M LiAsF6 2-Me-THF的0.01mA/cm2)到2M LiFSI FEC的1.21mA/cm2。在低CE电解质中,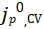 随CV扫描数保持大致恒定。相比之下,较高CE的电解质每次CV扫描后,
随CV扫描数保持大致恒定。相比之下,较高CE的电解质每次CV扫描后,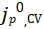 持续小幅增加。在2型电解质中,基于DOL/DME的体系显示出最高的
持续小幅增加。在2型电解质中,基于DOL/DME的体系显示出最高的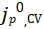 与
与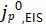 形成对比, 其中2M和7M LiFSI FEC电解质显示出最高的
形成对比, 其中2M和7M LiFSI FEC电解质显示出最高的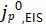 为了更系统地评估,在Li/Li电池中进行了额外的实验以测量
为了更系统地评估,在Li/Li电池中进行了额外的实验以测量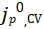 与
与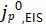 在这些条件下,这些值显示出良好的定量对应关系(图6c-d)。值得注意的是,回到图6a-b中的电镀Li测量(即,单个恒流电镀步骤后的CV),在所有扫描结束时观察到CE和
在这些条件下,这些值显示出良好的定量对应关系(图6c-d)。值得注意的是,回到图6a-b中的电镀Li测量(即,单个恒流电镀步骤后的CV),在所有扫描结束时观察到CE和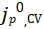 之间的正相关关系(图6e-f)。这表明,快速的Li+交换是区分高CE电解质和低CE电解质的关键特性。
之间的正相关关系(图6e-f)。这表明,快速的Li+交换是区分高CE电解质和低CE电解质的关键特性。
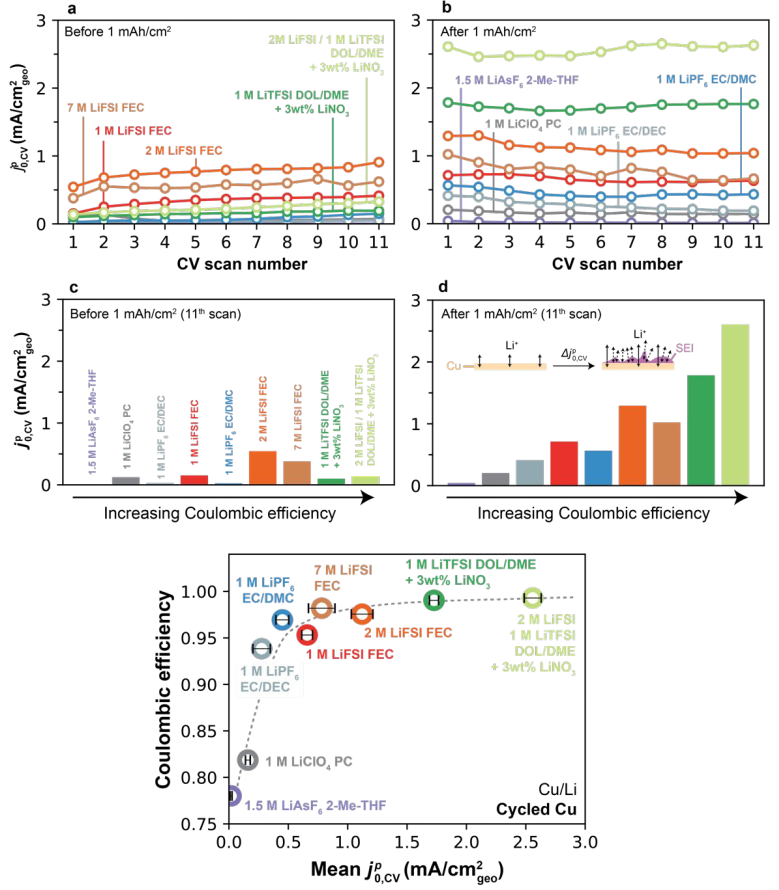
图7.(a)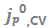 随原始Cu上CV扫描数的变化。(b)
随原始Cu上CV扫描数的变化。(b)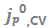 随循环Cu上CV扫描数的变化。(c)在1mAh/cm2恒流化成循环之前,Cu上第11次CV扫描后测量的
随循环Cu上CV扫描数的变化。(c)在1mAh/cm2恒流化成循环之前,Cu上第11次CV扫描后测量的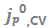 。(d)在1mAh/cm2恒流化成循环之后,Cu上第11次CV扫描后测量的
。(d)在1mAh/cm2恒流化成循环之后,Cu上第11次CV扫描后测量的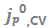 。(e)循环Cu上Li的CE随平均
。(e)循环Cu上Li的CE随平均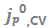 的变化。
的变化。
SEI形成后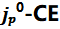 关系的出现
关系的出现
图7a显示所有电解质中原始Cu上前11次CV扫描的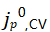 。在1 mAh/cm2的恒流循环之后(图7b),在某些电解质中观察到Li+交换明显提高。在1mAh/cm2电镀步骤之前,在Cu上没有发现
。在1 mAh/cm2的恒流循环之后(图7b),在某些电解质中观察到Li+交换明显提高。在1mAh/cm2电镀步骤之前,在Cu上没有发现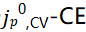 相关性(图7c),这与电镀后的Cu形成了对比,在电镀后观察到强烈的
相关性(图7c),这与电镀后的Cu形成了对比,在电镀后观察到强烈的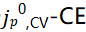 单调相关性。这表明,与Li的趋势类似,更高的CE电解质在修饰Cu/电解质界面方面也更有效。重要的是,即使在底层Li完全剥离后,这种效应仍然存在,表明SEI-Li+交换导致了这种趋势。相反,低CE电解质在预沉积Cu和剥离Cu之间显示出最小的Li+交换差异,表明即使在1 mAh/cm2循环之后,在Cu上形成的SEI在这些电解质中也是无效的。图7e中充分总结了剥离后Cu上定量的
单调相关性。这表明,与Li的趋势类似,更高的CE电解质在修饰Cu/电解质界面方面也更有效。重要的是,即使在底层Li完全剥离后,这种效应仍然存在,表明SEI-Li+交换导致了这种趋势。相反,低CE电解质在预沉积Cu和剥离Cu之间显示出最小的Li+交换差异,表明即使在1 mAh/cm2循环之后,在Cu上形成的SEI在这些电解质中也是无效的。图7e中充分总结了剥离后Cu上定量的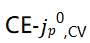 单调关系。即使在经历重复的1 mAh/cm2电镀/剥离循环时,1型电解质也显示出预期的稳定行为。
单调关系。即使在经历重复的1 mAh/cm2电镀/剥离循环时,1型电解质也显示出预期的稳定行为。
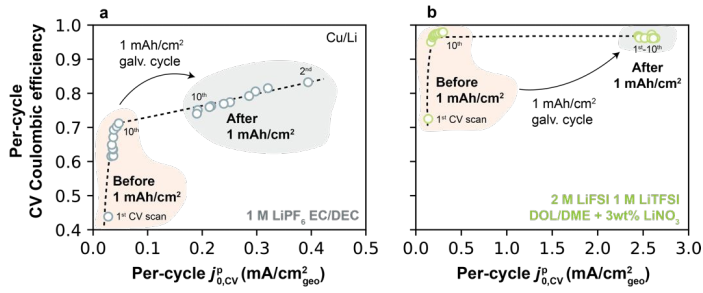
图8.在(a)1M LiPF6 EC/DEC和(b)2M LiFSI 1M LiTFSI DOL/DME+3wt%LiNO3中完整的1 mAh/cm2恒流循环之前和之后,通过Cu上的CV获得每个循环的CE和 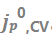
图8a和图8b分别显示了1M LiPF6 EC/DEC(1型电解质)和2M LiFSI 1M LiTFSI DOL/DME+3wt%LiNO3(2型电解质)中的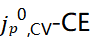 关系。对于1型电解质,1-10次循环中CE随着
关系。对于1型电解质,1-10次循环中CE随着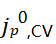 增加而单调增加。在1mAh/cm2恒流循环之后,
增加而单调增加。在1mAh/cm2恒流循环之后,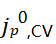 表现出阶跃变化增加到更高的值,并伴随着CE的改善。在2型电解质中观察到类似的行为,并没有观察到更高的CE和
表现出阶跃变化增加到更高的值,并伴随着CE的改善。在2型电解质中观察到类似的行为,并没有观察到更高的CE和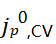 。这些结果表明,CE也与每个循环的Li+交换密切相关。
。这些结果表明,CE也与每个循环的Li+交换密切相关。
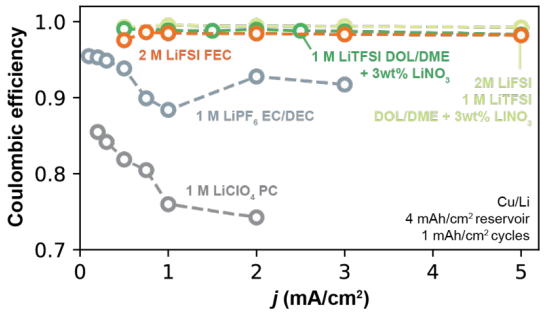
图9.1型电解质和2型电解质中CE随倍率的变化。
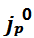 对Li倍率性能的影响
对Li倍率性能的影响
1型碳酸盐电解质(1M LiPF6 EC/DEC和1M LiClO4 PC)中的CE随着j的增加而不太稳定,与j<0.5 mA/cm2时的CE值相比,在高j时表现出普遍下降。这种行为在1M LiClO4 PC中最为明显,其中CE在0.2mA/cm2和2mA/cm2之间从87.1%降低到76.9%。另一方面,2型电解质(2M LiFSI FEC和DOL/DME基电解质)的CE值不随循环电流j变化。
在1M LiClO4 PC和1M LiPF6 EC/DEC中,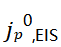 分别不超过0.25mA/cm2和0.55mA/cm2;当施加的电流密度超过这些值时,这些电解质的CE显著降低。而2型电解质的SEI在这些系统中可以容忍极端的Li+交换速率,其可以很容易地超过5mA/cm2。
分别不超过0.25mA/cm2和0.55mA/cm2;当施加的电流密度超过这些值时,这些电解质的CE显著降低。而2型电解质的SEI在这些系统中可以容忍极端的Li+交换速率,其可以很容易地超过5mA/cm2。
05
成果启示
本工作使用EIS和CV两种技术,在低CE和高CE电解质中,对天然SEI的总Li+交换速率进行了量化。低CE电解质通常表现出稳定和适度的Li+交换速率(<1 mA/cm2)。而高CE电解质表现出更高的总Li+交换速率,并在循环过程中进一步增加。这表明CE和Li+交换之间存在正相关性。研究结果还表明,与循环后的铜相比,未循环铜的Li+交换更缓慢,原始铜的CE更低。这些发现有望指导未来的电解质设计,以最大限度地优化SEI相,促进Li+交换过程。
审核编辑:刘清
-
锂离子电池的性能2013-06-13 5488
-
采用离子交换技术改善抗燃油品质的探讨2009-11-01 1011
-
离子交换除盐水处理器的失效控制2010-02-04 488
-
离子交换树脂的原理及其应用2009-11-19 5281
-
转换速率,转换速率是什么意思2010-03-22 9048
-
离子交换器结构图,离子交换器再生原理2017-10-20 32114
-
阳离子交换器作用及工作原理2017-10-26 18948
-
玻璃基离子交换技术光集成器件研究及相关技术的解析2017-11-30 767
-
离子交换柱橡胶衬层腐蚀如何解决2021-05-12 991
-
离子交换柱内衬损坏用什么材料修补2021-07-01 1140
-
离子交换柱的工作原理2021-08-16 8849
-
离子交换柱内衬开裂如何快速修补2022-02-17 1128
-
离子交换柱橡胶层损坏如何修复?最有效的竟然最简单2021-06-30 1443
-
离子交换柱橡胶层渗漏如何及时修补2022-12-27 1259
-
玻璃基离子交换型和熔融拉锥型多模光分路器对比2023-11-02 457
全部0条评论

快来发表一下你的评论吧 !

