

基于载酶金属有机框架的微流控平台实现单细胞代谢物分析
描述
据麦姆斯咨询报道,近日,南京大学宋玉君教授团队开发了一种高通量的单细胞微流控平台,并结合载酶金属有机框架,用于实时无损监测单细胞内外的代谢物浓度。同时基于癌细胞特有的有氧糖酵解代谢特性,该平台实现了高效的癌细胞识别及其远端成瘤能力评估。
超过90%的癌症相关死亡是由肿瘤转移引起的。转移是一个复杂的过程,包括原发肿瘤细胞的脱落、內渗进入循环系统、在循环系统中迁移、外渗到靶器官以及定植形成微转移。事实上,只有<0.1%的循环肿瘤细胞(CTC)最终定殖成功。研究表明,癌细胞的“瓦博格效应(Warburg effect)”在肿瘤的定殖中起着关键作用,因为癌细胞分泌的大量乳酸有助于免疫逃避、细胞迁移和血管形成等,从而促进继发性肿瘤的发展。因此,在单细胞层面实现癌细胞的“糖代谢”特征分析,对于评估癌细胞远端成瘤能力具有重要意义。
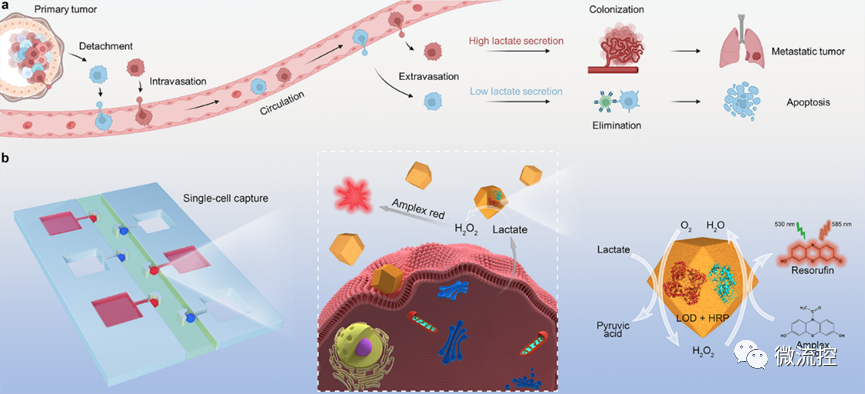
图1 基于微流控芯片的单细胞乳酸代谢分析
为此,研究团队设计了一种阵列式微流控芯片,实现了>99%的单细胞捕获效率,并借助氟化液构建了无交叉污染的单细胞微环境,用于模拟外渗过程中的肿瘤微环境。进一步利用负载葡萄糖氧化酶或乳酸氧化酶的金属有机框架及相应荧光探针,实现了细胞内外的代谢物浓度的半定量可视化分析,进而评估单细胞的成瘤能力。
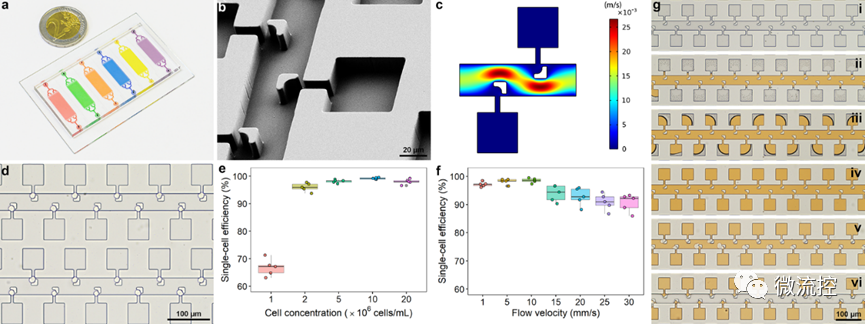
图2 微流控芯片上单细胞微环境的构建
基于该微流控平台,研究团队分析了正常乳腺上皮细胞MCF-10A、弱转移能力的乳腺癌细胞MCF-7、强转移能力的乳腺癌细胞MDA-MB-231,以及乳酸抑制药物处理过的乳腺癌细胞的“糖代谢”特征。微流控芯片上的大规模统计分析结果与小鼠尾静脉转移瘤模型一致,验证了该平台用于癌细胞代谢分析及成瘤能力评估的可行性。
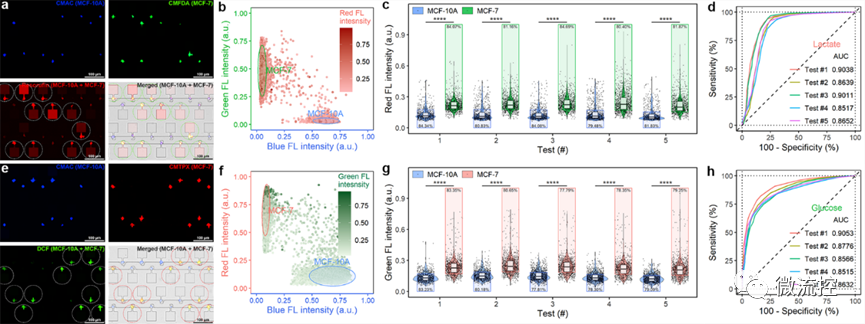
图3 不同细胞成瘤能力的分析
此外,该微流控平台可直接用于捕获分析未经处理的全血样本中的循环肿瘤细胞,肿瘤细胞的捕获率可达80%以上,根据单细胞“糖代谢”特征检测肿瘤细胞的灵敏度高达95%以上,具有较高的临床应用潜力。
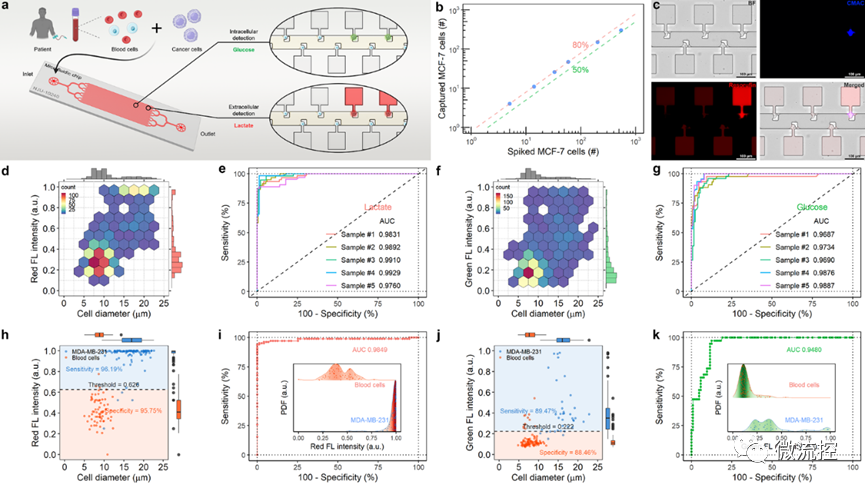
图4 全血样本中的癌细胞检测分析
总之,这种高通量的微流控平台在单细胞无损检测和长期监测方面具有巨大应用潜力。不仅可以用于临床稀有细胞的代谢物分析,还可以实现单细胞层面的药效评估,对于精准医疗和液体活检具有重要的启发意义。
审核编辑:刘清
-
乳酸代谢物的全新概念生物传感器介绍2020-08-03 2029
-
微流控芯片在单细胞捕获中的应用2019-04-08 9318
-
微流控芯片单细胞克隆形成抑制实验用于乳腺癌干细胞特异性药物筛选2019-06-20 6403
-
生物传感器提供更简单代谢物检测解决方案2020-12-26 1077
-
微流控耦合高分辨质谱技术检测单个细胞内代谢物2022-10-14 2269
-
微流控芯片-质谱联用技术在细胞代谢和药物代谢方面的应用2022-10-17 3203
-
中国科学院福建物质结构研究所:开发用于检测汗液代谢物的可穿戴金属有机框架传感器2022-10-30 1289
-
基于微流控平台的单细胞通讯研究进展2022-11-29 1684
-
可用于单细胞分析的选择性液滴提取微流控装置2023-04-10 1728
-
北京基因组所开发出新型高通量单细胞多组学技术2023-04-20 1970
-
使用 RAPIDS 进行更快的单细胞分析2023-07-05 1371
-
中国科学院:开发新型荧光RNA传感器,能监测代谢物、外源药物、蛋白与金属离子等靶标!2023-08-01 2163
-
一种用于测量单细胞瞬态响应的封闭式微流控芯片2023-08-03 758
-
用于单细胞谱系追踪图像引导的微流控系统2023-08-18 2037
全部0条评论

快来发表一下你的评论吧 !

