

基于微流控的原位扩增助力核酸定量更快、更准、更细致
描述
荧光定量PCR(qPCR)是目前应用最广泛的定量PCR技术,然而在接近单分子的核酸浓度下,qPCR的无法实现绝对定量,而更先进的数字PCR(dPCR)手段又存在成本高、耗时长、只能检测低浓度样本等限制。本文通过在硅基微流控芯片上进行PCR反应,讨论了单分子的“原位扩增”现象的科学性和价值,利用原位扩增(在芯片上分子扩散局域化)现象实现了排除非特异性扩增、模板分辨和高灵敏度核酸检测等应用。研究综合了qPCR和dPCR两者之长处,完成了ct值和绝对浓度之间的关联,达到了从单分子等级到高浓度模板的超大浓度范围分子检测,对于快速精确定量未知浓度的核酸样本提供了新的方法。
该团队创新地使用了硅基微流控进行核酸扩增反应,利用高效帕尔贴技术、硅片隔热设计和硅片的快速导热特性,使得通常需要1-2小时的PCR反应在数分钟内完成(图1)。有趣的是,在模板浓度足够低的情况下,微流控芯片内的核酸扩增并不均匀:部分流道区域有扩增现象,而有的区域完全没有扩增。团队将这种现象命名为“on-site PCR(osPCR),即原位扩增”现象(图2)。
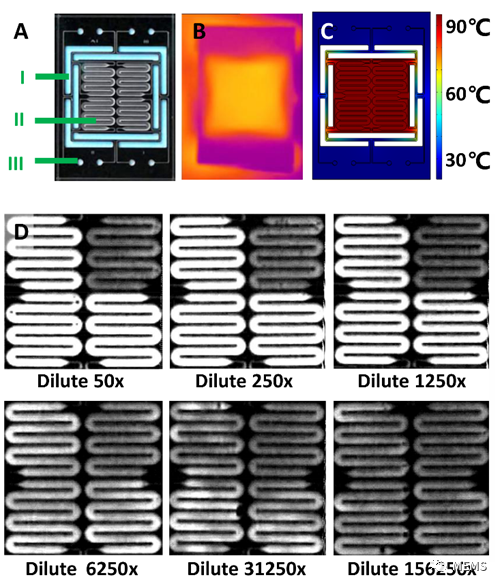
图1 硅基微流控PCR系统(a)微流控芯片(b)加热红外图(c)加热热学仿真(d)不同浓度模板扩增结果,每张图右上角为阴性对照。
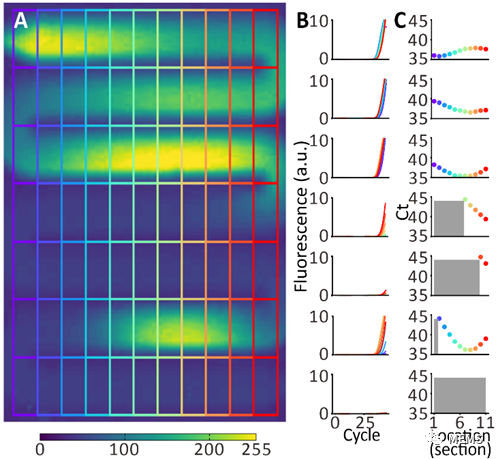
图2 原位扩增现象分析(a)将不均匀流道拆分示意图(b)每个拆分区域的荧光扩增信号(c)每个拆分区域的ct值,灰色代表没有ct。
团队对于osPCR现象进行了深入的研究,显示“原位扩增”的点位来自于单个模板分子。团队发现,原位扩增的点位数量和实际模板浓度正相关。对于同一芯片上,每一个扩增点位的ct基本一致,显示其初始模板量一致。研究团队假设大多数点位只有一个模板分子而计算出了相对应的模板浓度,该模板浓度与数字PCR得到的模板浓度吻合,证明了原位扩增现象可以像数字PCR一样进行核酸的绝对定量(图3)。
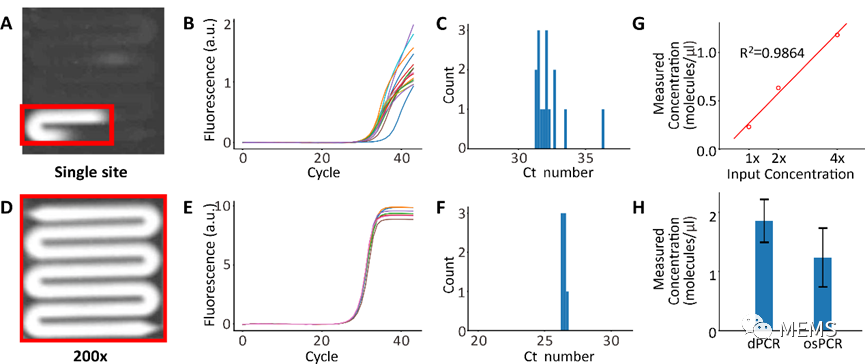
图3 原位扩增来自单分子扩增(a-c)对于单个扩增点位的代表性照片(a)、扩增曲线(b)和ct分布(c) (d-f)对于均匀扩增流道的代表性照片(d)、扩增曲线(e)和ct分布(f)(g)原位扩增手段测试的模板浓度和实际浓度对比 (h)原位扩增手段测试的模板浓度和数字PCR测试浓度对比。
该研究团队利用原位扩增现象首次实现了区分不同模板分子。团队混合了两种不同长度的模板同时扩增,原位扩增系统精准分辨出了不同的模板,并可以对各模板分别定量,甚至确认两种模板的浓度比例(图4)。利用这种对不同模板分子的区分能力,团队展示了在低模板浓度时对非特异性扩增产物(如引物二聚体)的剔除。传统qPCR在低模板浓度时容易出现由于副产物导致的ct值变化,而微流控系统可以剔除副产物信号,在有引物二聚体出现的时候,依然可以得到准确的ct值(图5)。

图4 利用原位扩增分辨模板(a)扩增图片(b)熔解图片(c)各点位扩增曲线图(d)各点位熔解曲线原始图和(e)各点位熔解曲线导数图。
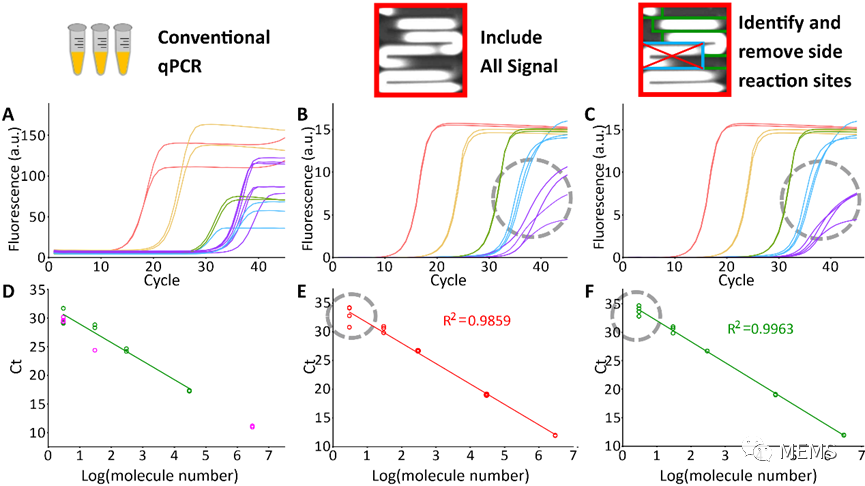
图5 利用原位扩增去除副产物精确定量(a)不同浓度样本传统qPCR扩增曲线(b)不同浓度样本原位PCR不剔除副产物扩增曲线(c)不同浓度样本原位PCR剔除副产物扩增曲线(d-e)a-c的ct线型图。
研究团队将该系统应用于新冠临床样本检测中,并针对性地开发了可以大幅度提升检测灵敏度的滑窗算法。在新冠检测中,微流控系统成功地检出了所有传统qPCR检出的样本(图6)。更重要的是,在两个传统qPCR检测结果模糊的样本上,原位扩增系统都确认了样本阳性,与临床结果一致(表1)。因此,原位扩增系统有望在核酸检测中作为传统qPCR的扩展。
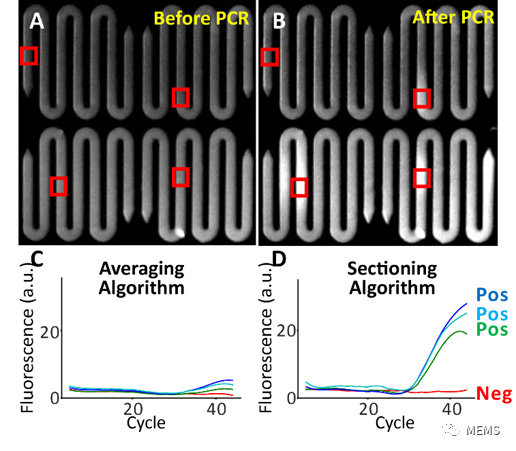
图6 利用原为扩增进行临床(a)PCR前照片(b)PCR后照片。红色区域显示滑窗算法关注位置。(c)使用传统算法的扩增曲线和(d)使用滑窗算法的扩增曲线。
表1 传统qPCR和原位扩增系统检测效果对比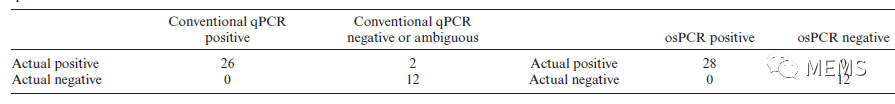
本文第一作者丁睿骅博士介绍道:“我们的技术将qPCR和dPCR进行了有机结合,将ct值对应的相对浓度和绝对模板数量进行了联系。通过微流控的设计,我们不使用微孔或液滴手段也可以分离模板,达到数字PCR的效果。同时,对于每个扩增区域的分析使得我们可以有效剔除副产物,这使得我们的技术可以从根本上解决非特异性扩增在核酸定量中的影响,从而对于微量样本达到更精确的定量。”
本文核心作者之一上海市实验医学研究院院长王华梁院长介绍道:“本方法的最大优势主要是速度快,检测线性范围大,所以适合于任何需要检测灵敏度高,快速出结果的场景。其中的原位扩增与以前的in situ的杂交反应是不同的,这个on site的技术凸显的是PCR的过程,具有新的科学意义,也使得qPCR的反应体系能够呈现出dPCR的效果。”
本文通讯作者田桢干主任介绍道:“相较于传统手段,新技术检测速度更快,同时具有更高的灵敏度,该项新技术的应用将极大地提升口岸的检测效率。我们相信这种技术将会在未来持续发展,为我们的口岸现场快速检测工作带来更多的便利。”
本文通讯作者刘博博士介绍道:“本文是利用半导体芯片技术来实现超快PCR检测,利用了芯片高加工精度、高可靠以及硅材料的高热导性等特性。当芯片技术应用到生命科学研究课题中的时候,往往会有一些令人意想不到的惊喜,比如利用硅基核酸检测芯片我们发现不光实现了快速核酸检测,还由于硅基核酸芯片中分子扩散局域化的特征,在低拷贝数的情况下还能实现同数字PCR一样的绝对定量,这也是信息技术同生物技术交叉融合所带来新的发现,同时团队在完成核酸检测芯片研发过程中还打通了不同材料异质集成封装的全链条。驷格生物作为一家致力于利用信息技术服务生命科学的创新型企业,将继续深耕芯片微纳制造领域,结合不同应用端未来还将带来更多的创新产品和技术。”
本文通讯作者陈昌博士介绍道:“本文的工作是非常典型的生物与信息技术跨界融合的代表,我们将具有特殊热学设计的微纳硅基芯片应用在核酸扩增领域,不仅能实现生物反应的加速,而且还能额外实现单分子水平的不同靶标鉴定。同时,我们也是学术界和产业界的一个非常好的跨界合作,上海大学微电子学院的研究生、驷格生物的技术人员能够在工研院和微系统所的产学研协同创新体系中得到成长,前沿技术能够与现实应用充分结合。”
审核编辑:刘清
-
请问一下25千兆以太网怎样让网络更快更智能?2021-05-18 1943
-
智能助理兴起 智慧家庭平台经济更细致与多元2017-02-23 1111
-
一种应用于核酸超敏检测的CRISPR-Cas9链取代扩增技术2018-12-10 5437
-
泰克推出新一代中端示波器,主打“更快”、“更准”、“使用无忧”2019-06-05 5212
-
手工提取核酸有什么风险,自动核酸提取仪的优势说明2021-04-25 3812
-
非洲猪瘟荧光定量pcr仪有什么特点?2021-09-27 803
-
基于环介导等温扩增的纸基核酸快速检测2022-10-12 2903
-
多点ToF技术助力投影仪无感对焦和梯校2023-05-19 4537
-
做了三年核酸,你知道核酸检测用的“芯片”吗?2022-12-19 1955
-
介绍一种高灵敏度多靶标核酸检测微流控芯片2023-08-16 2573
-
让“可靠”变得“更快更安全”的数据传输协议:SCTP2023-12-28 2617
全部0条评论

快来发表一下你的评论吧 !

