

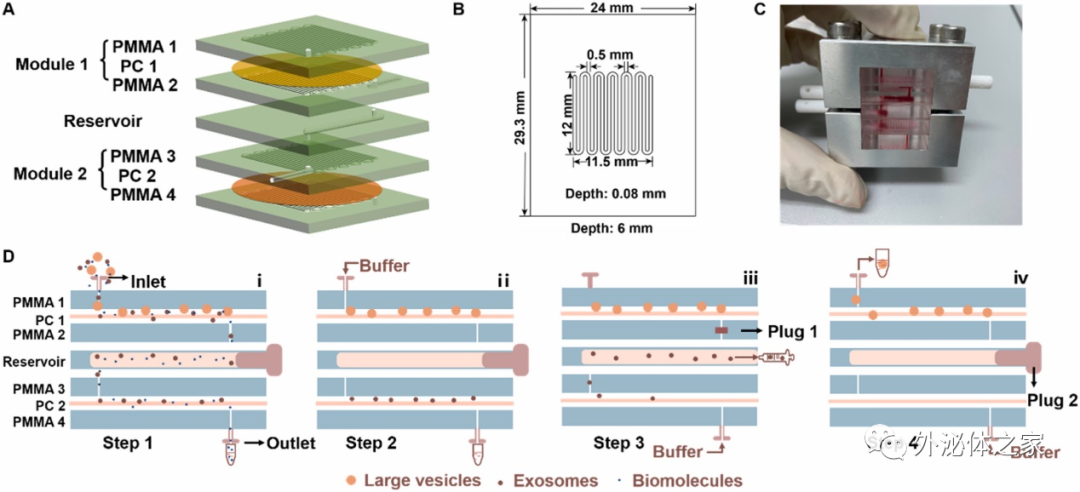
基于双切向流的微流控分离装置,实现外泌体的高效分离与富集
描述
外泌体(exosomes,EXOs)是一种直径在40 nm-200 nm之间的具有磷脂双分子层结构的囊泡。目前,科研人员已经从各种体液,如精液、血液、尿液、唾液、母乳、羊水、腹水、脑脊液以及胆汁中分离出了具有外泌体特征的囊泡。同时,外泌体作为一种功能性的囊泡,包含了丰富的来自母体细胞的分子信息,例如DNA、RNA、脂质、代谢物、细胞质以及蛋白等,引起了科研人员的广泛兴趣。然而,外泌体作为一种纳米尺寸的柔性颗粒,且所处体液环境组成复杂,因此,实现外泌体准确无损的无标签分离一直是外泌体研究领域发展的瓶颈。
切向流过滤(TFF)技术是过滤技术的一种,当分离液体移动方向与过滤方向垂直,一部分液体将会透过分离介质,截流的颗粒在分离界面上不断被新补充的液体扫除,降低了节流颗粒在膜表面的积累,使其一直处于高效的过滤模式,因此,TFF在生物分子分离上有着独特的优势。外泌体等柔性囊泡在使用TFF方法进行分离时由于不直接受到流体的挤压,而是通过轻柔的切向作用流过分离界面,极大地减小了对外泌体等柔性结构的破坏,保证了其完整性。同时,前期报道的单层TFF分离作用有限,往往需要进行高速离心等预处理步骤。因此,有必要发展一种双层TFF过滤设备用于外泌体的高效分离与富集。
近日,东南大学刘松琴教授团队在国际期刊Analytica Chimica Acta上发表了题为“A double tangential flow filtration-based microfluidic device for highly efficient separation and enrichment of exosomes”的研究论文。该研究设计了一种基于双切向流(DTFF)的微流控分离装置,结合双切向技术与两种孔径的纳米多孔膜,实现对30 nm-200 nm区间外泌体的高效分离与富集。利用该芯片分离肝疾病患者血清中的外泌体,并进行蛋白组学分析,得出了外泌体表达的差异蛋白,为肝脏相关疾病的诊断提供了新思路。文章通讯作者为东南大学刘松琴教授,第一作者为东南大学华鑫博士与研究生朱倩。

该论文首先搭建了一种基于双切向流的微流控装置,双层的TFF构造为尺寸分布不够均匀的生物囊泡分离提供了可靠的方法,通过构建两种不同尺寸的分离界面,可以限定待分离生物囊泡的上下限,将大于该区间的物质拦截,小于该区间的物质通过流体流动分离;同时,双层TFF作用相较于单层TFF,其压力更小,对于维持囊泡的完整性上更具优势。
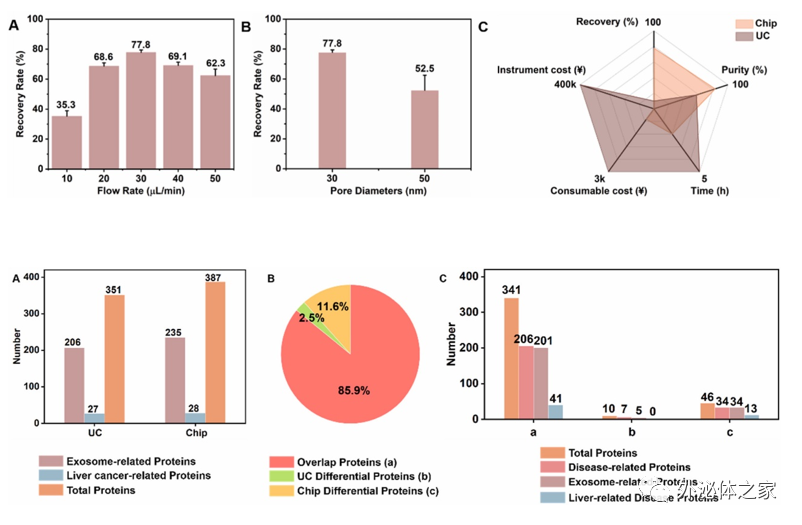
将该方法与传统外泌体分离方法-超速离心法进行对比,芯片分离在耗时、纯度、回收率、耗材耗费以及设备耗费上均优于超速离心法。进一步用芯片与超速离心两种方法分离肝疾病患者血清中的外泌体,并进行蛋白组学分析,芯片分离出的血清外泌体纯度高于超速离心法得到的外泌体,并在蛋白组学分析中展现了更多的差异蛋白,为疾病相关外泌体的研究及临床应用提供了新的方法。
论文链接:
https://doi.org/10.1016/j.aca.2023.341160
审核编辑 :李倩
-
基于微流控的外泌体分离技术也于近些年来不断涌现2018-08-20 3651
-
浅析基于微流控技术的外泌体分离方法2018-10-18 7569
-
一种用于外泌体分离富集和检测的微流控芯片2018-12-31 5346
-
采用离心微流控芯片实现血液中白细胞的分离提取2022-10-31 4101
-
综述:基于磁泳的微流控分离技术研究进展2022-12-27 2045
-
可用于单细胞分析的选择性液滴提取微流控装置2023-04-10 1729
-
利用DNA计算介导的串联微流控平台,实现细胞外囊泡亚群的有效分离2023-06-11 1790
-
武汉大学:研究微流控电化学集成传感器,快速、高效分离和灵敏检测致病菌2024-06-17 1618
全部0条评论

快来发表一下你的评论吧 !

