

电池是如何工作的
描述
电池中的能量实际上来自哪里?让我们仔细看看!
这是我的电池连接到手电筒灯泡以构成一个简单的电路。我打开了一个回形针来做一根连接线,我把它夹在电池底部和灯泡侧面之间。如果你仔细看,你会发现灯泡在发光。那是因为电子正在穿过它!
阳极和阴极?
现在这是里面发生的事情。电池的正极端子(在照片中显示在我左手拇指的正上方,在下面的插图中显示为红色)连接到大部分隐藏在电池内部的正极。我们称之为阴极。外壳和电池底部构成负极端子或负电极,在艺术品中也称为阳极 ,颜色为绿色。曲别针线在艺术中由蓝线表示。
让我们快速澄清一点困惑。在学校,你可能知道阴极是负极,阳极是正极?然而,这实际上仅适用于电解 (通过化学物质传递电流以将其分解)之类的事情。电池就像倒退的电解(它们分解化学物质来发电),所以阳极和阴极这两个术语会互换。好的?为避免混淆,我建议最好不要使用阳极和阴极这两个术语。最好说“正极端子”和“负极端子”,这样你的意思就很清楚了,不管你是在谈论电池还是电解——或者任何其他有阴极的东西。
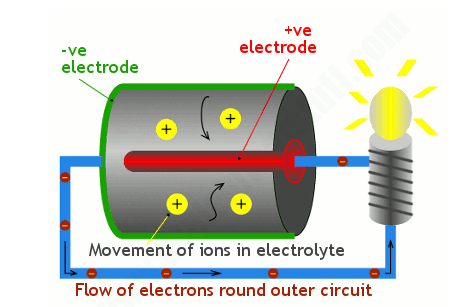
化学反应
现在回到我们的电池。正极和负极被化学电解液隔开。它可以是液体,但在普通电池中更可能是干粉。
当您将电池连接到灯并打开时,化学反应开始发生。其中一个反应在负极产生正离子(此处显示为大黄色斑点)和电子(较小的棕色斑点)。正离子流入电解质,而电子(较小的棕色斑点)绕着外部电路(蓝线)流向正极,并使灯在途中点亮。在正极发生单独的化学反应,进入的电子与从电解质中取出的离子重新结合,从而完成电路。
由于电池内部发生的化学反应,电子和离子会流动——通常是两个化学反应同时进行。确切的反应取决于制造电极和电解质的材料。(本文进一步给出了一些例子,我们比较了不同类型的电池。如果您想了解更多关于特定电池的反应,请输入您感兴趣的电池类型,然后输入“anode cathode”在您最喜欢的搜索引擎中搜索“反应”。)无论发生什么化学反应,电子围绕外电路运行以及离子与电解质反应(移入或移出)的一般原理适用于所有电池。当电池产生电能时,其内部的化学物质会逐渐转化为不同的化学物质。它们发电的能力减弱,电池电压慢慢下降,最终电池电量耗尽。换句话说,如果电池因为内部化学物质耗尽而无法产生正离子,那么它也无法为外部电路产生电子。
现在你可能会想:“等一下,这没有任何意义!为什么电子不走捷径,直接从负极通过电解质跳到正极?事实证明,因为电解质的化学性质,电子不能以这种简单的方式流过它。事实上,就电子而言,电解质几乎是一个绝缘体:它们无法跨越的屏障。它们最简单的正极路径电极实际上是通过外电路流过。
-
锂电池是如何工作的?锂电池充电过程 锂电池放电过程2023-11-10 2916
-
铅酸电池是如何工作的2023-05-23 2552
-
TOREX:了解的IoT器件(电池工作、低消耗)解决方案2023-05-22 1114
-
锂电池的工作#锂电池铅酸一起用jf_43140676 2022-10-22
-
碱性#电池是如何工作的?jf_97106930 2022-08-27
-
led和电池是如何工作的#电路原理Branch Education 2021-07-16
-
银锌蓄电池是如何工作的?资料下载2021-03-27 1327
-
银锌蓄电池是如何工作的2021-03-01 2388
-
救生衣上的电池如何工作2019-07-09 2540
-
锂氧电池是如何工作的?一文揭晓其中的猫腻2017-11-10 1268
-
VRLA蓄电池的工作特点2011-11-30 5892
-
锂铁电池工作性能及原理2009-10-23 1528
-
铅酸蓄电池工作的原理2009-10-20 9677
-
用电池工作的非可见光光源2009-09-22 476
全部0条评论

快来发表一下你的评论吧 !

