

集成信号转导及增强机制的微流控生物传感器用于检测多种真菌毒素
MEMS/传感技术
描述
真菌毒素被认为是食源性疾病的最重要原因之一,并受到全球范围内的长期关注。随着公共卫生意识的提高,一些组织已经为食品中的真菌毒素设定了最大残留限度(MRLS),以避免高风险行为。然而,大多数真菌毒素以微量的形式存在,对食品安全构成了严重威胁。此外,存在于同一食品中的多种毒素的协同或拮抗作用增加了对人和动物的毒性。而面对物流全球化的发展趋势,传统的真菌毒素分析方法如高效液相色谱法(HPLC)和液相色谱-质谱法(LC-MS)由于程序复杂、设备笨重、操作复杂,在一定程度上限制了其实际应用。因此,建立和开发针对多种真菌毒素的灵敏、快速、准确的高通量检测方法,以满足食品质量安全的要求已迫在眉睫。
为解决以上问题,淮阴师范学院、中国人民解放军总医院海南医院和清华大学联合研发了基于功能性DNA调节和过渡态CRISPR系统的超敏微流控生物传感器(FTMB),实现了6种真菌毒素的同时定量检测。在该系统中,触发开关的高响应性不受传感界面的空间限制,信号转导机制使其能够在复杂的生物背景下灵敏而特异地检测小分子目标,能使真菌毒素和荧光信号之间建立直接的线性正相关。此外,该研究还进一步开发了具有高响应特性的过渡态CRISPR系统并评价了微流控芯片中流道对流体的操纵以及PC基底对量子点探针荧光的增强作用。所构建的FTMB系统具有小型化、批量生产和可调性等优点,在实际样品分析中表现良好,具有高通量、准确性和重现性,为多种真菌毒素的快速检测提供了良好的平台。相关工作以“Microfluidic Biosensor Integrated with Signal Transduction and EnhancementMechanism for Ultrasensitive Noncompetitive Assay of Multiple Mycotoxins”为题发表在Analytical chemistry期刊上。
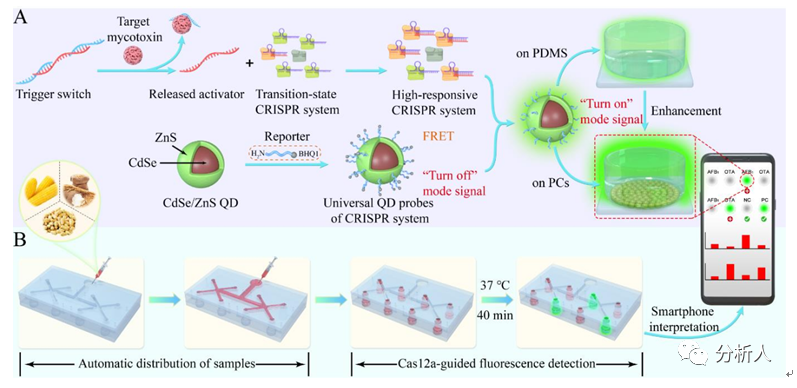
图1 FTMB系统的检测原理图
CRISPR/Cas12a双重转导机制的可行性
为了进一步确证功能DNA在真菌毒素检测中的转导机制的实用性,研究人员将功能DNA调控的CRISPR系统激活机制分别采用单链DNA(ssDNA,19nt)和FAM标记的Cas12a通用型DNA探针(FAM-TTATT-BHQ1)。如图2A所示,在没有相应激活子的反应体系中,ssDNA保持完整(通道1-2)。在使用功能性DNA锁定激活子(通道3-8)时,成功限制了CRISPR系统的裂解功能。在此基础上,在相应的真菌毒素(100 ng/mL)存在的情况下,6种真菌毒素的激活子可以触发相应的CRISPR系统的反式切割活性,使ssDNA被切割成随机短片段(通道9-14)。这种降解现象表明,6种适配子-1/激活子/适配子-2作为触发开关可以成功启动后续的级联反应。
为了验证聚丙烯酰胺凝胶电泳结果,基于功能DNA的触发开关在常规CRISPR/12a荧光检测系统中被进一步测试。实时荧光曲线显示,在激活子不存在或锁定时,荧光信号几乎不积累,而在激活子存在或解锁时,荧光值迅速增加(图2B)。根据荧光测试结果(图2C),功能DNA与激活子的最佳配比均为2:1。聚丙烯酰胺凝胶电泳和荧光定量分析结果表明,功能DNA具有识别目标分子的能力,同时激活子被成功锁定。
为了进一步提高传感器的检测灵敏度和抗干扰能力,选用QDs作为一种全新的CRISPR系统探针的供体材料。与常规CRISPR探针相比,QDs的窄带发射光谱和高的量子产率有利于高度匹配光子晶体的光子带隙。此外,得益于QDs的宽吸收光谱,信号输出可以在简单的紫外灯照射下实现。考虑到绿色荧光波段是最常见的检测输出信号,因此选择发射波长为520 nm的QDs。为了构建适合CRISPR系统的FRET模型,将含有淬灭基团BHQ1的DNA报告子修饰在量子点的表面,实现荧光猝灭。DNA报告子的浓度被进一步优化以达到最佳的猝灭效率。如图2D,猝灭效率随报告子浓度的增加而增加,直至在6 nmol(~100%)时达到完全猝灭。
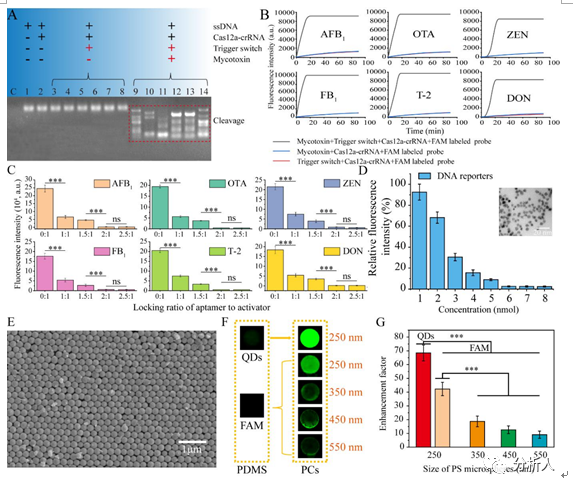
图2 CRISPR/Cas12a双重转导机制的可行性
用于真菌毒素检测的过渡态CRISPR系统的建立
同时具有不同形式Cas12a酶(封闭、中间和开启)处于动态平衡状态的CRISPR系统很容易用少量的激活子改变这种平衡,这有利于激活更多的Cas12a酶,从而使整体反式裂解活性大幅度提高。因此,推测CRISPR系统最敏感的状态是亚稳态,即使是少量的激活子也可以很容易地激活Cas12a酶,诱导较强的裂解活性。由图3A(2)可以看出,在激活子浓度相同的情况下,不同crRNA对应的CRISPR体系的反式切割活性不同。这是因为单个CRISPR系统的裂解活性是由多组分的性质共同驱动的,组分的结构和比例会对整个CRISPR系统的特性产生不同的影响。根据所选择的能够刺激Cas12a酶高活性的crRNA和激活子序列,调整组成比例有助于实现对低浓度目标真菌毒素的高响应。
为了确定分子开关的过渡状态,研究人员首先评估了激活复合物(crRNA/激活子)对Cas12a酶的影响。对于固定浓度的Cas12a酶,激活复合物浓度增加至4 nM以上(保持crRNA:激活子的比例为1:1),Cas12a酶的附属切割活性显著提升(图3B)。通过绘制激活曲线的一阶导数,研究人员将分子开关分为三组,即开启、过渡和关闭(图3B插图)。用高浓度的激活复合物(>8 nM)制作开启态CRISPR系统。在响应范围内,用中等浓度的激活复合物制备过渡态CRISPR系统,并对激活复合物浓度的变化保持响应(即,在Cas12a酶反应速率最高的顶点,用5.32 nM的激活复合物制作高响应CRISPR系统)。用低浓度的激活复合物(<3 nM)制成了封闭状态的CRISPR系统。当研究人员通过减少激活子的数量(即降低增强子:crRNA的比例)来扰乱系统时,处于响应状态的CRISPR系统显示出Cas12a酶附属切割活性的巨大变化(图3C)。
为了建立过渡态,研究人员进一步调整激活子的数量(即由功能性DNA锁定,通过触发开关与目标结合被释放),同时保持crRNA的数量不变(图3D)。通过此优化,研究人员将过渡状态定义为一阶导数抑制图(图3D,插图)上的顶点。这种被识别的过渡状态表明其反应性进一步提高,Cas12a酶附属切割速率最大,而开启和封闭状态CRISPR系统不能产生任何可识别的信号(图3E)。比例调节的Cas12a酶不仅在与互补的目标毒素分子孵育时表现出显著的附属切割活性,而且在与非目标分子孵育时也保持低背景活性。针对六种真菌毒素设计的过渡态CRISPR系统都实现了更快的激活动力学。与在其它状态下准备的开关相比,过渡态CRISPR系统能够快速激活Cas12a酶。在室温孵育40 min内,可以识别低浓度靶标。
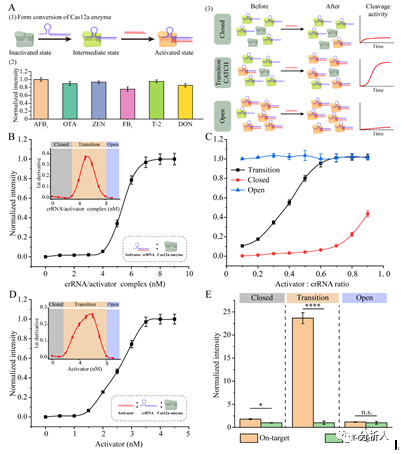
图3 用于真菌毒素检测的过渡态CRISPR系统的建立
压力驱动微流控芯片的液体流动测试
微流控芯片上的流体控制是真菌毒素高通量检测的重要保证。为确定反应液在各室的均匀分布,采用添加红色染料的反应液(上方25 μL矿物油)进行流体测试。流道设计受到自然分形树系统的启发,确保入口施加的压力均匀分布在腔室上,以引导液体流动的划分。这种分区方式的均匀性不受注入过程中压力变化的影响,保证了100%的分区效率,利于用户的友好使用。从图4中可以看出,红色液体均匀分布在左右八个检测室中,并被后续的矿物油隔离,避免交叉污染。芯片底部设计的排气通道利用毛细管效应形成一个截止阀,使腔内的空气排出,但液体不能流出。为了保证结果的准确性,本研究分别采用右侧的2个腔室作为阴性对照和阳性对照,另外6个腔室用于不同真菌毒素的检测。此外,基于不同分形维数和分支级别的芯片设计,该策略可以进一步扩展为更高通量的检测方案。
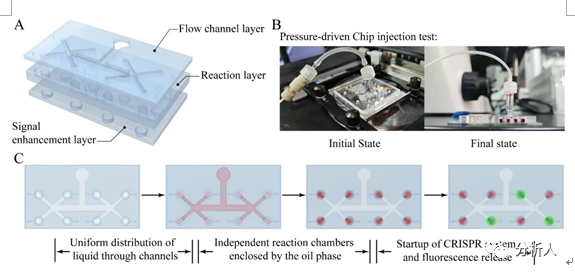
图4 压力驱动微流控芯片的组成和整个操作流程
FTMB系统的分析性能
在最佳实验条件下,FTMB检测系统中各真菌毒素标准曲线被构建。如图 5A所示,FTMB系统传感位点的亮度随着真菌毒素浓度的增加而增加,这并不遵循竞争免疫分析法的原理。FTMB系统的信号转导机制不需要与目标类似物竞争,通过减少信号标记修饰的识别分子的数量来实现量化。因此,FTMB系统中各位点的荧光强度与目标真菌毒素浓度呈正相关,这有利于检测灵敏度的提高。由Michaelis-Menten方程得到的AFB₁、OTA、ZEN、FB₁、T-2、DON的标准回归曲线(图5A)。R²值范围为 0.949 ~0.989,表明在检测范围内具有良好的相关系数。从标准曲线计算AFB₁、OTA、ZEN、FB₁、T-2和DON的检测限(LOD)分别为 2.3 fg/mL、3.9 fg/mL、2.6 fg/mL、1.4 fg/mL、1.7 fg/mL 和 1.5 fg/mL。
为了进一步评估FTMB系统对单一和多重检测的特异性,FTMB系统对单个AFB₁、OTA、ZEN、FB₁、T-2、DON及其混合物的荧光响应被研究(图5B)。通过对AFB₁、OTA、ZEN、FB₁、T-2、DON等6种真菌毒素的单独检测,各检测单元对应的目标毒素可触发单元内的CRISPR反应从而恢复QDs的荧光。检测单元对非目标毒素无反应,信号值与空白对照相似。对于多重检测,当对多种真菌毒素的不同组合(2-plex、3-plex、4-plex和5-plex)进行测试时,FTMB系统也提供了准确的结果。在需要制备半抗原的竞争性免疫测定中,某些真菌毒素(如AFB₁)在紫外线下的自发荧光可能会干扰结果的判读。而FTMB系统通过触发级联反应发出荧光,则不受其影响。这些结果表明,FTMB系统的非竞争性检测方法能够准确、特异地检测出单重或者多重目标毒素。
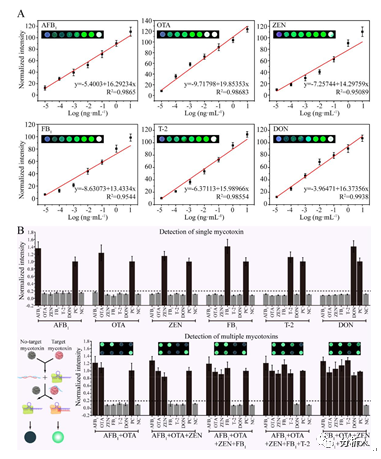
图5 FTMB分析性能
综上所述,该项研究成功开发了一种基于功能性DNA调节和过渡态CRISPR系统的超敏微流控生物传感器,可以实现食品中真菌毒素的高通量识别。该传感器通过设计的触发开关建立了Cas12a酶的程序化侧枝裂解活性与霉菌毒素浓度之间的正相关关系。在信号转导方面,高灵敏度的过渡态被认为是提高CRISPR/Cas12a系统识别能力的关键因素。调整Cas12a酶的开放状态和关闭状态的比值对FTMB的分析性能有积极的影响。在增强信号方面,通过设计发射波段与芯片内光子带隙高度匹配的量子点探针实现了信号显著增强至45.6倍。该方法不需要对人体和环境造成生物危害的真菌毒素-蛋白偶联物,也不需要制备复杂、繁琐的抗体。为了进一步提高用户友好性,FTMB系统的微流体平台可以与自动化液体处理系统或者手动进样兼容。FTMB通过样品扩展和系统自动化,在真菌毒素残留物联合检测方面具有广阔的应用前景,可为食品的安全性评价和质量控制提供新的技术支持。
审核编辑:刘清
-
真菌毒素检测仪是什么?检测步骤是什么2022-04-22 991
-
真菌毒素检测仪 快速定量检测2021-12-22 941
-
(飞测生物)真菌毒素快速检测仪2021-11-17 1379
-
国产真菌毒素检测仪的作用2021-09-30 542
-
真菌毒素快速检测仪设备 【飞测生物】真菌毒素检测仪2021-09-29 982
-
真菌毒素检测仪的特点2021-09-03 552
-
请问怎样去设计压电生物传感器检测电路?2021-04-14 2028
-
高效快速准确生物传感器技术成功分离赤芍抗内毒素成分2018-11-20 1727
-
GMR生物传感器的原理及研究现状2018-11-01 3388
-
生物传感器成科技新宠 iphone还可检测人体毒素?2013-08-22 1210
-
UPT生物传感器2011-01-28 1466
全部0条评论

快来发表一下你的评论吧 !

