

静电势作为溶剂描述符,实现锂电池电解液的合理设计
描述
研究背景
锂离子电池(LIB)作为电化学储能器件的使用取得了实质性进展。然而,新电池的实施总是受到不希望发生的电极/电解质界面反应的阻碍。因此,迫切需要优化电解质以匹配不断发展的电池系统。电解质工程是电池研究领域的热点之一。重要的是,源于阴离子的界面化学策略优化了电解质框架,促进传统锂离子电池和新电池化学的重大进展。通过将阴离子引入Li溶剂化结构,如高浓度电解质(HCEs),局部高浓度电解质(LHCEs),和弱溶出电解质(WSEs),他们可以合理地调节富含有机物的固体电解质间相(SEI)/正极电解质间相(CEI)。适合的有限阴离子,溶剂数量在决定阴离子衍生的界面化学中起着至关重要的作用。到目前为止,电解质的设计和选择主要是基于实验。这种传统的试验和错误的电解质设计过程会使研究周期变得漫长而复杂。应用于电池研究的人工智能/机器学习(AI/ML)方法被认为是加速研究周期的有力工具。
成果简介
近期,清华大学核研院何向明研究员和王莉副研究员基于Li和溶剂之间的静电作用,通过密度泛函理论计算出电解质溶剂的静电势(ESP),并显示出明显的规律性。提出了ESP作为一个直接和简单的溶剂描述符,可以方便地设计电解质。最低的负静电电位(ESPmin)保证了溶剂的亲核能力,弱ESPmin意味着溶剂化能的降低。弱ESPmin和强最高正静电电位(ESPmax)是非溶剂化性抗溶剂的主要特征。利用ESPmin - ESPmax图,可以确定在电解质工程中使用的强溶解性溶剂、弱溶解性溶剂或反溶剂。这种溶剂描述符可以促进AI/ML开发高性能的电解质。
该工作以“Electrostatic Potential as Solvent Descriptor to Enable Rational Electrolyte Design for Lithium Batteries”为题发表在期刊Advanced Energy Materials上。第一作者为清华大学核研院博士后吴延州(现为中科院烟台海岸带所特别研究助理)。
研究亮点
(1)提出了ESP作为一个直接和简单的溶剂描述符。
(2)最低的负静电电位(ESPmin)保证了溶剂的亲核能力,弱ESPmin意味着溶剂化能的降低。
(3)利用ESPmin - ESPmax图,确定强溶剂化溶剂、弱溶剂化溶剂或反溶剂。
图文导读
基于对溶剂化学的理解,通常用介电常数(相对介电常数,ε)和供体数(DN)代替极性来评价溶剂对锂盐的溶解能力(图1)。在传统的电解质中,溶剂通常是极性的,具有适度的ε,如碳酸乙烯酯(EC)、乙腈(AN)、1,2-二甲氧基乙烷(DME)。DN描述了溶剂的路易斯型供体特性。例如,硝酸锂(LiNO3)在醚类溶剂中的溶解度很高,但在大多数酯类电解质中的溶解度很低(图1b)。这种现象的根本原因是,醚基溶剂的DN值与NO3-相当,如DME。然而,ε或DN并不足以描述特定溶剂的溶解行为。对于LHCEs,非溶剂化性的氢氟醚(HFEs)具有与二甲醚类似的低水平,但它们对锂盐没有溶解性。此外,1,4-二氧六环(1,4-DX)的DN高于AN(图1a),而双(氟磺酰)亚胺锂(LiFSI)在1,4-DX中的溶解度很低。因此,非常需要一个物理化学参数来全面反映一个溶剂的溶剂化能力,以指导电解质工程。由于不同阴离子相互作用模型的复杂性,我们希望在本文中简化模型并进行全面讨论。因此,我们选择LiFSI作为电解质的主要盐。在这个模型中Li+-solvent-FSI-,FSI-是否参与溶剂化结构与比较不同溶剂之间的竞争配位无关。
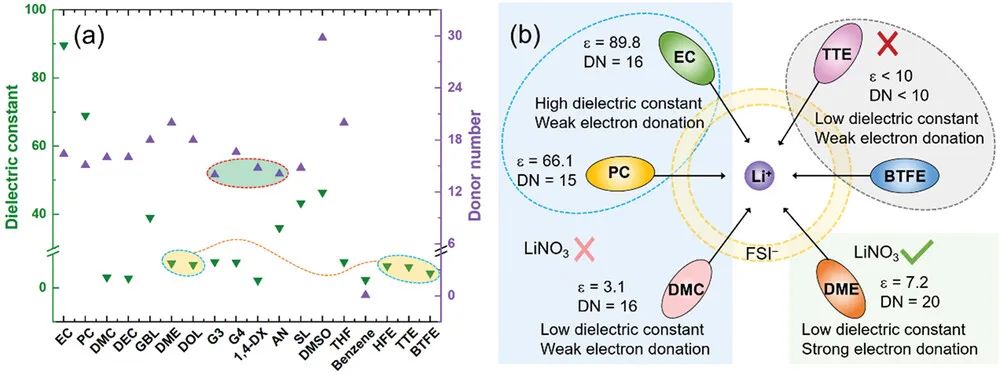
图1 a) 用于锂离子或锂金属电池的一些溶剂的介电常数和供体数量。b) 几种典型溶剂的介电性能、电子供体和溶盐能力之间的关系示意图,上面的讨论是在LiFSI作为主要盐的背景下进行的。
图2显示了溶剂化溶剂和反溶剂的ESP图,包括酯基,醚基,氰基,HFEs等。溶剂化溶剂的负电荷主要集中在氧原子和氮原子上,并导致比反溶剂的负电荷多得多。对于溶剂化溶剂来说,最低静电电位的绝对值(ESP+min|)远远高于ESPmax,(ESPmin| > ESPmax)。相比之下,反溶剂的ESP显然显示出相反的趋势,|ESPmin| < ESPmax,因为氟原子的存在导致了氧原子表面负电荷的分散,从而使负电荷几乎平均分散在氧原子和氟原子上。这意味着反溶剂是一个不理想的电子供体,与以前出版物中提到的非溶剂化现象一致。因此,我们认为根据分子的ESP特性来指导功能电解质的设计是可行的。
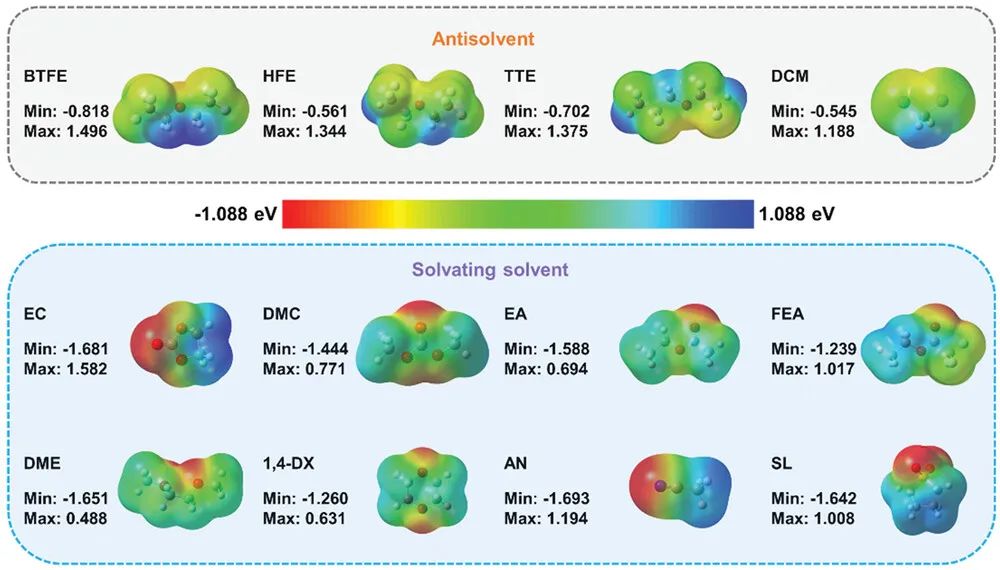
图2. 真空条件下有机溶剂的计算静电势图。
如图3a所示,HFEs作为代表性的反溶剂,都位于左上角(绿色阴影),它们的ESPmin值较小,并且|ESPmin| < ESPmax。此外,苯和1,2-二氟苯(dFBn)对Li的亲和力较低,已被证明是稀释高浓度电解质的新反溶剂。可以看出,芳香族溶剂(紫色阴影)的特点是低|ESPmin|和ESmax。因此,这些结果表明,ESPmin为弱负值的溶剂不是很好的电子供体,阻碍了锂盐的溶解,使它们如预期的那样成为合适的反溶剂。
如图3a所示,常规溶剂主要分布在图的右侧,具有强烈的负表面静电电位。强极性溶剂(黄色阴影)如EC、PC和AN的正负表面静电电位都比较强(|ESP+min|≈ESPmax)。对于弱溶剂化溶剂,如二乙醚(DEE)、1,2-二乙氧基乙烷(12DEE)、1,3-二氧戊环(DOL)和1,4-DX,观察到ESPmax明显下降(|ESPmin| ≫ESPmax)。尽管用ESPmin和ESPmax来测量极性是不准确的,但它仍然是一个有用的参考。更具体地说,如果ESPmin相似,更高的ESPmax表明电荷分离的程度更大,从而导致更大的极性。这样的观察对解释Li溶剂化鞘的结构是合理的。强负的ESP+min使溶剂能够与Li配位,而ESP+max的变化表明分子极性的波动。对于弱溶剂化性的溶剂,低ESPmax意味着低极性,阴离子更愿意与Li连接,并在低浓度下形成CIP或AIP。图3b显示了EC、EA、丙酸甲酯(MP)、12DEE及其氟化衍生物的ESP。值得注意的是,氟化溶剂的ESPmin变得比其没有取代的类似物的ESPmin要小,这表明氟原子削弱了与Li配位的溶剂的亲和力,促进了Li的脱溶。因此,我们可以通过ESPmin-ESPmax图来大致区分反溶剂、强溶剂化溶剂和弱溶剂化溶剂。
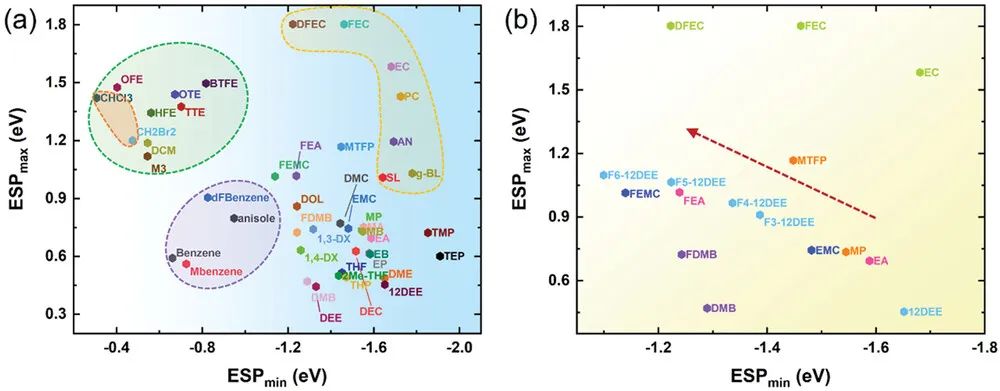
图3 a)密度函数理论计算的真空条件下各种溶剂的静电势(ESP)。b)氟化溶剂的ESP。
结合能是评价溶剂或阴离子参与Li溶剂化鞘的能力的常用指标。为了进一步评价使用ESP作为溶剂指标的合理性,我们讨论了结合能和ESP之间的关系。这里,典型的Li-溶剂复合物的优化化学结构显示在图4a中。在真空条件下,溶剂化效应被忽略,ε被认为是固定的。结果表明,Li更喜欢与C=O、P=O基团相互作用。这样的趋势与溶剂化溶剂表面的负电荷分布一致(图2)。图4b显示了上述优化的Li-溶剂配合物在真空中的相应结合能。低的结合能意味着Li和溶剂之间的相互作用很弱,这有利于阴离子在Li溶剂化鞘中的配位。
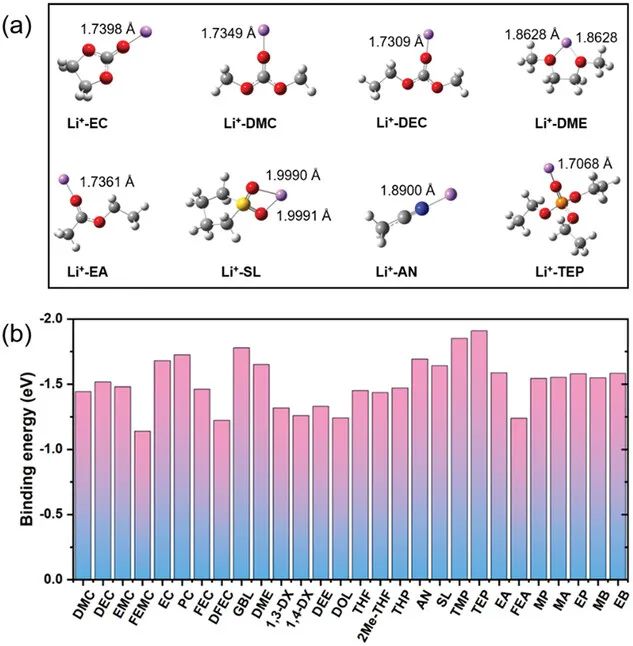
图4. a) 真空条件下各种Li+-溶剂配合物的优化化学结构。Li、O、H、S、N和P原子分别显示为紫色、红色、灰色、黄色、蓝色和橙色。b) 真空条件下由DFT计算的Li+-溶剂配合物的结合能。
图5说明了我们选择ESP作为描述符的总体思路。对于锂电池电解质来说,溶剂分子与离子的相互作用主要是通过静电相互作用产生的。ε和DN都提供了供体和受体之间静电作用的信息,但两者各有侧重。ε侧重于描述分子在电场中的电荷极化,而DN则反映了溶质中富集的电子吸引Li的能力。因此,使用单一的方法来评估与电解质的相互作用有时是矛盾的。EPS描述了分子表面上电荷的具体位置和密度。它可以用来表征溶质和Li之间的微观相互作用,所以它是评价电解质中各组分之间相互作用的一个重要的物理化学参数。基于上述结果,我们得出结论,静电势为指导电解质溶出结构的设计提供了一个理想的视角。
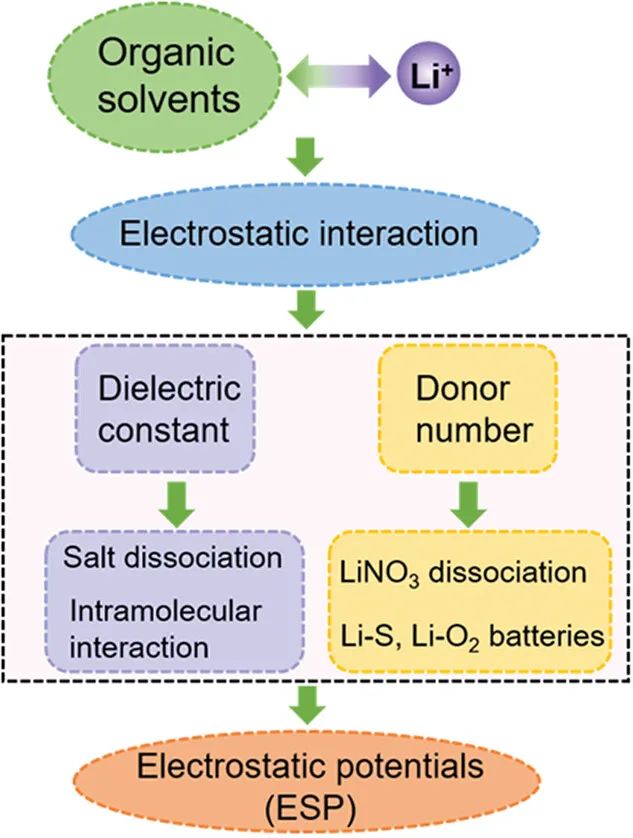
图5 选择ESP作为描述词的一般准则。
总结与展望
综上所述,利用DFT计算研究了电解质工程中溶剂的表面ESP,阐明了溶剂化溶剂的表面电荷特性。生成的溶剂图显示出明显的分布规律性。正如计算结果所揭示的那样,反溶剂的表面电荷分布的特点是|ESPmin|远小于ESPmax。我们应用这一规律来预测几种新型的反溶剂分子,它们可能成为下一代抗溶剂的候选者。此外,表面ESP的变化可以用来比较溶剂参与溶剂化的强度。一个溶剂化的溶剂扮演电子供体的角色并与Li配位,ESP+min的减少表明溶剂化能量低。结合能和ESPmin的图表可以用来可靠地估计电解质中溶剂之间的竞争配位。这种洞察力使我们能够筛选出反溶剂、强溶剂化性溶剂和弱溶剂化性溶剂。因此,分析溶剂的ESP是筛选溶剂和调节溶解结构的一个简单方法。
-
锂电池电解液如何影响电池质量?锂电池电解液成分优势是什么?2024-01-11 2463
-
锂电池电解液的主要成分有哪些?2023-07-04 6695
-
电池原材料要怎么选择?锂电池的电解液2023-04-18 1983
-
锂电池电解液溶剂基础入门知识总结2021-03-26 4656
-
东华股份投资2.6亿,生产锂电池电解液和回收溶剂2020-09-14 3537
-
锂电池电解液的组成部分_锂电池电解液的危害2020-08-03 11578
-
锂电池电解液是什么_锂电池电解液主要成分2020-03-30 50669
-
如何正确选择锂电池电解液水分检测仪器2020-03-26 5651
-
电解液——锂电池的‘血液’2018-08-07 5899
-
锂电池电解液价格走势2018-03-08 11237
-
锂电池注液机的注液原理是怎样的2017-08-16 6890
-
现在的锂电池都是用什么样的电解液?电解液里加入什么添加剂?2009-10-23 5122
全部0条评论

快来发表一下你的评论吧 !

