

利用DNA计算介导的串联微流控平台,实现细胞外囊泡亚群的有效分离
描述
细胞外囊泡(EVs)由不同类型细胞产生,对细胞间交流至关重要。不同细胞来源的EV亚群可以准确地与各自对应受体细胞精确相互作用,进行内化并发挥功能。因此,分离多个EVs亚群对于充分解析EVs生物功能具有重要意义。 目前已经开发了多种EVs分离技术,包括超速离心、尺寸排阻和亲和分离等。其中,亲和分离通常具有较好选择性,其原理为主要通过抗体/核酸适体等识别分子对EVs上单一生物标志物的相互作用以实现EVs分离。然而,尽管在某些应用中亲和分离行之有效,但由于大多数EVs亚群缺乏特异性单一生物标志物,所以较难实现它们与密切相关的EVs混合群体的明确区分。
基于适体识别的DNA计算技术的快速发展为EVs分离分析离提供了一种强有力的工具。宋彦龄教授团队前期已发展了基于双适体邻位连接的特定EV亚群的高灵敏检测方法(Angew. Chem. Int. Ed. 2021, 60, 7582),以及基于适体靶向识别和代谢标记的EV特定蛋白糖基化成像方法(Angew. Chem. Int. Ed. 2021, 60, 18111)。然而,考虑到逻辑计算设计的复杂性以及EVs的高度异质性,现有的方法往往一次只能定量一个特定的EVs亚群,难以同时分离多个EVs亚群。由于分离方法的缺乏,目前难以实现对多个EVs亚群同时分离分析及下游分析,从而阻碍了对EVs亚群生物学功能和临床应用的深入探索。因此,亟需发展一种多EVs亚群的分离策略。

近日,厦门大学宋彦龄教授团队在国际期刊small methods上发表了题为“Isolation of PD-L1 Extracellular Vesicle Subpopulations Using DNA Computation Mediated Microfluidic Tandem Separation”的研究论文,开发了一个模块化的串联微流控分离平台(如图1所示),能够将多个结合事件作为输入,进行逻辑计算,并产生两个独立的输出,用于串联微流控芯片的EVs亚群分离。该平台利用双适体识别的优异选择性和串联芯片的灵活性,实现了肿瘤PD-L1 EVs和非肿瘤PD-L1 EVs的顺序分离。因此,所开发的平台不仅能有效区分癌症患者和健康志愿者,还能为评估免疫异质性提供新的线索。此外,捕获的EVs可以通过DNA水解反应高效释放,与下游的质谱分析兼容,进行EV蛋白质组分析。总的来说,这一策略有望分离出不同的EVs亚群,将EVs转化为可靠的临床生物标志物,并准确研究不同EVs亚群的生物学功能。文章通讯作者为厦门大学宋彦龄教授,第一作者为厦门大学硕士研究生卢银珠与林冰倩博士。
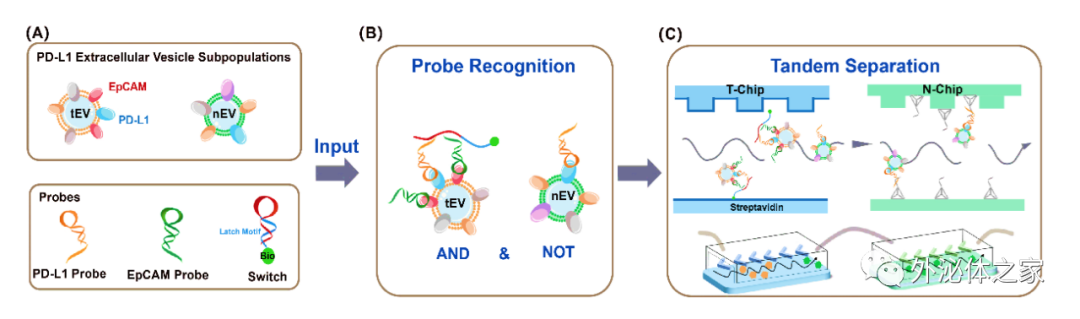
图1 DNA计算介导的微流控串联实现PD-L1细胞外囊泡亚群分离的原理
该论文将肺癌患者和健康志愿者的血浆样本用来研究所开发策略的临床效用。将血浆样本与亲和探针和开关探针孵育后通入到串联芯片中。如图2A所示,对于T-Chip,癌症患者捕获的EVs数量远远高于健康志愿者(t检验:P = 0.0006)。而对于N-Chip,除了一些健康志愿者的数值较高外,两类样品的区别并不明显(图2B,t检验:P = 0.02)。值得注意的是,对于N-Chip分离的PD-L1 EVs亚群,由于肿瘤患者中正常细胞产生的PD-L1 EVs可能因免疫逃逸而被分泌抑制,所以患者捕获的EVs的平均量低于健康人。如果只是将同一样本的两种芯片信号简单相加,而非顺序分离,癌症患者和健康志愿者的区别会被削弱(图2C和2D,t检验:P = 0.04,ROC曲线的AUC值为:T-Chip为0.9664,T-Chip + N-Chip为0.7731),这可能是因为免疫异质性导致正常细胞分泌的PD-L1 EVs数量差异较大造成。这些结果表明,该策略不仅可以通过肿瘤PD-L1 EVs区分癌症和正常人,同时可以获得正常细胞来源的PD-L1 EV亚群的数量,以协助免疫异质性评估。
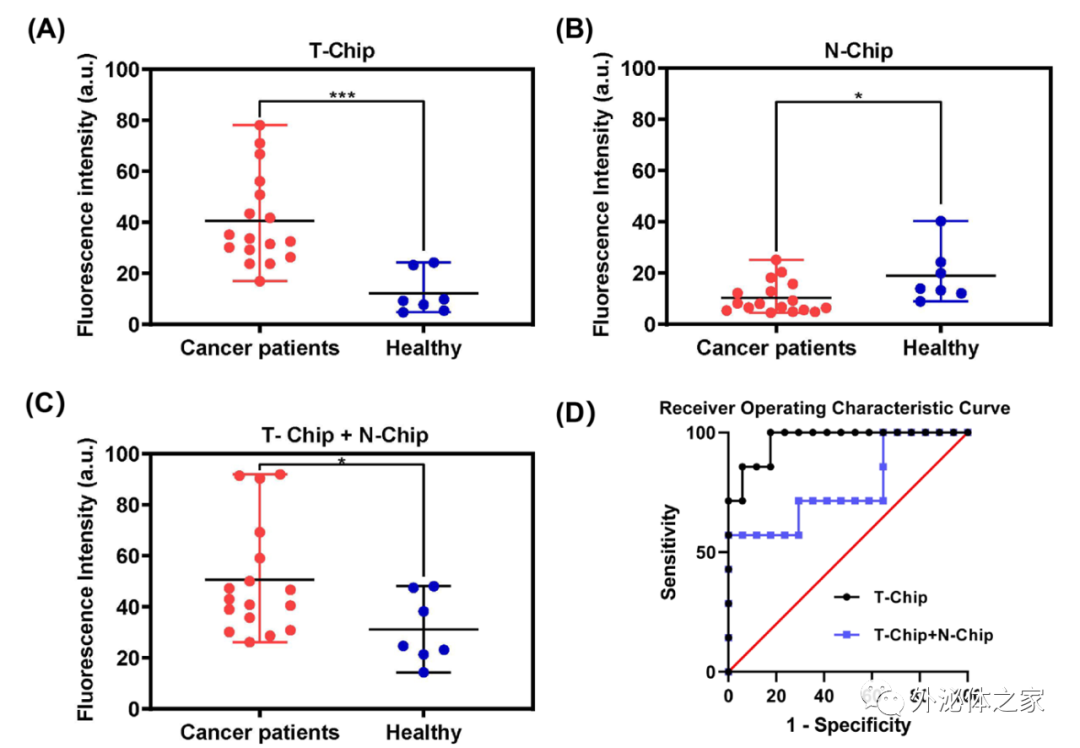
图2 临床样本中肿瘤来源和非肿瘤细胞来源PD-L1 EVs定量
总体而言,所开发的平台通过EVs亚群的同时分离,有望能让人们更好地理解EVs的生物学功能、以及对癌症进展、免疫反应以及对免疫治疗耐药性的实时评估。
论文链接:
https://doi.org/10.1002/smtd.202300516
-
微流控芯片细胞分析技术的分类及优点2018-10-10 12414
-
浅析基于微流控技术的外泌体分离方法2018-10-18 7565
-
中科院大连化学物理研究所在单细胞外囊泡多参数分析方面取得新进展2019-04-08 4339
-
一种高效的微流控细胞芯片,通过快速筛选允许细胞实现病毒的分离和培养2022-06-07 4435
-
基于细胞外囊泡(EV)的液体活检技术2022-08-30 2570
-
采用离心微流控芯片实现血液中白细胞的分离提取2022-10-31 4081
-
基于微纳流控平台的细胞外囊泡荧光标记新策略2023-05-25 1525
-
基于计算机视觉的AI介导的多重微流控数字免疫分析法2023-09-23 1768
-
利用粘弹性微流控系统,直接从人体血液中分离小细胞外囊泡2023-10-19 2250
-
安泰ATA-7050高压放大器在微流控细胞分选中的应用2024-03-01 1166
-
基于磁珠的液滴微流控平台,用于细胞外囊泡的高效分离2024-03-12 2195
-
Aigtek高电压放大器微流控细胞筛选测试2025-01-20 721
-
基于细胞微流控的阻抗测试解决方案2025-07-02 1091
全部0条评论

快来发表一下你的评论吧 !

