

利用惯性微流控技术实现微通道内非尺寸依赖的细胞可控三维聚焦
描述
微流控流式细胞术能够以高通量、连续流动的方式测量细胞流经检测区域时的荧光信号、光学图像和阻抗变化,可以更好地了解细胞功能,测量单个细胞的生物物理信息,以及表征大样本中的细胞异质性,为基础生物学研究和临床诊断提供了重要的工具。
随着对于细胞检测精度需求的提升,将细胞进行三维聚焦逐渐成为新的思路,这可以使得不同尺寸细胞在固定的截面位置逐个经过检测区域,从而避免了由于细胞位置变化和多个细胞同时在检测区域中而导致的检测误差。然而,目前已报道的无鞘三维聚焦方案仍然不能解决细胞偏心聚焦的问题,无法解决细胞表面的不均匀变形,以及通道壁面对细胞轮廓识别和光学检测的干扰。
近期,东南大学项楠教授课题组报道了一种新型的高深宽比非对称蛇形(HARAS)微通道,用于探索非尺寸依赖的可控聚焦,并成功实现细胞在通道三维中心的单线聚焦,相关成果以“Controllable Size-Independent Three-Dimensional Inertial Focusing inHigh-Aspect-Ratio Asymmetric Serpentine Microchannels”为题发表在国际化学权威杂志Analytical Chemistry上。文章第一作者为倪陈博士,通讯作者为项楠教授。
在有限雷诺数下,颗粒在牛顿流体中沿弯流道流动时,会受到惯性升力和Dean拽力共同作用,该团队设计的HARAS微通道(图1A)能够在不影响颗粒垂直聚焦的同时,完美地将惯性升力和Dean阻力进行有机结合,迫使颗粒在通道中迁移至唯一的受力平衡位置。
具体而言,该团队采用的高深宽比通道结构通常在直流道中可以将颗粒聚焦至通道长壁中心附近的两个平衡位置,蛇形流道用以产生Dean流来调整颗粒的横向位置,从而有机会将原本的双列聚焦优化成单线聚焦(图1B-1C)。然而Dean流由于具有混合效应,往往对颗粒的垂直聚焦产生负面影响。
因此,该团队采用浸入边界法(IBM)耦合格子玻尔兹曼方法(LBM)和有限元方法(FEM)来模拟颗粒在流体中完整的三维迁移轨迹,并计算颗粒和流体的相互作用(图2A)。通过分析不同曲率下不同尺寸颗粒的运动轨迹和Dean流分布(图2B),解析惯性升力和Dean阻力对颗粒聚焦的影响,确定可忽略Dean流混合效应且适用多尺寸颗粒的最佳曲率结构,并获得了与实验结果高度一致的数值轨迹(图2C)。
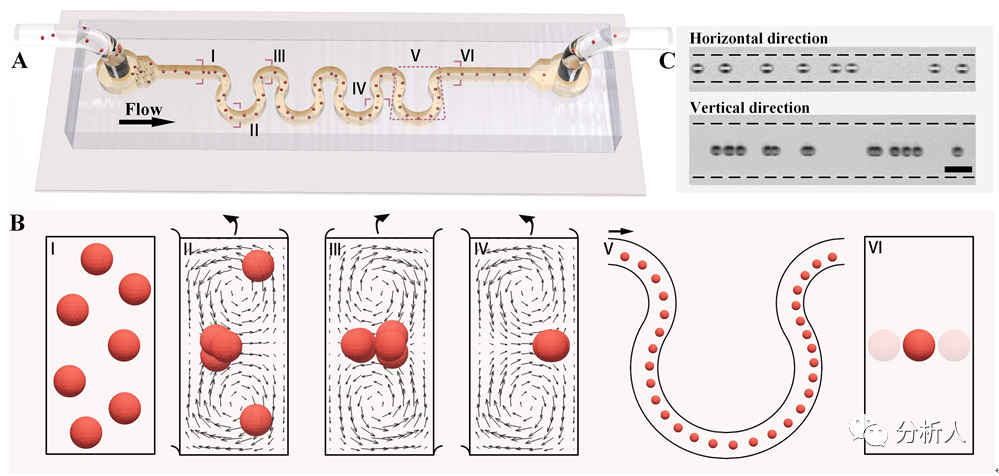
图1 (A)HARAS微通道示意图;(B)颗粒从无序状态到单线聚焦的过程示意图;(C)颗粒在通道三维中心的单线聚焦(来源:Anal. Chem.) 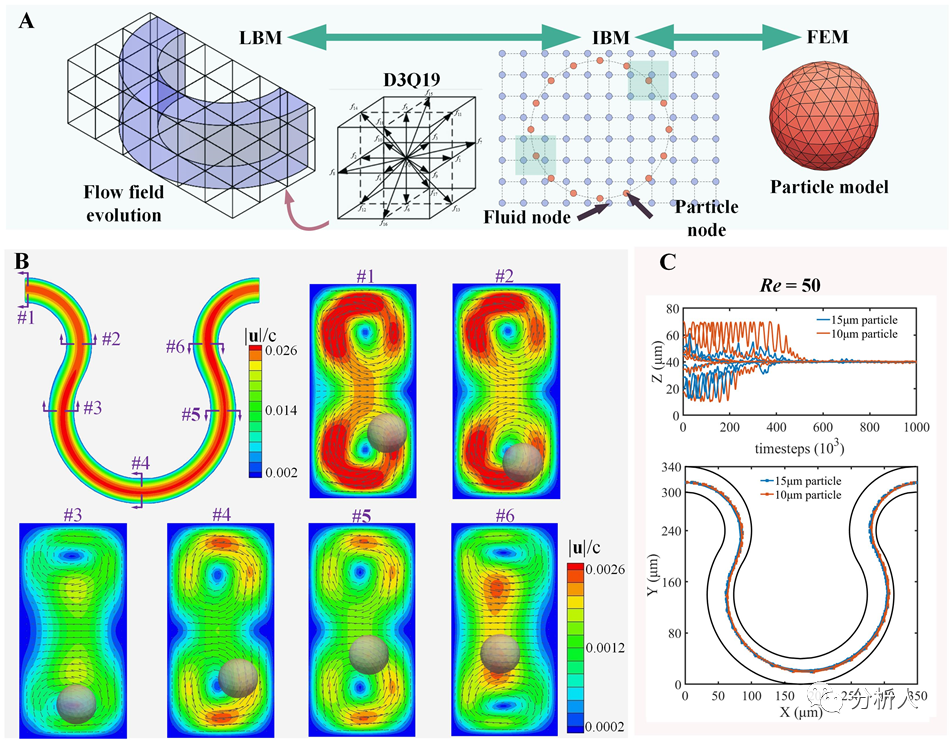
图2 (A)数值模拟方法示意图;(B)不同位置处颗粒在Dean流中相应位置;(C)颗粒迁移轨迹模拟结果(来源:Anal. Chem.)
基于优化的HARAS微通道,该团队对10 μm和15 μm颗粒以及A549和MCF-7细胞在不同流速下进行了聚焦测试。研究表明,不同尺寸的颗粒和细胞均在能较广的流速范围内实现单线聚焦(图3A-3D)。得益于这种高度稳定的聚焦状态,颗粒/细胞可以在相同位置以三维单线聚焦的形式进入出口直线通道,并随流速的增加,单线轨迹逐渐从内流道壁向外流道壁移动,实现聚焦位置的可控化。
此外,在流速调控的过程中,水平和垂直方向上的聚焦位置会相交于一点(图3A-3C),即实现颗粒/细胞在通道三维中心的单线聚焦(图3E)。这种流速调控的聚焦方式可以用于细胞不同后续单元的可控分配,而细胞在通道三维中心的单线聚焦也将为单细胞封装、液滴聚焦和细胞图像识别创造新的贡献。
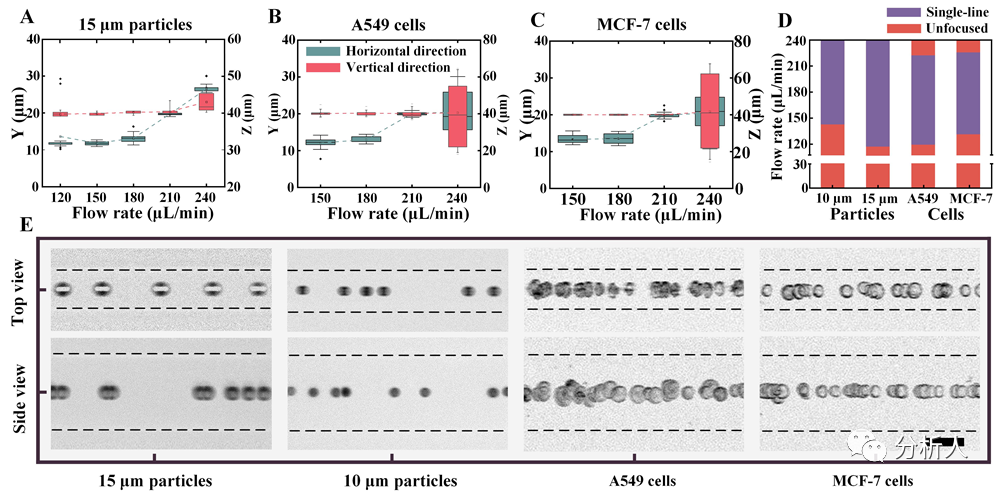
图3 颗粒和细胞在不同流速下的聚焦状态(来源:Anal. Chem.)
综上所述,该研究工作克服了以往报道中的偏心聚焦问题,为惯性微流控的三维聚焦提供了新的见解,所设计的微流控装置具有结构简单、成本低和稳定实现三维惯性聚焦等优点,将为后续的单细胞检测和分析提供稳定、高通量和位置可控的方案。
审核编辑:刘清
-
基于细胞微流控的阻抗测试解决方案2025-07-02 1103
-
功率放大器在液滴微流控细胞分选中的应用2025-04-03 642
-
Aigtek高电压放大器微流控细胞筛选测试2025-01-20 728
-
基于双极性电极阵列的微流控芯片,可实现细胞可控、非接触三维旋转2024-03-07 3299
-
安泰ATA-7050高压放大器在微流控细胞分选中的应用2024-03-01 1171
-
宽带功率放大器基于微流控技术的细胞分选的应用2023-04-27 1134
-
一种用于分泌型自噬小体分离检测的三维微流控芯片2022-07-29 2650
-
一种高效的微流控细胞芯片,通过快速筛选允许细胞实现病毒的分离和培养2022-06-07 4444
-
利用微流控技术制备高度贯通多孔微载体2019-06-30 4774
-
多器官微流控芯片技术及其应用2019-05-07 8692
-
基于滑动原理分选不同尺寸单细胞的微流控装置2019-01-02 5403
全部0条评论

快来发表一下你的评论吧 !

