

虹科案例|用于多路复用荧光检测的固态照明
描述
写在前面
在复杂的异质标本中同时识别和定位多个分子或分子组装体的能力长期以来一直是推动荧光显微镜在生物和物理科学中应用的主要优势。例如,自 1986 年以来,使用四种光谱不同的荧光团鉴定 DNA 的腺嘌呤、胸腺嘧啶、胞嘧啶和鸟嘌呤 (ATCG) 碱基,已成为大多数自动化 DNA 测序技术的基础 [1]。
在下文中,小编为大家介绍了几种多重荧光检测的方法及其特点,并展示利用虹科固态光源实现的多重荧光技术的应用案例。

01 基于光谱鉴别的
多重荧光检测
目前,大多数多路检测方案都基于光谱鉴别,因为与基于时间或空间鉴别的方法相比,它在技术上不太复杂且成本更低[2]。该技术原理主要利用双分子标记的荧光染料和荧光蛋白 (FP) 的光谱特性,如图 1 所示。
在这个例子中,两种荧光标记的激发光谱和发射光谱具有明显的光谱重叠以及分离的区域。因此,可以通过特征的激光区域来实现不同荧光团的激发。当两种荧光团都存在时,比如利用475nm的激光可以实现两种荧光团同时倍激光。而只有在大于 550 nm 的波长下才有可能选择性激发一种荧光团而不激发另一种荧光团。通过这种对比成像方式来获取更多特征图像。
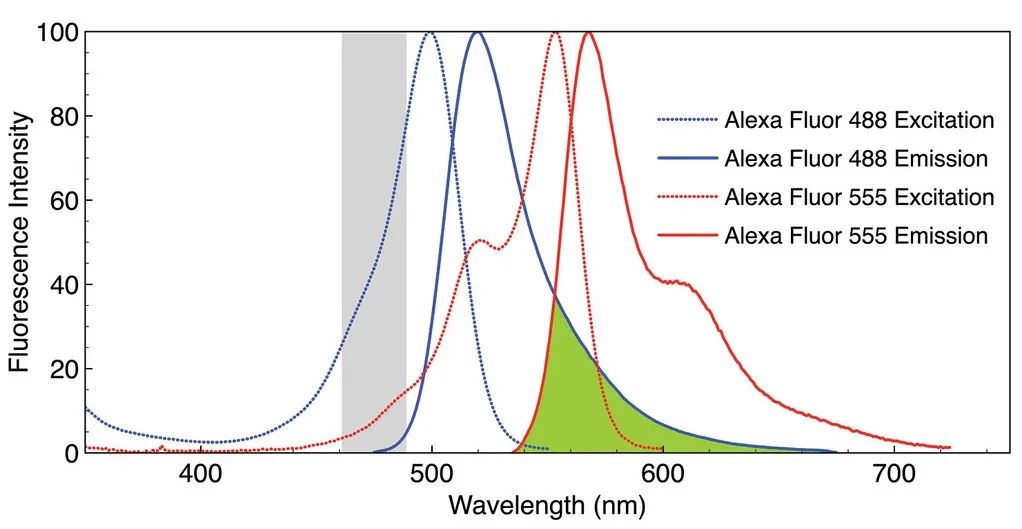
图 1. Alexa Fluor 488 和 Alexa Fluor 555 荧光团的标准化荧光激发和发射光谱。发射光谱重叠区域以绿色阴影显示。灰色阴影区域表示用于获取图 2 中图像 A-C 的激发带宽 (475/28 nm)
基于图 1 中的两种荧光团的光谱位置,有研究者对麂皮成纤维细胞实现标记,标记有 Alexa Fluor 488 phalloidin(肌动蛋白)和小鼠抗 OxPhos 复合物 V + Alexa Fluor 555 山羊抗小鼠 IgG(线粒体)。
实验中使用虹科 SPECTRA 光源、Andor Zyla 5.5 sCMOS 相机和 Nikon Ti2 显微镜获取的同一区域的四张 60X 荧光图像,如图2所示。图像不会因串扰而退化,因为激发带宽 (555/28 nm) 与 Alexa Fluor 488 的激发光谱没有很大程度的相交,从而实现多路荧光检测的效果。
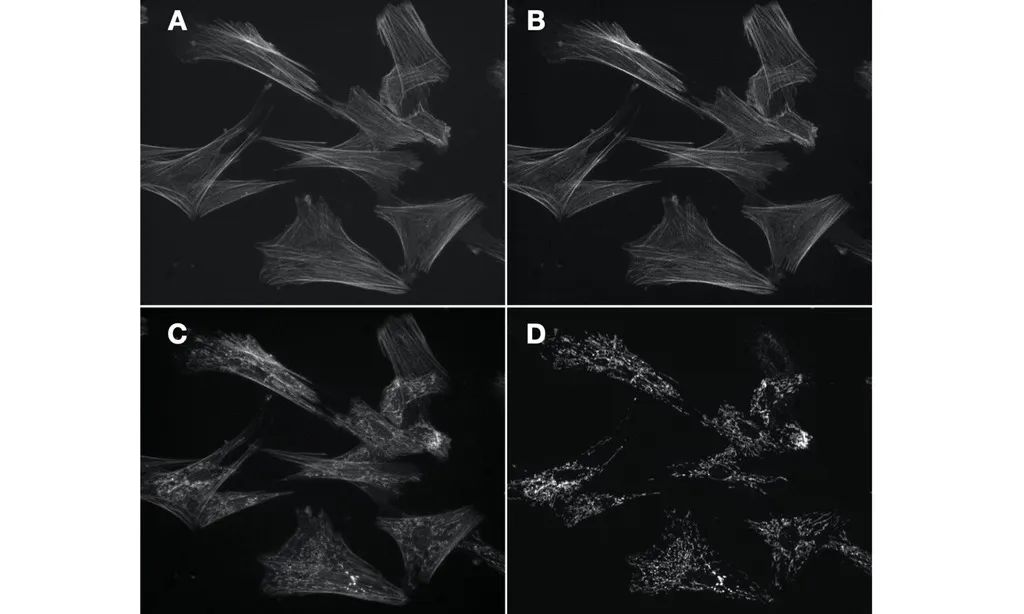
图 2. 使用单波段激发获得的肌动蛋白细胞骨架图像与线粒体细胞图像然而,光谱鉴别的方法并不能适用所有场景。目前光谱鉴别的最大局限在于光谱串扰,其适用范围仅限于大约五个目标(如图 1 和 2)。在上面的例子中,虽然只有两个荧光标记,但是它们的激发和发射波长跨越了整个可见波长范围( 400–700 nm)。而在当前使用的数千种不同染料和 FP 中,荧光激发和发射的光谱带宽几乎没有变化,较宽的光谱范围限制了光谱鉴别的多重荧光检测技术的进一步应用。目前,大规模生物系统的基因组和转录组研究可能需要同时识别和定位成百上千的分子靶标,这种高度并行的分析超出了基于光谱鉴别的多路复用的能力。尽管已经开发出具有窄发射光谱的量子点纳米晶体 [3],但与有机染料相比,这种改进的代价是荧光团尺寸增加了一个数量级以上,这反过来又阻碍了它们在双分子标记应用中的实用性 。

02 基于SPECTRA光源的
多重染色成像
由于光谱鉴别技术在多重荧光检测的局限性,研究者们为了扩大可检测目标数量而引入的一些新技术。
近期,有研究者提出,提出了一种直接的方法,可以从连续的全脑切片中生成一组综合生物标志物的读数,表征所有主要的脑细胞类型,范围从亚细胞区室、单个细胞、局部多细胞生态位到每个切片的全脑区域。通过对滤光片和标记试剂的仔细优化,以及对原始荧光图像数据的串扰和非特异性标记进行校正的稳健解混算法的应用,已经证明了脑组织的 10 色多重成像 [5]。
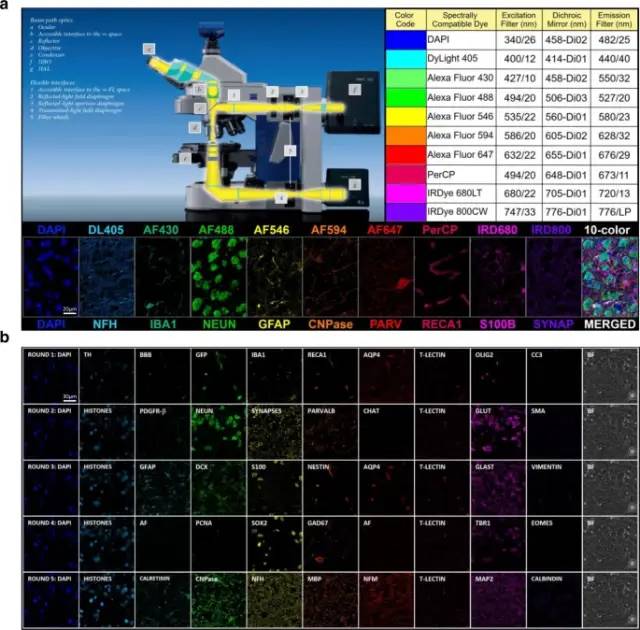
图3 多重 IHC 染色和多光谱广域落射荧光成像设备[5]
该成像平台在从紫外到近红外(350-800 nm)的整个可用光谱范围内,充分利用了广泛选择的光谱兼容荧光团的可用性。10 色多光谱成像所需的宽视场落射荧光显微镜组件包括配备高分辨率物镜、高灵敏度数码相机、广谱光激发源和 10 个独立的激发/二向色/发射滤光片组经过优化,可检测多达 10 种常用或定制的光谱兼容荧光报告分子,具有最小的光谱串扰。
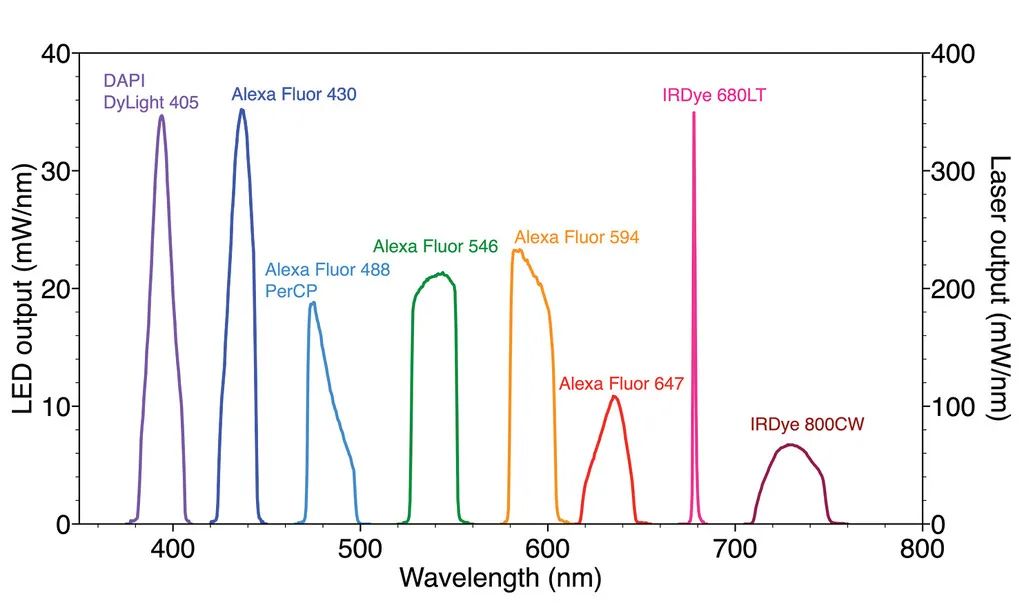
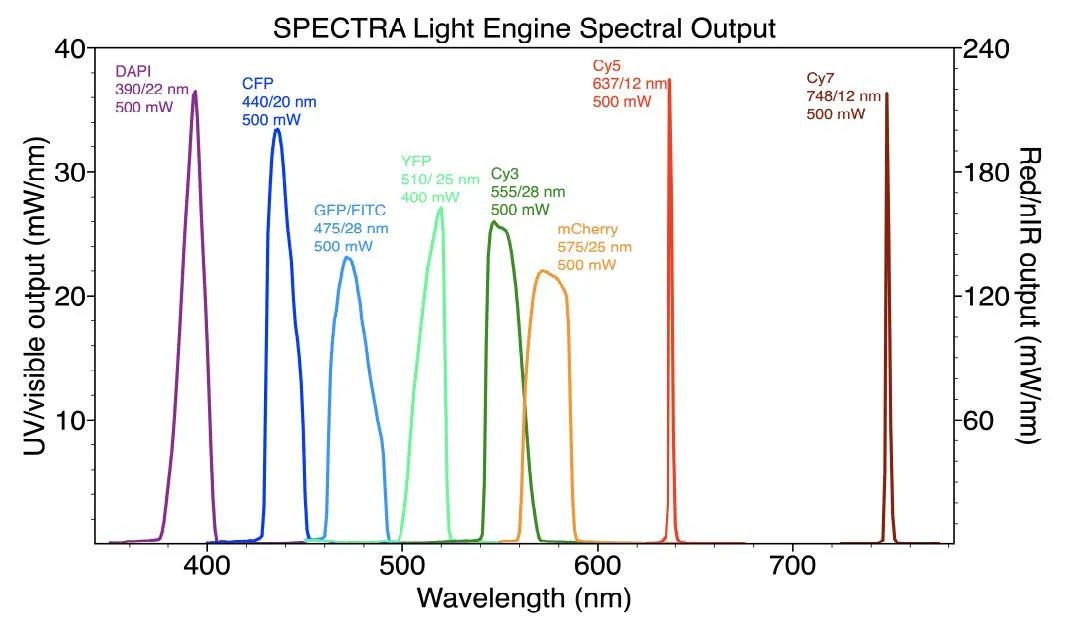
图 4. SPECTRA Light Engine 的光谱输出经过优化,可选择性激发用于 10 重免疫荧光检测的荧光染料 [5]。
图 4显示了针对本技术中使用的荧光染料面板的选择性激发而优化的虹科 SPECTRA 光源 的光谱输出。光源结合了 LED、光管和激光器,以实现所需的光谱激发分布和所需的光功率。使用相同的荧光染料面板和滤光片配置,可以通过连续几轮的剥离、重新标记和成像来增加多路复用的程度。
通过五个循环的剥离、10 色重新标记和成像,以及专业的隔离算法与深度学习,已经实现在整个大鼠脑冠状切片中同时定位 50 个生物标志物目标 [5]。

03 基于CELESTA光源的
MERFISH技术
通过将空间和时间维度添加到基于光谱辨别的多路复用中,已经开发出能够同时识别和定位成百上千个生物分子目标的多路复用技术 [6]。在相当大的程度上,这些技术利用核酸杂交既可以识别 DNA 和 RNA 分子靶标,也可以作为产生荧光染料顺序排列的模板。
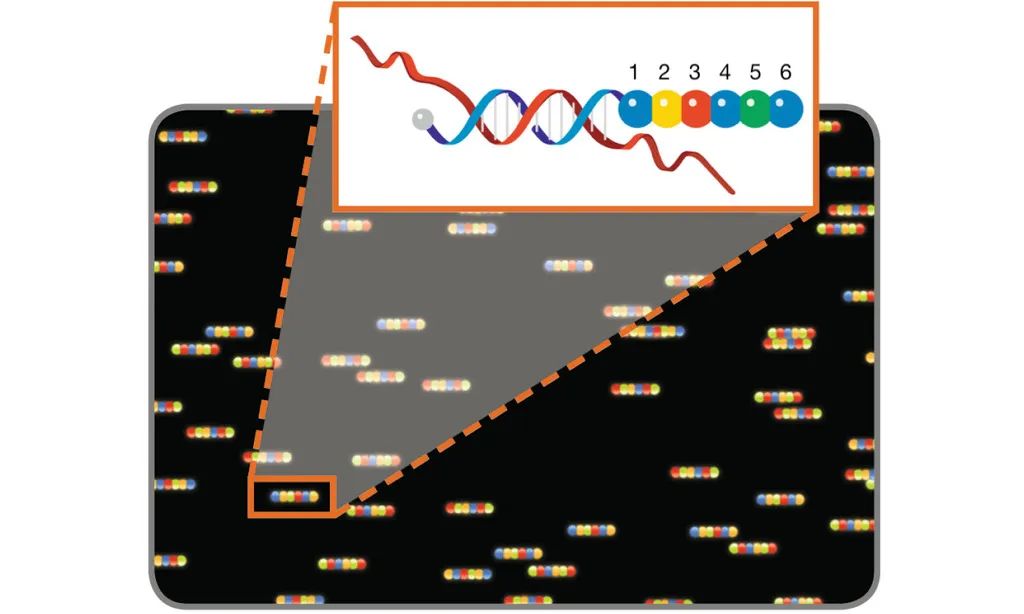 图 5. 用于基因表达分析的分子条形码扫描原理。带有激发和发射滤光片的扫描仪可识别由蓝色、绿色、黄色和红色圆圈表示的 4 种染料,从探针位置 1 到 6 读取荧光信号,以揭示杂交核酸靶标的编码身份。基于此原理的MERFISH(多重误差鲁棒荧光原位杂交)技术可以实现大规模多重单分子成像,能够同时测量单细胞中成百上千个目标 RNA 的拷贝数和空间分布 [9]。在 MERFISH 中,目标相关的条形码被迭代读取。首先,编码寡核苷酸探针与目标 RNA 杂交。然后连续添加荧光染料标记的读出寡核苷酸探针,在单分子水平上进行空间定位,然后熄灭。读出探针必须专门与编码探针杂交,而不是与细胞核酸杂交。编码探针身份在连续成像周期中累积,如果通过读出探针的杂交检测到编码探针,则分配二进制位值“1”,否则分配“0”值。通过在每个循环中同时检测具有光谱不同荧光标记的读出探针,可以减少杂交 + 成像循环的数量,从而减少完成数据采集所需的时间。
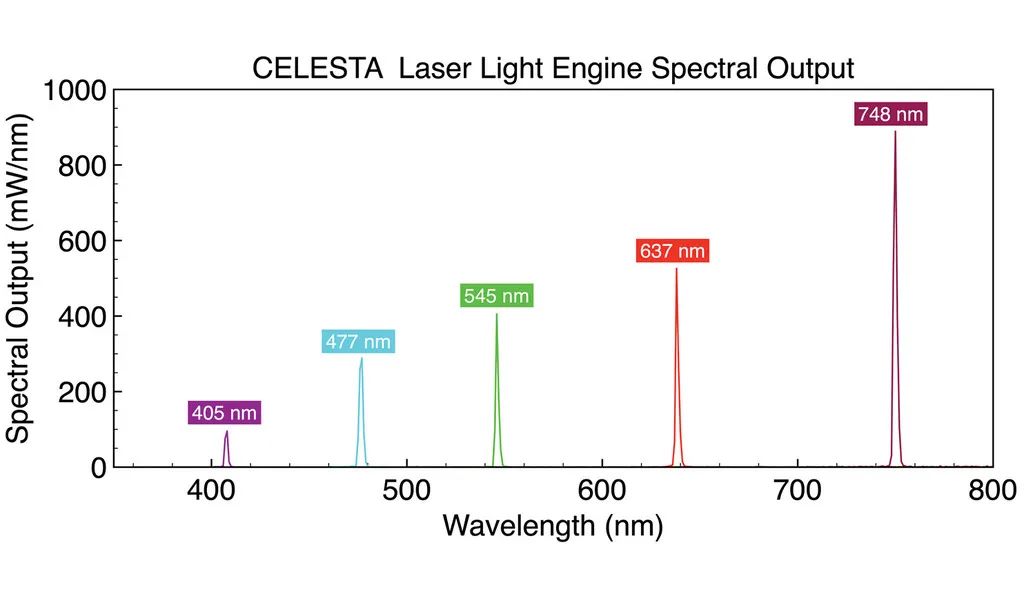
图 5. 用于基因表达分析的分子条形码扫描原理。带有激发和发射滤光片的扫描仪可识别由蓝色、绿色、黄色和红色圆圈表示的 4 种染料,从探针位置 1 到 6 读取荧光信号,以揭示杂交核酸靶标的编码身份。基于此原理的MERFISH(多重误差鲁棒荧光原位杂交)技术可以实现大规模多重单分子成像,能够同时测量单细胞中成百上千个目标 RNA 的拷贝数和空间分布 [9]。在 MERFISH 中,目标相关的条形码被迭代读取。首先,编码寡核苷酸探针与目标 RNA 杂交。然后连续添加荧光染料标记的读出寡核苷酸探针,在单分子水平上进行空间定位,然后熄灭。读出探针必须专门与编码探针杂交,而不是与细胞核酸杂交。编码探针身份在连续成像周期中累积,如果通过读出探针的杂交检测到编码探针,则分配二进制位值“1”,否则分配“0”值。通过在每个循环中同时检测具有光谱不同荧光标记的读出探针,可以减少杂交 + 成像循环的数量,从而减少完成数据采集所需的时间。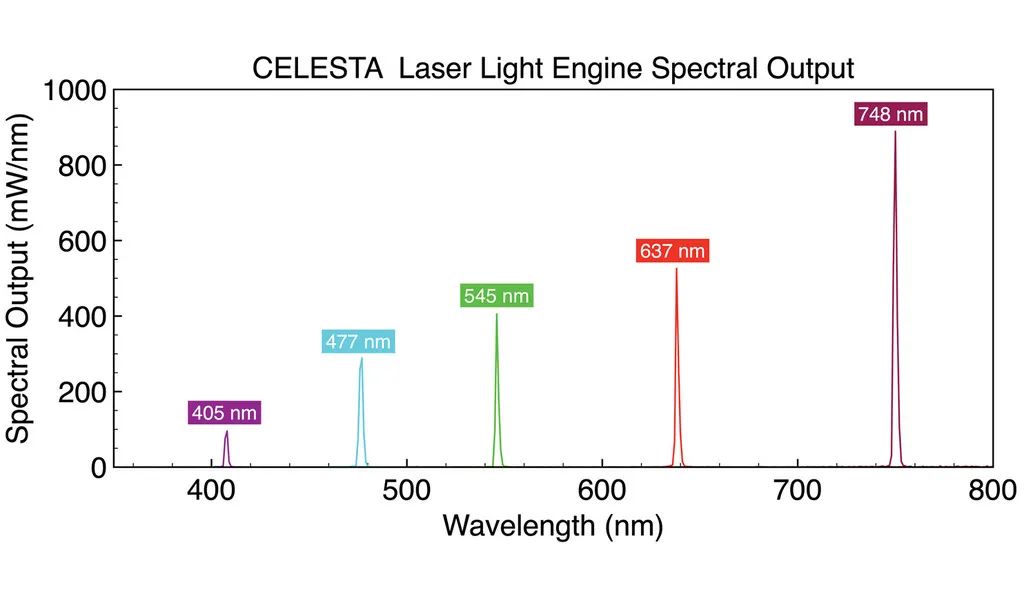 图 5. CELESTA 激光引擎光谱输出针对 MERFISH 多路复用单分子成像进行了优化。
图 5. CELESTA 激光引擎光谱输出针对 MERFISH 多路复用单分子成像进行了优化。
MERFISH 需要与典型 sCMOS 相机传感器的尺寸 (~200 mm2) 相匹配的高强度、空间均匀的照明场。为了满足这一要求,研究者们在显微镜中安装了一个与 虹科 CELESTA 光源(图 5)的光纤输出耦合的专用临界落射器,通过具有高数值孔径的高放大倍率物镜在样品平面上提供每平方厘米1-10W的光强度。
显然,高度平行的荧光标记生物分析,那些需要多路复用超过简单光谱辨别能力的分析,可以通过明智地选择荧光、滤光片、微调激发照明和智能算法来实现。分子条形码等巧妙的标记策略也可用于各种生物样品,以增强来自高度复杂组织标本的生物分子信息的光谱辨别和空间分布。
在虹科固态光源的纯净、明亮、稳定的照明性能的支持下,能够有效克服可见波长内定义的历史限制,能够实现最高通量、最优质量的多路复用荧光检测效果。


虹科固态光源介绍


虹科SPECTRA
虹科SPECTRA固态光源拥有8个可单独控制的固态光源,提供了空前的性能。每个色带在液体光导的末端提供大约半瓦的光功率。组成光源包括LED,专利的冷光灯和激光光源。
光源的输出通过内部集成的带通滤光片优化。光输出端口具有内置适配器,可通过标准的3mm直径的液态光导LLG连接到显微镜和其他生物分析仪器。为满足需要快速(10us)切换的应用,所有八个信号源均提供了TTL触发输入。


虹科CELESTA
虹科 CELESTA 和 CELESTA quattro 光源包括4-7个可单独控制的固态激光光源阵列(在400-800nm范围提供7个可选波长),并且支持快速切换。CELESTA 光引擎在1.5mm直径光纤的远端出光,其7个激光器中的每一个都能提供约1W的输出功率。
同样,CELESTA quattro 光源以相同的输出功率规格提供了一个具有性价比的4或5线选择。激光输出与复杂的控制和监测系统相结合,为旋转盘共聚焦显微镜、空间分辨率转录组学和其它高级成像应用提供所需的高清晰度性能。
- 相关推荐
- 热点推荐
- 检测
-
频分多路复用和时分多路复用的区别有哪些2024-05-07 6158
-
如何在Mx1051的FlexCAN1中配置简单信号多路复用和扩展信号多路复用?2023-05-05 652
-
[6.4.1]--多路复用器李开鸿 2022-11-13
-
AD8184-EB是用于视频路由和多路复用系统的单路4:1模拟多路复用器评估板2020-06-17 1891
-
多路复用ICSP引脚如何控制开关?2020-04-01 2463
-
基于模拟开关和多路复用器的应用基础知识2017-09-06 1337
-
什么是异步时分多路复用(ATDM)2010-04-03 2155
-
时分多路复用(TDM),时分多路复用(TDM)的原理是什么?2010-03-19 11251
-
复用器的多路复用2010-01-07 1359
-
多路复用技术2009-06-27 1234
-
非多路复用与多路复用总线转换桥的设计与实现2009-03-28 1195
全部0条评论

快来发表一下你的评论吧 !

