

点成案例 | 利用微流控平台探究剪切应力在黑色素瘤转移中的潜在功能
描述
一、前言
癌症的不良预后与肿瘤细胞转移的能力有关。
在转移过程中,血液或淋巴管中循环的肿瘤细胞可以粘附并穿过内皮侵入结缔组织。大多数与癌症相关的死亡是由转移形成引起的。从肿瘤细胞与原发性肿瘤分离开始,到侵入组织,进入血管或淋巴管(内渗),并运输到远程部位。
人们普遍认为,肿瘤细胞随后可以从微血管系统中逃逸(外渗),侵入靶组织并在远处器官中形成继发性肿瘤。
因此,在转移中一个潜在的限速步骤是外渗,该过程涉及肿瘤细胞与内皮细胞的粘附,以及通过内皮细胞单层和基底膜的迁移。黑色素瘤是最具侵袭性的皮肤癌之一,它会侵入皮肤的深层,并有早期转移的倾向。
为了深入了解黑色素瘤细胞转移的机制,本文介绍了一种利用Cellix VenaFlux平台研究生理剪切流条件下黑色素瘤同基因模型中不同细胞粘附情况的应用实例。
二、实验方法
1. 细胞收获
黑色素瘤细胞系(1205-Lu、WM793、WM793-P1和WM793-P2)和绿色荧光蛋白标记的黑色素瘤细胞系GFP-1205Lu维持在含有GlutaMAX(Invitrogen)的DMEM中,辅以10%胎牛血清、100 U/ml青霉素、100 µg/ml 链霉素和 4 µg/ml 胰岛素。人脐静脉内皮细胞系 (HUVEC) 维持在含有1g/L葡萄糖 (Invitrogen)、补充有10%胎牛血清、5 ml/L庆大霉素和10 ml/L两性霉素B溶液的DMEM中。
2. Vena8 Fluoro+ 生物芯片涂层
Vena8 Fluoro+生物芯片(400µm宽,100µm深)在涂上BSA (10 µg/ml)阻断非特异性结合之前,在4°C的潮湿条件下用rhICAM-1(10 µg/ml)、rhVCAM-1(10 µg/ml) 或纤连蛋白(20 µg/ml)包被过夜。两个额外的通道在室温下用BSA涂敷两小时。在剪切实验之前,所有通道都用培养基洗涤三次。
3.VenaEC 生物芯片培养程序
将VenaEC生物芯片置于35 mm培养皿中(面积 9.61 cm^2)并在细胞接种前进行紫外线消毒20分钟。将HUVEC细胞以75,000个细胞/cm^2 的密度接种在生物芯片上,并使其融合48小时。组装的生物芯片(微通道600µm 宽,120µm深)在10 dyne/cm^2的剪切应力下预处理10分钟,然后在0.5 dyne/cm^2 的剪切应力下预处理10分钟。
4.附着力曲线和图像捕获
将黑色素瘤细胞系1205Lu、WM793、WM793-P1和WM793-P2(浓度5 x 10^6个细胞/ml)在 (A) 0.5 dyne/cm^2 的限定剪切应力下注入涂层通道,持续时间为 5 min(累积测定)或 (B) 5、2 和 0.5 dyne/cm^2 的递减梯度剪切应力,持续时间为 2 min/剪切应力。使用Cellix的VenaFlux分析软件捕获图像并使用Image Pro Premier软件进行分析。从四个实验中获得数据并导出到Excel中以进行进一步分析。
使用VenaEC生物芯片检查GFP-1205Lu细胞的粘附特性。GFP标记的细胞在汇合的HUVEC单层上受到0.5dyne/cm^2的剪切应力。在配备LD A-Plan 20x/0.30物镜、0.5x相机适配器和DeltaPix DP200相机的Zeiss Axiovert 25 CFL显微镜上使用相差对单层进行成像。然后使用Zeiss滤光片组#9(激发BP450-490 nm,发射LP515)对荧光标记的黑色素瘤细胞进行成像。
三、结果与讨论
在这项研究中,WM793、WM793-P1和WM793-P2细胞在0.5 dyne/cm^2的恒定剪切应力下没有粘附到指定的粘附子上,而1205-Lu细胞在类似的剪切下粘附到V-CAM上(图 1)。为了确定1205Lu细胞粘附到V-CAM的阈值剪切应力,施加了5、2和0.5 dyne/cm^2的递减剪切应力,这导致1205-Lu细胞在剪切应力低于2dyne/cm^2时粘附增加(图 2)。GFP-1205Lu细胞受到0.5 dyne/cm^2的剪切应力,并记录到与内皮细胞的粘附(图 3)。
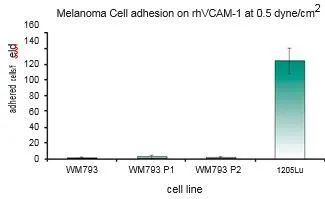
图1:黑色素瘤细胞在0.5dyne/cm^2 的恒定剪切应力下粘附到rhVCAM-1
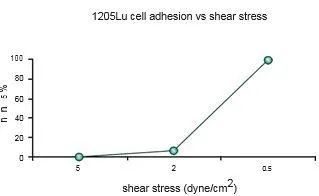
图2:1205Lu细胞粘附到rhVCAM-1上的阈值
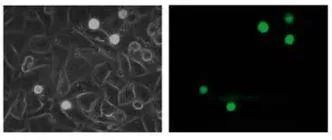
图3:GFP-1205Lu粘附在内皮细胞上的代表性显微镜图像
同基因模型系列由致瘤性差的黑色素瘤亲代细胞系WM793及其衍生物WM793-P1、WM793-P2(来自小鼠在WM793注射部位发育的肿瘤)和1205-Lu(小鼠皮下注射WM793后发生自发性肺转移,与亲本系相比,在体外显示出生长、侵袭和致瘤性增加)。
我们的研究结果表明,剪切应力在外渗过程中起重要作用。
1205-Lu细胞在较高剪切应力下附着于V-CAM的能力可能有助于其外渗能力,从而有助于其转移。有趣的是,除了1205-Lu细胞外,所有细胞系在静态条件下都具有高度粘附性,但在流动条件下却无法粘附。
VenaFlux平台
VenaFlux平台是第一款半自动化的微流控平台,能在模拟体内流速的剪切流下执行细胞滚动、结合/粘附和迁移研究,可满足剪切流下进行细胞检测的高通量需求。

-
求助:请问一下皮肤黑色素怎么测量啊?2012-11-17 2921
-
具备机器学习能力的黑色素瘤自动侦测工具来袭 可提前发现2017-01-01 713
-
黑色素瘤类型现在可以用AI查出来了吗2019-11-23 1057
-
科学家通过深度学习算法检测黑色素瘤2021-02-19 2548
-
利用微流控平台探究剪切应力在黑色素瘤转移中的功能2022-08-19 1318
-
通过微流控系统来模拟并研究血管中的脉动剪切应力2022-09-06 2724
-
利用中空微针实现高效皮内递送治疗非黑色素瘤皮肤癌2022-10-31 2817
-
点成分享| 如何探究剪切力在细胞层面的影响?微流控芯片来帮你2021-09-15 2794
-
用于血栓模型体外研究的时空可控微流控剪切应力生成器2024-05-14 1372
全部0条评论

快来发表一下你的评论吧 !

