

金属离子与质子:跟踪插入到水系电池阴极氧化物的电荷载流子
描述
研究背景
水系电解液中的质子可以作为水系可充电电池中除主载体阳离子之外的另一种类型的电荷载体用于插入/萃取。尽管关于质子效应有许多不同的说法,但在过去十年中,在没有直接证据的情况下,已经报道了相互矛盾的实验结果及其解释。因此,系统的检查和分析是阐明在水系可充电电池中质子嵌入状况的必要条件。近日,韩国首尔国立大学Jang Wook Choi &韩国科学技术院Sung-Yoon Chung团队利用V2O5阴极和烧杯型电池,在充足的ZnSO4电解液中,证明了在低pH条件下(pH≤3.0),质子先于锌离子插入阴极。与之形成鲜明对比的是,在硬币型电池中,当pH变高(pH≥4.0)或电解质体积相当低时,质子对放电电压和容量的影响不显著。在钠离子、镁离子和铝离子电解质中也证实了依赖pH的质子插入的类似行为。为了解决关于质子插入的争议,本研究强调质子的影响在很大程度上取决于水系电池中电解液的pH值和相对体积。
研究亮点
本文利用V2O5正极材料,研究了不同pH电解液中的载流子的差异,并在不同金属离子电解液体系中得到了验证。对于水系电池中嵌入载流子的讨论具有重要意义。 在充足电解液,低pH条件(pH≤3.0)下,质子插入通常发生在相对较高的电位,此外对于放电容量具有较明显的影响。而在少量电解液的情况下,没有发现放电行为的实质性差异,表明质子对此没有显著影响。
因此在评价质子在水系电池中的作用时,需要综合考虑正极材料与电解液的相对质量比例以及pH值。
图文导读
图1. 不同pH值电解液放电行为的比较.
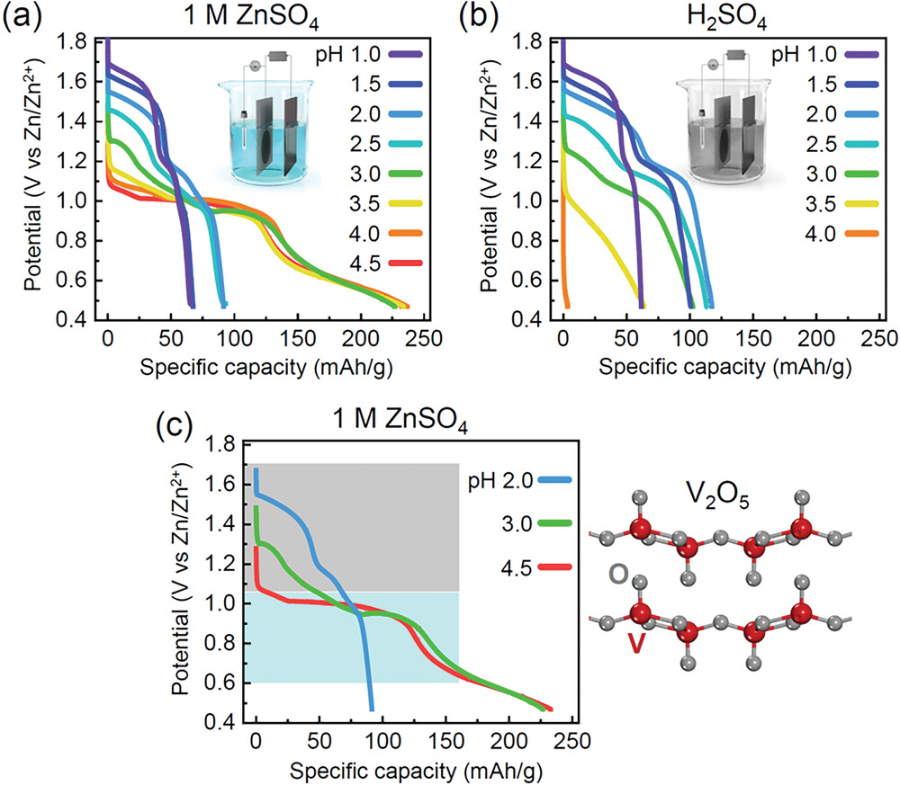
所有恒流放电曲线均在烧杯型电池中得到。a)电池内电解液采用1 M ZnSO4水溶液。为了调整pH值,将H2SO4溶液与每种电解液相应混合。b)仅使用不含锌盐的H2SO4溶液作为电解液。c)在ZnSO4电解质中获得的三条具有代表性的放电曲线。两个电位范围分别用灰色和青色阴影表示。
▲通过比较在不同pH环境下的放电曲线,观察到在pH≤3.0的情况下,放电初期出现的高电位与质子插入有关。这与pH为1.0-3.0的H2SO4溶液中获得的在1.1-1.7 V之间的放电曲线几乎相同。而在pH≥3.5时,H2SO4电解液中几乎没有明显的放电容量,证明了低pH下质子的电化学插入。
图2. 不同放电深度下阴极颗粒中锌的能谱图.
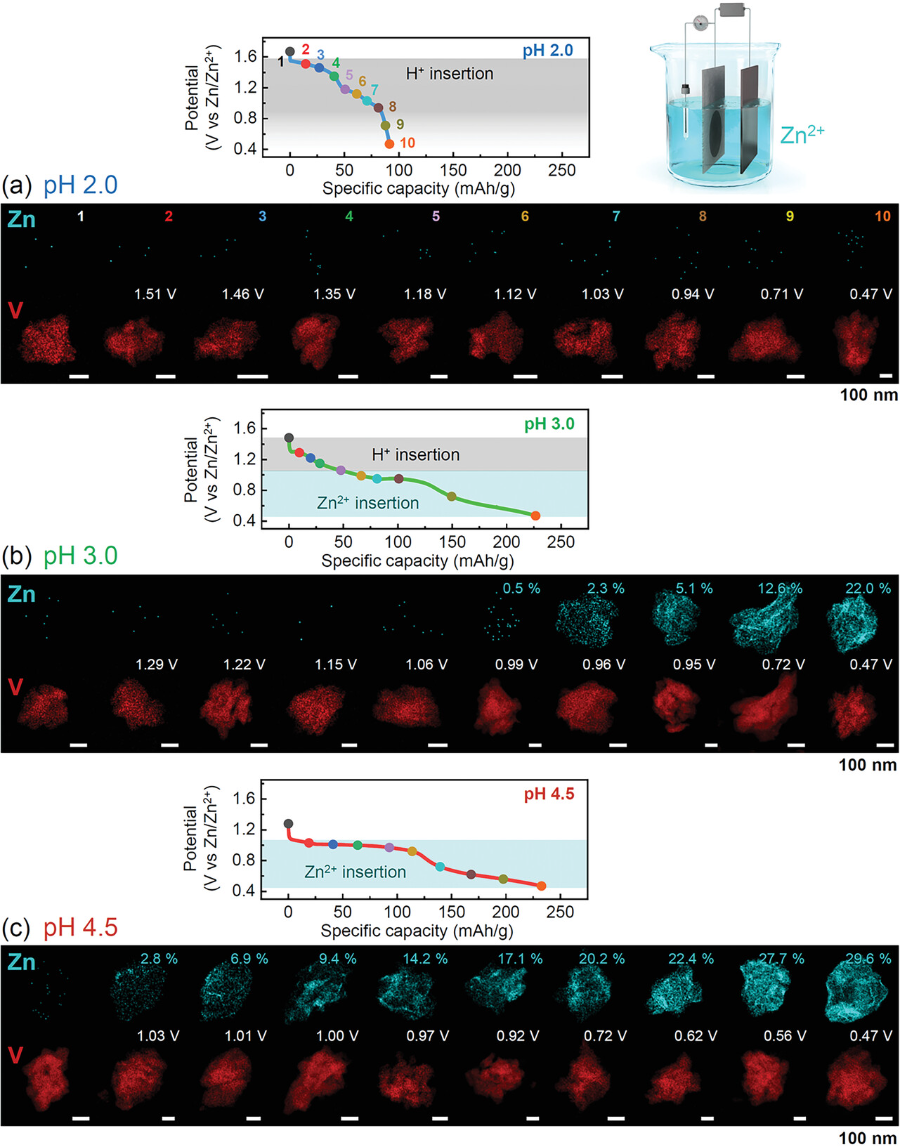
在三种pH条件下,分别得到10张EDS maps:a) pH 2.0;b)3.0;c) 4.5。与pH值为4.5时Zn含量逐渐增加相比,pH值为2.0时没有Zn插入,pH值为3.0时整个放电过程中从0.99 V开始检测到显著的Zn特征。还给出了锌的定量浓度。
▲利用EDS能谱图直接可视化了在三种不同pH条件下的V2O5颗粒中插入了多少锌离子,作为放电深度的函数。在pH 2.0的情况下,几乎没有检测到锌,有力地支持了质子是电化学插入的主要电荷载体而非锌离子。而在高pH条件下(图2c),没有观察到1.2 V以上的高电位放电平台,并且从放电开始Zn浓度一直在增加。因此,在该pH条件下,质子对总容量几乎没有贡献。
图3. 不同放电深度下V2O5的三组XANES光谱.
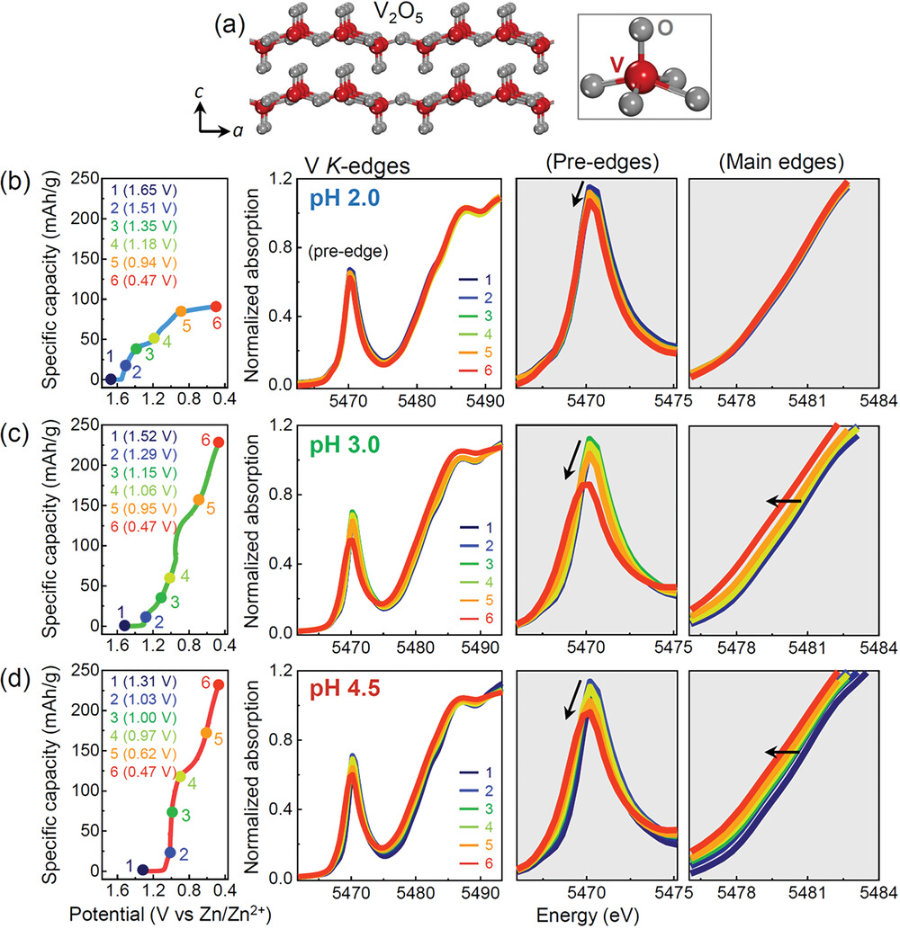
a)给出了V2O5的晶体结构。五个非中心对称氧配体在放大图中呈现。在3种pH条件下分别得到6个光谱:pH为b) 2.0;c) 3.0;d) 4.5。
▲对不同pH环境下六种不同放电深度的样品进行XANES分析。由于V与五个非中心对称的氧配体配位(见图3a的插图),这种强烈扭曲的氧方锥体环境偏离了对称的氧八面体,从而导致了V 3d态与O 2p态的大量混合。因此,额外的偶极禁止1s→3d跃迁导致V2O5中存在吸收预边。除了主边缘的低能位移外,预边缘强度的降低是V2O5氧化态降低的另一个标志。在pH为3.0和4.5的情况下,随着放电反应的进行,主吸收边向较低能量值移动,预边强度减小(图3c,d),这直接表明V被还原了。在pH为2.0的情况下,主吸收边的移动没有明显的区别,但预边缘的强度明显降低(图3b)。因此,结合图2a中没有Zn的EDS图和图3b中的XANES光谱,提供了在低pH条件下放电反应中质子插入的一致证据。
图4. V2O5粒子的三组EXAFS光谱和HAADF STEM图像.
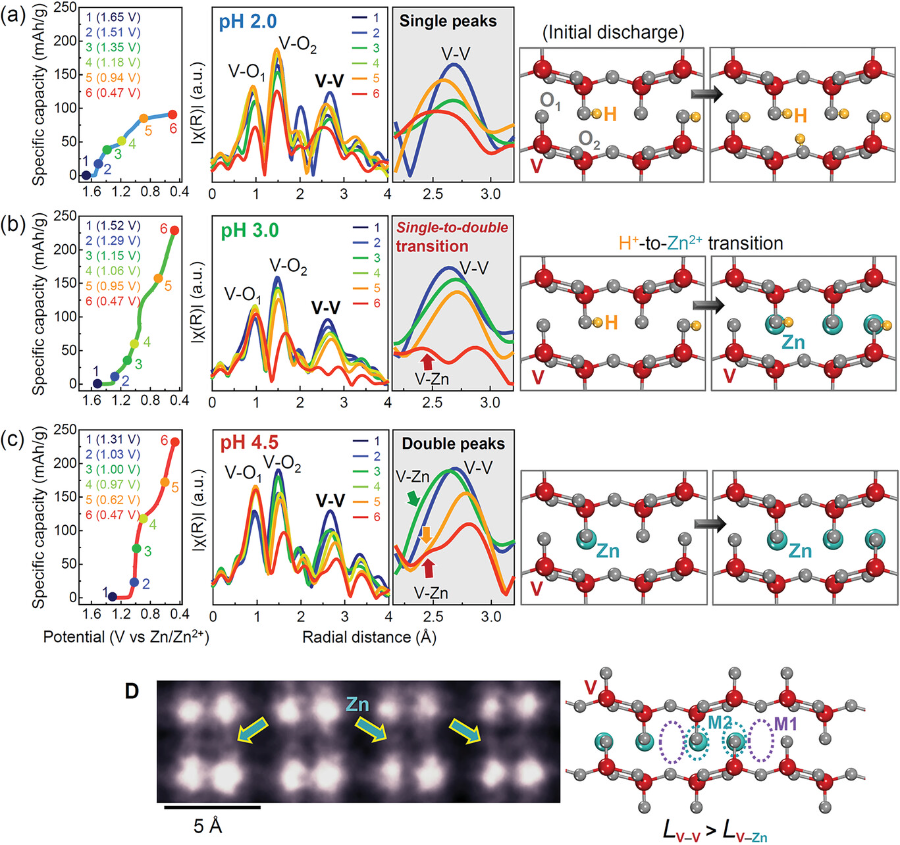
在以下三种pH条件下,电解质在不同放电水平下的傅立叶变换光谱分别为:a) pH 2.0;b) 3.0;c) 4.5。在每种情况下,表示V-V的峰在中间一列中被放大,并附有载流子离子插入的示意图。d) HAADF-STEM图像显示Zn嵌入到V2O5框架中。如图中箭头所示,直接说明Zn占据了M2的间隙位,而不是M1的间隙位。LV-V和LV-Zn分别表示V-V和V-Zn的键距。
▲傅里叶变换光谱中的前两个主要峰来自两个不同的V-O键,第三个峰对应于V-V键。从图4a中间列放大图中可以看出,在pH为2的情况下,整个放电过程中V-V峰之间的单峰形状没有变化。而随着放电反应的进行,在pH为3.5的条件下,由最初的单峰型V-V峰转变为双峰型。图4b中V-V峰的红色箭头说明了另一个峰的出现,这个峰是由插入到间隙位置的Zn离子作为V-Zn形成的。图4b中的一系列EXAFS光谱揭示了在放电初始阶段首先插入质子,然后Zn离子参与了低于1 V (vs Zn/Zn2+)的放电反应。
图5. 不同放电深度下的XPS结果.
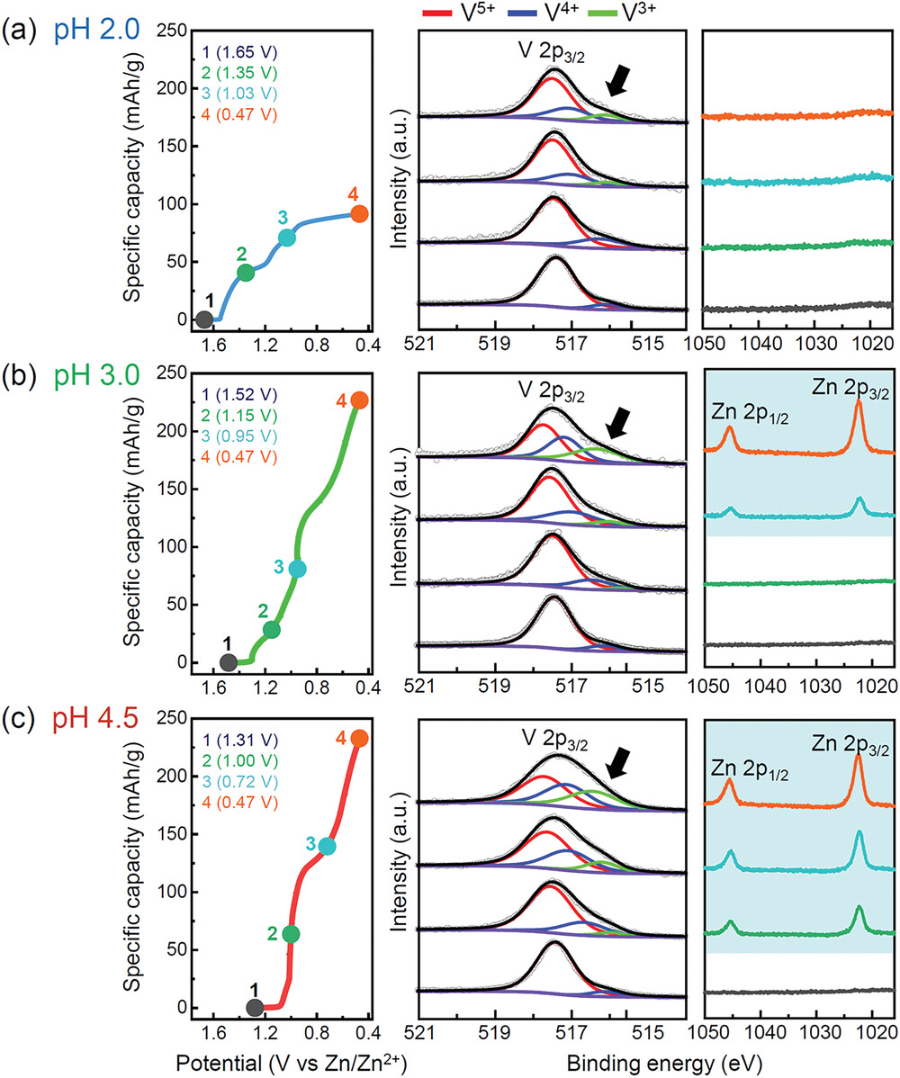
对在3种pH电解液中放电的阴极颗粒进行了非原位XPS分析:(a) pH 2.0;b)3.0;c) 4.5。在所有三个样品中,V4+/3+肩峰(黑色箭头)的一致出现表明放电反应是通过H+或Zn2+插入发生的。在pH为3.0和4.5的情况下,XPS对Zn的检测结果与图2所示的EDS图吻合较好。
▲图5a中未检测到Zn的存在,表明在低pH条件下无锌离子插入。而在V 2p3/2峰附近出现一个较低结合能的宽峰,表明V5+由于质子插入还原为V4+和V3+。在图5b中,当pH为3.0时,在0.95 V之前没有检测到Zn,尽管在整个放电反应过程中,V4+/V3+峰的强度逐渐增加。因此,这些XPS结果与之前的结论一致,一致支持插入载流子随着pH增加从H+向Zn2+的转变。
图6. 钠、镁、铝在不同放电深度下的EDS maps.
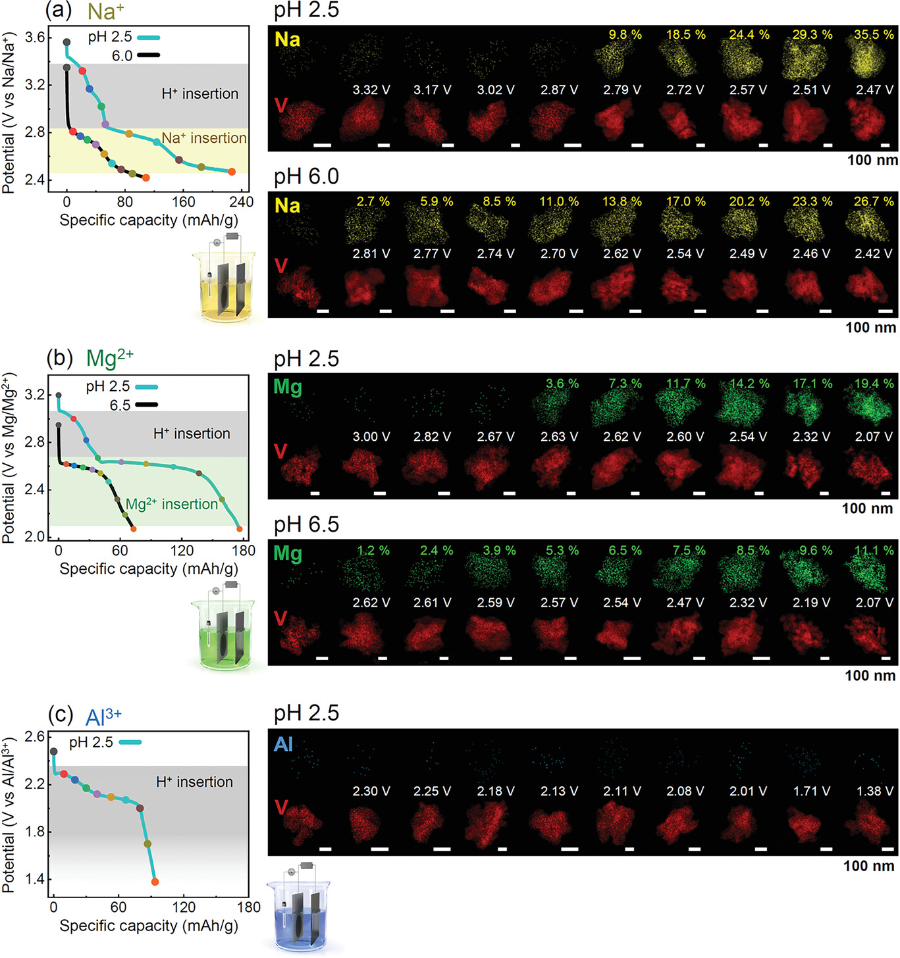
在烧杯电池放电过程中,使用了含有a) Na2SO4,b) MgSO4和c) Al2(SO4)3的电解质来检测其它化学物质作为插入载体。在低pH条件下(pH 2.5),质子在高电位范围内的插入似乎在所有三种情况下都占主导地位。
▲同时,作者发现这种依赖于pH的插入-载流子转变不仅局限于锌离子化学,而且在其它体系中也可以观察到。在低pH环境下,质子在更高的放电电压内嵌入,先于三种阳离子。而在高pH条件下(6.0 ~ 6.5)放电时,每种阳离子都是主要的插入载流子。其中,使用Al2(SO4)3盐无法获得高pH电解液(pH>2.5)。有趣的是,在硫Al2(SO4)3电解液中,整个放电过程中都没有检测到Al,这表明与Al/Al3+相比,Al插入的放电电位远低于1.4 V。
图7. 硬币型电池试验中阴极颗粒中Zn的放电曲线和EDS maps.
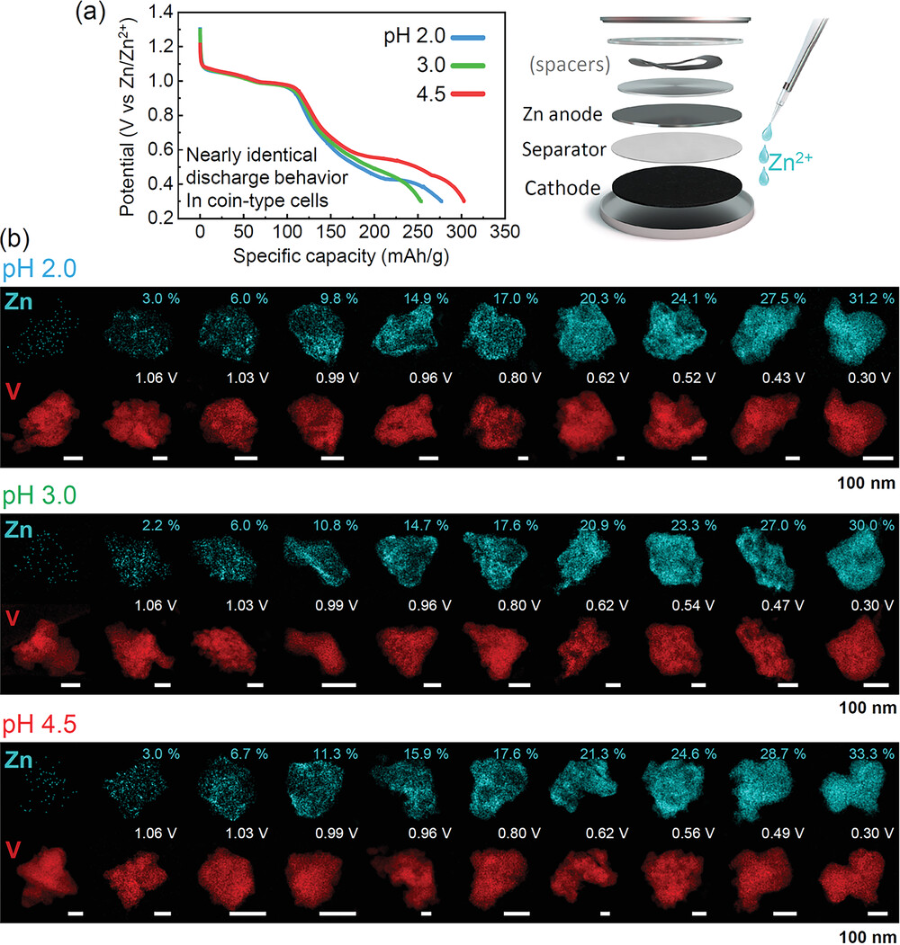
a)无论硬币电池中电解质的pH值如何,都可以确定几乎相同的放电行为,其中采用了非常少量的电解质。b)三个样品从放电反应开始就检测到Zn。各V2O5颗粒中锌的定量浓度也在图中给出。
▲尽管电解质是不可缺少的组成部分,但通常需要最少量的电化学非活性电解质来最大化电池系统的总体体积能量密度。于是使用极少量的电解液(70μL)和锌金属阳极组装成硬币型电池进行同样的分析。图7显示不同pH条件下表现出几乎相同的放电行为(图7a),和从放电开始阴极颗粒中的Zn浓度就开始逐渐增加(图7b)。证明了当采用少量电解质时,放电过程中没有明显的质子插入。
研究总结
本研究提供了一组一致的实验分析和测量,证明了电解液中质子对水系条件下氧化物阴极放电电压和容量的影响。虽然本文在这项工作中处理的是一种单一的氧化物阴极材料,但通过使用含有大量电解质的烧杯电池,证明了在低pH条件下(pH≤3.0),质子插入可以先于Zn2+和其他阳离子(包括Na+,Mg2+和Al3+)的插入。相比之下,在使用少量电解质的硬币电池测试中,在三种不同的pH条件下,没有发现放电行为的实质性差异,这表明质子对此没有显著影响。因为质子的总数也取决于电解质的体积,所以在评价质子在水系电池中的作用时,正极材料的质量与电解液质量之间的相对比例以及pH值似乎是另一个需要考虑的重要参数。
审核编辑:刘清
-
金属氧化物异质结光电探测器研究进展综述2024-05-13 2991
-
带热脱扣的金属氧化物压敏电阻的优点2023-08-22 1443
-
钠离子电池正极可逆氧变价机理概述2020-12-25 1592
-
金属氧化物有望成为下一代锂离子电池的关键材料2020-09-10 2277
-
载流子——电流的搬运工2019-12-06 2325
-
氧化物半导体甲烷敏感元件详解2018-10-24 4720
-
固体氧化物电池的原理及系统结构2018-02-04 14685
-
金属氧化物太阳能电池研究取得突破2016-03-07 2686
-
锂离子电池锂锰氧化物正极的研究进展2010-09-19 569
-
金属氧化物气敏传感器(VI)2010-02-26 1141
-
(MOV)层叠金属氧化物压敏电阻2009-11-21 3090
-
金属氧化物陶瓷湿敏元件2009-11-12 1533
-
金属氧化物气敏传感器-52009-04-06 603
-
金属氧化物气敏传感器2009-03-31 451
全部0条评论

快来发表一下你的评论吧 !

