

利用微流控技术模拟骨仿生微环境促进乳腺癌进展机理研究
描述
乳腺癌是女性健康潜在威胁之一。临床研究表明,骨是晚期乳腺癌患者最常发生转移的部位之一,严重影响患者的生活质量。
在药物筛选和肿瘤病理研究中,传统二维培养的细胞模型难以准确分析肿瘤细胞与骨细胞之间的相互作用,给有效筛选和评估靶向乳腺癌骨转移的药物和治疗方案带来困难。
模拟骨仿生微环境对于构建乳腺癌骨转移体外模型至关重要。近年,基于微流控技术的细胞-细胞共培养体系,为肿瘤生长、转移等病理生理研究提供了新平台、新手段。
近日,西南大学余玲课题组开发了基于I型胶原蛋白修饰的尼龙线基(Col-I@thread)的乳腺癌-骨转移共培养装置。该研究利用线基装置易叠加-拆分的特点,量化了乳腺癌细胞向骨细胞侵袭的过程。分离出侵入骨细胞层的乳腺癌细胞,并分析其基因特征,探究了乳腺癌细胞与成骨细胞之间的相互作用及信号通路变化。
在该项工作中,研究人员通过冷冻干燥方法制备胶原蛋白修饰的尼龙线基(Col-@thread)用于细胞培养,分析了线基上三维生长的成骨细胞在基因表达、成骨分化功能等方面的变化。将Col-I@thread与聚氯乙烯片材制作的框架相组装,构建了乳腺癌-骨转移共培养模型。利用“指叉”共培养模型可分离、易拆卸的特点捕获了侵袭入骨细胞层的乳腺癌细胞和共培养后的成骨细胞,并通过转录组测序与独立培养的乳腺癌细胞和成骨细胞进行基因比对分析。
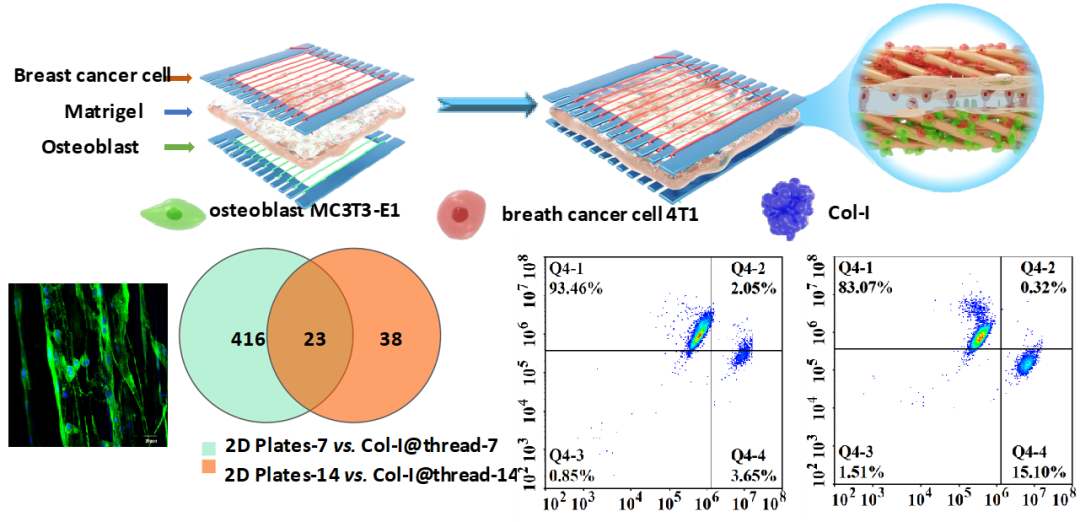
结果表明,Col-I@thread促进了成骨细胞钙离子分泌、成骨分化趋势和骨细胞矿化过程。乳腺癌-骨细胞共培养模型中分选出的侵入骨细胞层的乳腺癌细胞,其肿瘤相关基因CX43、CXCR5和CSPG4的水平升高。同时,成骨细胞的成骨分化基因RUNX2、RANKL和OPG受到抑制,提示乳腺癌细胞侵袭可以抑制成骨细胞的生长和骨分化功能,造成对成骨分化能力和骨微环境的破坏。
综上所述,该研究基于Col-I@thread构建的乳腺癌-骨转移共培养模型,模拟了骨基质微环境,为乳腺癌细胞和成骨细胞之间的生物学关系研究提供参考,在新药筛选和靶向乳腺癌骨转移治疗的研究中具有应用潜力。
审核编辑:刘清
- 相关推荐
- 热点推荐
- 微流控
-
基于逻辑回归算法的乳腺癌肿瘤二分类预测2019-06-18 3403
-
基于kNN算法可以诊断乳腺癌2019-06-21 2045
-
基于AMC7150的乳腺癌诊断系统设计_张云2017-03-19 952
-
HE染色乳腺癌组织病理图像分析2017-11-22 3789
-
DeepMind通过机器学习技术有助于改善乳腺癌2017-12-12 1114
-
英特尔携手汇医慧影,利用AI技术检查乳腺癌2018-09-30 1748
-
乳腺钼靶AI落地临床,乳腺癌患者的福音2018-10-19 3556
-
AI新闻:训练AI检测乳腺癌2018-11-05 2651
-
MIT研究员最新AI模型可提前5年预测乳腺癌风险!2019-05-11 5089
-
谷歌人工智能模型乳腺癌识别还存在什么没有完善的2020-01-03 1083
-
人工智能乳腺癌诊断能力精确 在防控乳腺癌的长期战斗中取得突破2020-01-07 902
-
复旦肿瘤医院与华米联手研究:可穿戴设备可促进乳腺癌康复2020-11-03 1941
-
乳腺癌-冠心病标志物的生物信息筛选技术2021-04-30 840
-
使用Movidius和UP2进行乳腺癌分类2023-06-13 696
-
MedCognetics利用AMD平台优化乳腺癌检测2025-11-02 566
全部0条评论

快来发表一下你的评论吧 !

