

贫电解液锂-硫电池正极的动力学评估
描述
研究背景
可充电电池在扩大可再生能源电力生产和应用规模方面发挥着关键作用。从20世纪90年代商业化的锂离子电池通过为电子产品和电动汽车提供动力,在便利的现代生活方式方面取得了巨大进步。然而,由于负极和正极的离子脱嵌反应机制,传统锂离子电池的能量密度正接近极限。迫切需要先进的高能量密度可充电电池以满足不断增长的需求和能量密度敏感的应用,如飞行器和航天器。锂硫(Li-S)电池在实现超越锂离子电池的实际高能量密度方面具有很大的前景。贫电解质条件是实现高能量密度锂电池的先决条件,尽管性能有所提高,但对贫电解质条件下硫正极动力学的基本理解仍然不足,特别是导致性能下降的关键动力学限制因素。因此,贫电解质条件下硫正极的关键动力学限制因素仍然存在争议。需要综合动力学分析,找到关键的动力学限制因素,指导实际条件下合理的动力学推广策略设计和电池性能提升。
文章简介
针对以上问题,北京理工大学黄佳琦教授与李博权副研究员团队对硫正极的极化进行了系统解耦,以确定贫电解质条件下锂硫电池中的关键动力学限制因素。具体而言,作者开发了一种电化学阻抗谱组合恒电流间歇滴定技术方法,将正极极化解耦为活化、浓度和欧姆部分。其中,随着电解质与硫比(E/S比)的降低,硫化锂成核过程中的活化极化成为主导极化,并且界面电荷转移动力学缓慢是贫电解质条件下电池性能下降的主要原因。因此,作者提出了一种双(氟磺酰)亚胺锂电解液来降低活化极化,采用该电解质的Li-S电池在0.2 C时,在低E/S比为4 μL mg−1的情况下提供了985 mAh g−1的放电容量。本工作确定了贫电解质锂硫电池的关键动力学限制因素,为设计合理的推广策略以实现先进锂硫电池提供了指导。
图文解读
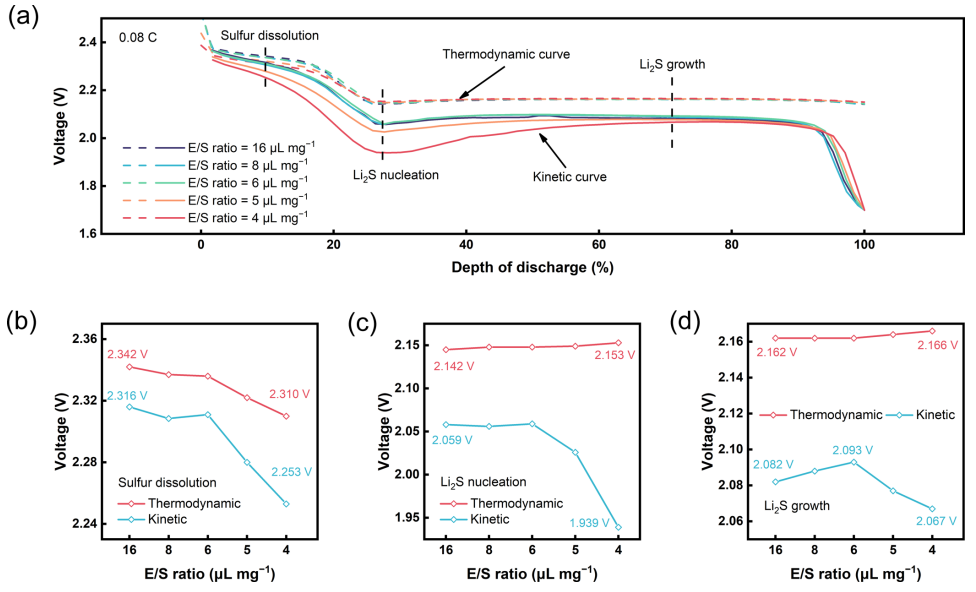
图 1. 不同E/S比下硫正极放电过程的热力学和动力学.(a)硫正极在E/S = 16、8、6、5、4 μL mg−1时的放电过程动力学曲线。E/S比分别为16、8、6、5和4 μL mg−1时(b)硫溶解阶段、(c)Li2S成核阶段和(d)Li2S生长阶段的热力学(红色)和动力学(蓝色)电压。
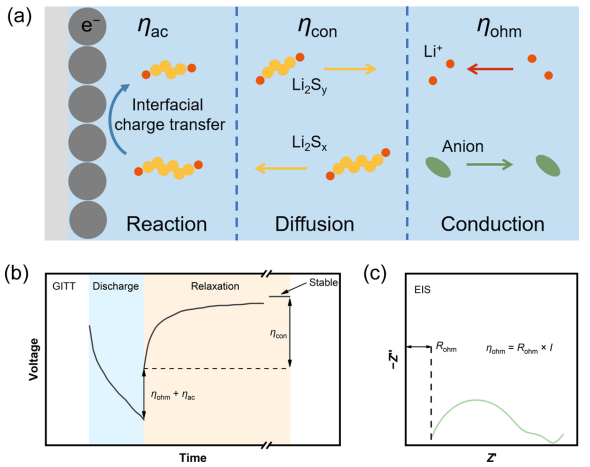
图 2. EIS-GITT动力学极化解耦方法。(a)界面电荷转移、反应物质扩散(Li2Sx、6≤x、Li2Sy、4≤x≤6)和电解液中离子传导的电极反应过程示意图,分别产生ηac、ηcon和ηohm。动力学极化解耦法在GITT(b)和EIS(c)测量中的机理。
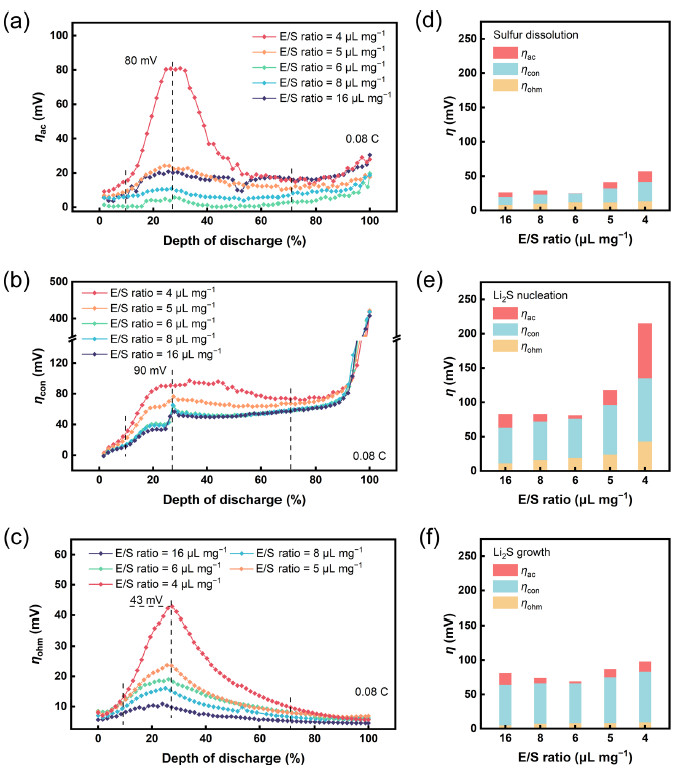
图 3. 不同E/S比下解耦正极动力学极化分析。(a)ηac、(b)ηcon和(c)ηohm在E/S比= 16、8、6、5和4 μL mg−1时在0.08 C电流密度下放电时的变化。E/S比= 16、8、6、5和4 μL mg−1时(d)硫溶解阶段、(e)Li2S成核阶段和(f)Li2S生长阶段的极化分析。
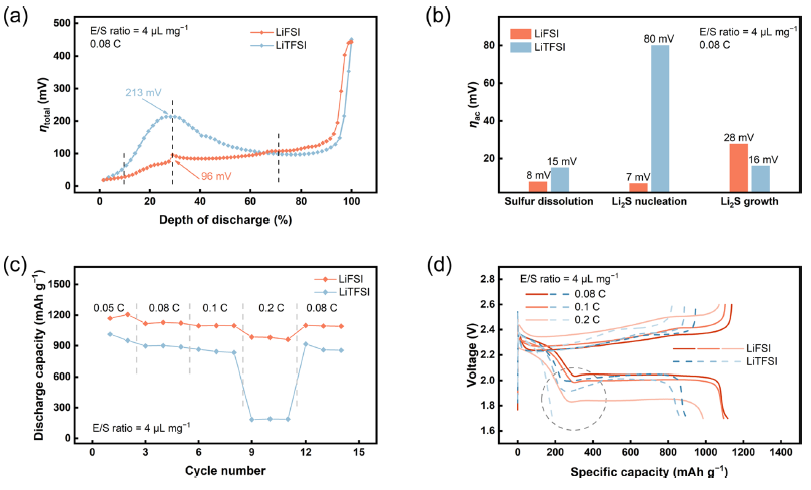
图4. 使用LiFSI电解质的贫电解质锂电池的动力学评价和电池性能。(a)在E/S比为4 μL mg−1,电流密度为0.08 C时,采用LiFSI电解质或LiTFSI电解质的贫电解质锂电池的全极化分析, (b)硫溶解、Li2S成核和Li2S生长阶段的解耦激活极化。锂硫电池在E/S比= 4 μL mg−1时的(c)倍率性能及(d)不同倍率下的充放电曲线。
研究结论
综上所述,本工作报道了贫电解质锂电池硫正极动力学的关键动力学限制因素是通过对工作条件下的动力学极化解耦确定的。作者采用EIS-GITT方法将硫正极放电时的总η解耦为ηac、ηcon和ηohm,并对不同E/S比条件下的正极动力学进行了系统评价。随着电解质体积的减小,Li2S成核过程的总η最大。ηac是Li2S成核阶段的关键动力学限制因素,是导致贫电解质锂电池动力学迟缓和性能下降的主要原因。为了解决上述问题,使用LiFSI锂盐代替传统的LiTFSI,使用LiFSI的电解质有效地改善了贫电解质Li-S电池的缓慢正极动力学。使用LiFSI电解质的锂电池在整个放电过程中ηac明显降低,放电容量为985 mAh g−1, E/S比为4 μL mg−1,电流密度为0.2 C。研究表明,LiPSs的界面电荷转移是关键的动力学限制过程,而ηac是贫电解质Li-S电池的关键动力学限制因素。上述基本认识为促进贫电解质Li-S电池硫氧化还原动力学的合理和有针对性的策略设计提供了启发,本文提出的EIS-GITT极化解耦方法有助于理解实际工作条件下的电极过程。
审核编辑:刘清
-
锂电池电解液如何影响电池质量?锂电池电解液成分优势是什么?2024-01-11 2425
-
电解液与SEI的关系?电解液对SEI的影响?2023-11-10 1448
-
吴憨子:动力电池电解液产业链与温度传感器2023-04-07 988
-
V2C MXene组件促进实用锂硫电池的硫释放动力学和锂离子筛分2023-04-01 2294
-
探讨高浓电解液阴离子对Li+活度和嵌入反应动力学影响机理2023-03-15 5060
-
1μL/mg贫电解液锂硫/硒电池取得新突破2023-01-14 1583
-
具有高硫载量和高效转化动力学开发RT-Na/S电池应用2022-11-21 1479
-
动力电池市场不断回暖,磷酸铁锂价格走势与电解液价格背道而驰2020-10-09 3424
-
锂电池电解液是什么_锂电池电解液主要成分2020-03-30 50653
-
锂硫电池的产业化进程加速!Oxis建立锂硫电池电解质及正极材料工厂2019-06-26 5045
-
电解液——锂电池的‘血液’2018-08-07 5889
-
锂离子电池电解液超全面介绍 有何神秘之处?2017-02-22 6962
-
解密:锂空气电池2016-01-12 5453
-
怎样预防蓄电池电解液结冰?2009-11-02 2015
全部0条评论

快来发表一下你的评论吧 !

