

如何利用微流控技术实现血小板在肺血管系统中的高效生成?
描述
血小板由巨核细胞衍生而来,具有止血作用。骨髓和肺是血栓形成的主要部位,但其机制尚不清楚。此外,在体外生成的血小板功能性很差。近日,来自英国布里斯托大学的Alastair W. Poole和Xiaojuan Zhao教授团队进行了利用微流控技术在肺血管系统中高效生成血小板的相关研究。研究成果以“Highly efficient platelet generation in lung vasculature reproduced by microfluidics”为题发表在Nature Communications期刊上。
在体外小鼠肺血管中灌注巨核细胞可产生大量血小板,每个巨核细胞可产生多达3000个血小板。尽管巨核细胞体积较大,但它们仍能反复通过肺血管,在血管中巨核细胞去核然后生成血小板。通过使用体外人工肺和微流控芯片,该研究明确了氧合、通气、肺内皮和微血管结构是如何支持血栓生成的。此外,还显示了肌动蛋白调节因子原肌球蛋白4(TMP4)在肺血管血小板形成最后步骤中的关键作用。该研究揭示了肺血管中血栓形成的机制,并为大规模生成血小板提供了可靠的方法。
体内肺血管中血小板高效生成
研究表明,肺是血小板生成的主要部位之一,但这种血小板生成的机制并不清楚。该研究在体内和体外建立了小鼠心肺模型,通过该模型能够灌注小鼠巨核细胞(MKs)。体外小鼠心肺模型的基础是将心肺分离成一个整体,结扎腔静脉和主动脉弓并灌注预染色的成熟MKs。首先对肺部进行人工通气。由于MKs体积较大,原设想绝大多数MKs会被困在肺血管中,但第一次超过50%的完整MKs可以出现在灌流液中。灌流液可以通过肺部再次注射,多次注射后,灌流液中完整MKs的数量继续减少。随着传代次数的增加,每个MK产生的血小板数量逐渐增加,18次传代后达到约931.7 ± 138.4个血小板/MK。传代后固定肺切片进行双光子显微镜检查显示,肺微血管中可见许多生成的血小板。经过18次肺部穿刺后,每个MK产生了约2997.0 ± 270.5个血小板,即体内每个MK产生约1000 ~ 4000个血小板。总之,在MKs通过肺微血管多次循环后,可以产生生理数量的血小板。
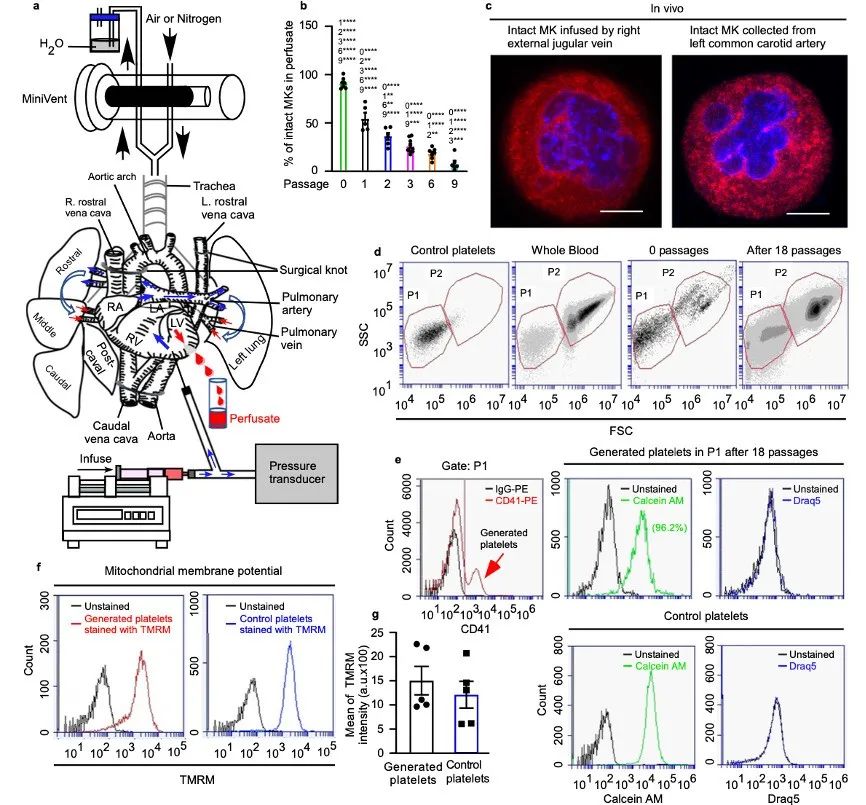
图1 小鼠血小板由通过小鼠肺血管的巨核细胞生成
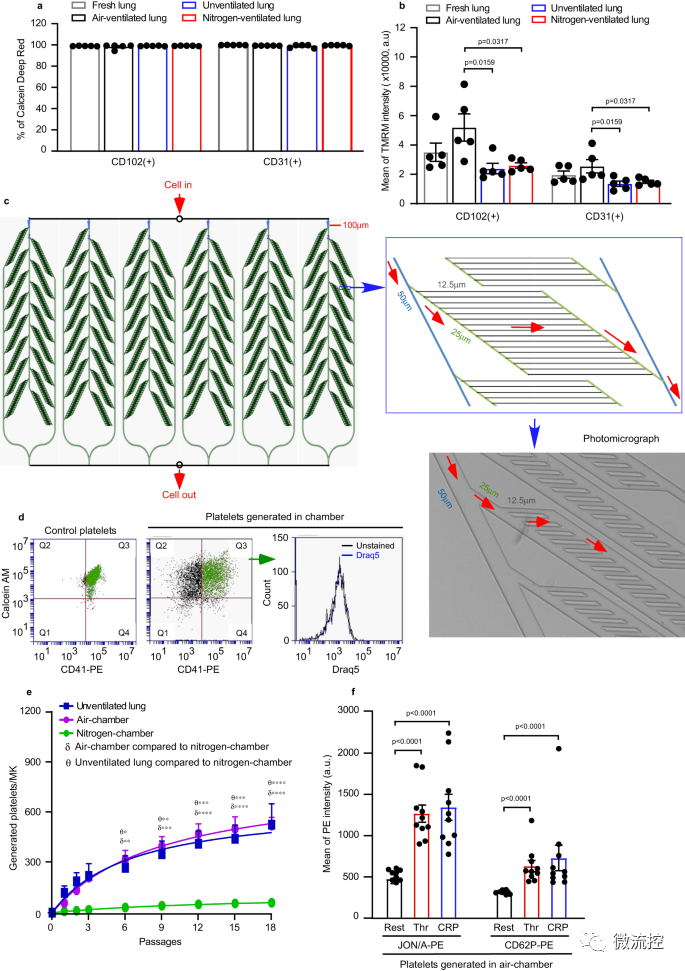
图2 肺内皮细胞健康和微血管结构在血小板生成中的作用
生成的血小板形态和功能正常
接着研究人员明确心肺系统中生成的血小板是否具有经典的形态和功能。用α-微管蛋白免疫标记生成的血小板显示具有典型的环状结构,细胞的平均大小比对照组大。根据生成血小板的直径范围,分为两个亚群:约33%的生成血小板与对照血小板大小相似,67%的生成血小板明显大于对照血小板。透射电子显微镜(TEM)观察生成血小板的超微结构也显示:血小板呈盘状,具有α颗粒、致密颗粒、线粒体、管状系统和微管线圈等。与尺寸较小的亚群相比,尺寸较大的亚群在整合素αⅡbβ3激活和P-选择素表达方面对凝血酶的反应更强。生成血小板和对照血小板的CD61和CD42b的平均荧光强度(MFI)相当。然而,尽管表达CD61的细胞比例也相当,但与对照组相比,生成血小板中表达CD42b的细胞比例较低。生成的血小板中三种胶原受体CD42d24、CD49b和糖蛋白VI(GPVI)的平均荧光强度(MFI)高于对照组。对体外血栓形成进行评估显示,生成的血小板占据血栓的所有层面,而对照组血小板主要位于血栓的顶部,表明生成的血小板对胶原蛋白有更高的反应性,生成的血小板是早期与胶原相互作用的血小板,具有更大的粘附性能。
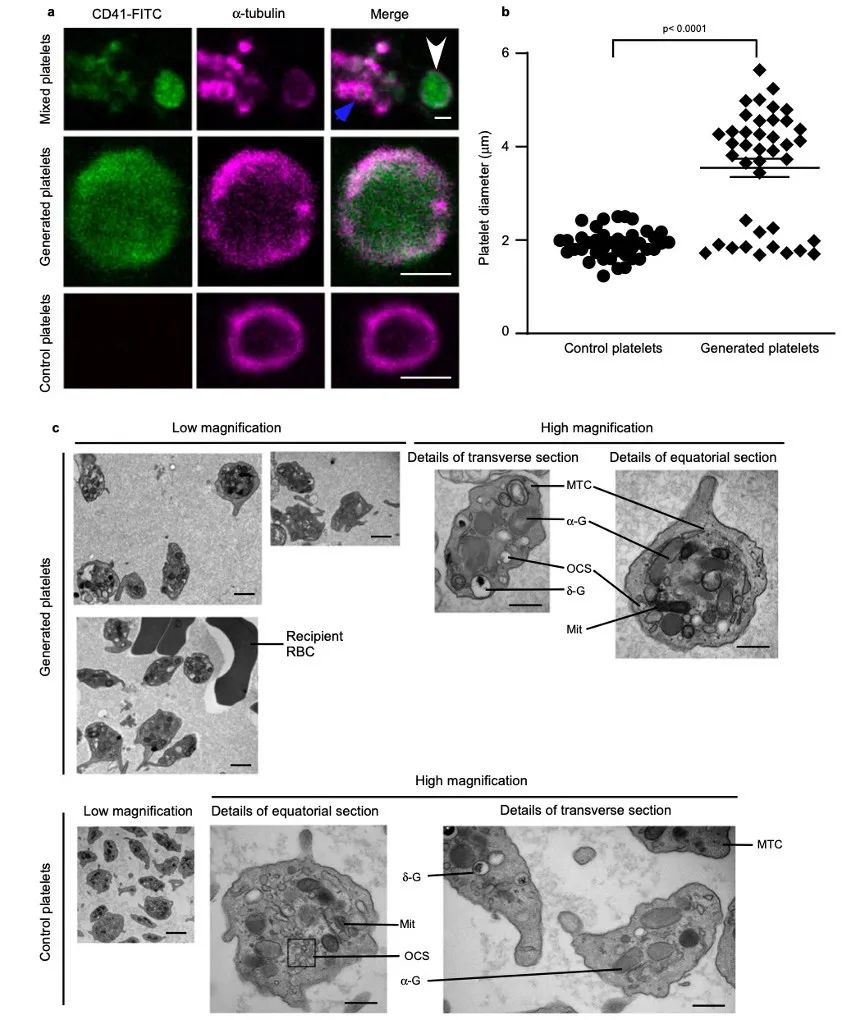
图3 生成的血小板具有与正常血小板相似的外观和功能
巨核细胞脱核和血小板在血管内的释放
研究人员进一步探索反复通过肺血管时MKs释放血小板的过程。结果显示在反复传代后,MKs的细胞核逐渐向外周移动,随后去核,产生裸核和去核MKs。虽然发现了少量有核圆形MKs,但较大的无核物逐渐积累。表明大的多倍体细胞核在极化过程中从细胞中心位置向外周移动。进一步通过肺血管时,细胞核从细胞中挤出,直到第9次传代时,有核的MKs所剩无几。经过12次传代后,大的裸核也变得稀少,取而代之的是不规则的小亚核。这些亚细胞核看起来相互连接。子核的特征是深度、长宽比、主轴和次轴都随传代的增加而大幅减少。因此,挤出的裸核经历了一个分裂为多个组成亚核的过程,这些亚核进而凝结成具有较大圆度的紧凑亚核单位。无核的MK经过多次传代后分裂成血小板,到15 ~ 18次传代时达到高峰。
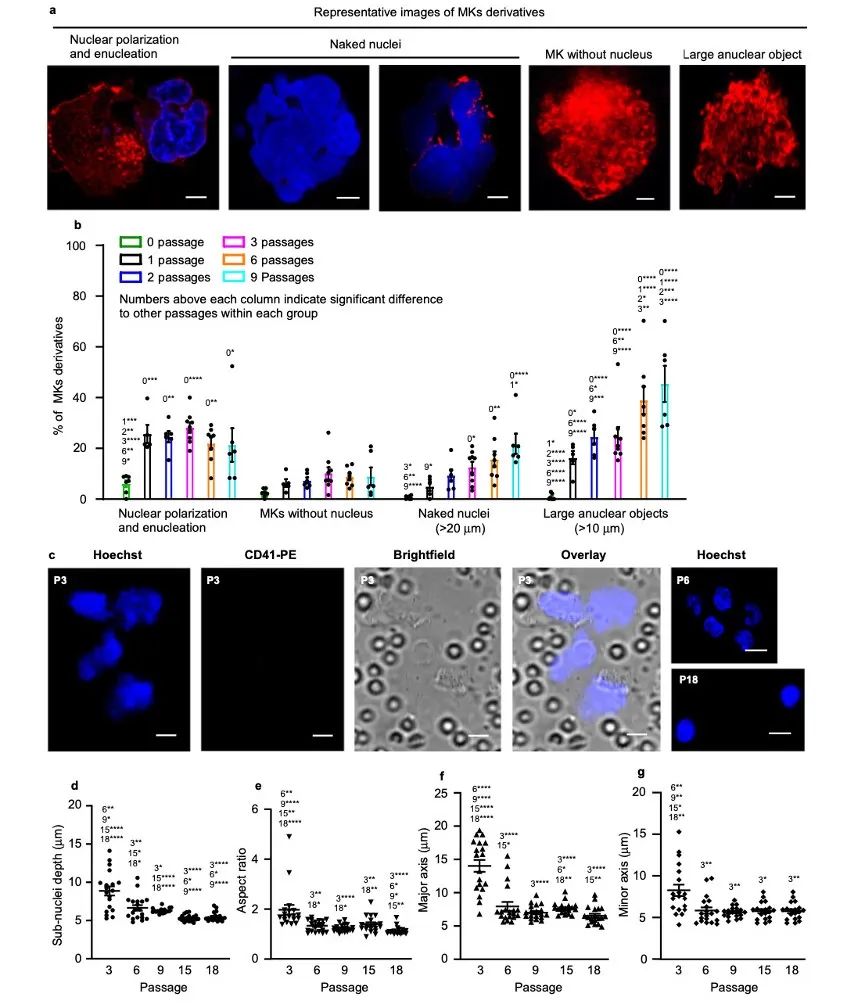
图4 巨核细胞在破碎前出现核边缘化和去核现象
肺血管中血小板生成需要原肌球蛋白4进行调节
血小板的释放涉及肌动蛋白细胞骨架重组,肌球蛋白与肌动蛋白丝形成共聚物,并以同工酶方式调节肌动蛋白丝的功能。TPM4在血小板形成中发挥作用,但在体外人工肺系统中, Tpm4 -/- MKs在灌流液中不生成血小板。因此,研究人员探索了血小板生成需要TPM4的步骤。与野生型MKs相比,在前3个传代期间,较少的 Tpm4 -/- MKs转变为大的无核物。到6 ~ 9代时,大核物体的数量与野生型相当。双光子显微镜观察固定的肺切片显示,18个传代后,出现大量的核荧光物,表明TPM4在调节无核化过程中的作用很小且非必要,但在调节血小板形成的最后步骤及其释放到循环中的过程中起着关键作用。在心肺模型中,TPM4在血小板生成中起着关键作用。接着研究人员研究了 Tpm4 -/- MKs在骨髓中是否与WT相似。在WT或 Tpm4 -/-小鼠中,观察到MKs从骨髓间隙到窦状的4种不同形态,在肺血管中,TPM4调节约10 μm无核碎片向血小板的转化。此外,TPM4可能在调节肺血管以外的器官中生成的血小板最终大小方面起一定作用,因为 Tpm4 -/-小鼠的血小板体积比野生型小鼠略大。
综上所述,该研究开发了一种在体外高效生成血小板的方式,即在通气条件下通过肺血管反复注射MKs。此外,还发现巨核细胞去核过程、生成血小板的最后步骤以及血小板释放到循环中依赖TPM4。这些发现将为大规模生产人类血小板提供一个新方法。
审核编辑:刘清
-
芯片上集成功能性血管化类器官的微流控平台2024-11-18 869
-
微流控技术在临床检测中的应用2023-10-12 2984
-
一种基于微流控的血管芯片模型设计2023-03-09 2247
-
双曲线微流控测定方法,用于拉伸应变下血小板机械转导机制研究2023-02-17 1277
-
点成分享 | 液滴生成和器官芯片?点成Microfluidic系统玩转微流控技术2022-11-17 2231
-
点成分享 | 微流控集成系统在人体血管研究中的应用2022-10-31 1286
-
基于微流控的血管芯片来模拟人体血管内部剪切力分布状况2022-06-14 4331
-
利用微流控技术制备高度贯通多孔微载体2019-06-30 4776
-
研究人员设计了一款能够实时测量血小板强度的微流控装置2019-03-22 4026
-
微流体系统模拟毛细血管帮助预测血管易堵塞程度2018-09-23 3782
-
新型微流控芯片利用局部电场高效“捕获”细胞2018-08-23 4749
全部0条评论

快来发表一下你的评论吧 !

