

锂离子电池的作用原理?锂离子电池是如何产生电的?
电池技术
描述
锂离子电池 (Lithium-ion battery)是一种可重复充电电池,它主要依靠锂离子在正极和负极之间移动来工作。锂离子电池使用一个嵌入的锂化合物作为一个电极材料。目前用作锂离子电池的正极材料主要常见的有: 锂钴氧化物(LiCoO 2 )、锰酸锂(LiMn2O 4 )、镍酸锂(LiNiO 2 )及磷酸铁锂(LiFePO 4 ) 。
此外,锂离子电池容易与下面两种电池混淆:
一、 锂电池(Lithium battery) :虽然常常用作为锂离子电池的简称,但严格意义的锂电池是锂原电池,内含纯态的锂金属,为一次性使用、不可充电。
二、 锂离子聚合物电池(Lithium-ion polymer batteries,也常称为“锂聚合物电池”) :大致上其实也是锂离子电池,是普通锂离子电池的改良,利用胶态或固态聚合物取代液态有机溶剂的可充电锂离子电池,其安全性较好不会爆炸,且可以塑造各种不同形状的电芯,成为了现在的主流形式电池。
0****1
锂离子电池的优点
1、电压高:单体电池的工作电压高达3.7-3.8V(磷酸铁锂的是3.2V、,是Ni-Cd、Ni-MH电池的3倍。
2、比能量大:能达到的实际比能量为555Wh/kg左右,即材料能达到150mAh/g以上的比容量(3-4倍于Ni-Cd,2-3倍于Ni-MH、,已接近于其理论值的约88%。
3、循环寿命长:一般均可达到500次以上,甚至1000次以上,磷酸铁锂的可以达到8000次。对于小电流放电的电器,电池的使用期限,将倍增电器的竞争力。
4、安全性能好:无公害,无记忆效应。作为Li-ion前身的锂电池,因金属锂易形成枝晶发生短路,缩减了其应用领域:Li-ion中不含镉、铅、汞等对环境有污染的元素;部分工艺(如烧结式、的Ni-Cd电池存在的一大弊病为“记忆效应”,严重束缚电池的使用,但Li-ion根本不存在这方面的问题。
5、自放电小:室温下充满电的Li-ion储存1个月后的自放电率为2%左右,大大低于Ni-Cd的25-30%,Ni-MH的30-35%。
6、快速充电:1C充电30分钟容量可以达到标称容量的80%以上,磷铁电池可以达到10分钟充电到标称容量的90%。
7、工作温度:工作温度为-2545°C,随着电解液和正极的改进,期望能扩宽到-4070°C。
02
锂离子电池的缺点
1、衰老:与其它充电电池不同,锂离子电池的容量会缓慢衰退,与使用次数有关,也与温度有关。这种衰退的现象可以用容量减小表示,也可以用内阻升高表示。因为与温度有关,所以在工作电流高的电子产品更容易体现。用钛酸锂取代石墨似乎可以延长寿命。
2、回收率:大约有1%的出厂新品因种种原因需要回收。
3、不耐受过充:过充电时,过量嵌入的锂离子会永久固定于晶格中,无法再释放,可导致电池寿命短。
4、不耐受过放:过放电时,电极脱嵌过多锂离子,可导致晶格坍塌,从而缩短寿命。
03
锂离子电池的种类
根据正极所用的金属材料的不同,锂离子电池分为几个种类。最初锂离子电池的正极所用的金属材料是钴。不过钴的产量几乎与锂同样少,也是稀有金属,制造成本高。因此开始使用廉价且环境负荷小的材料,例如锰、镍、铁等金属。锂离子电池按其所使用的材料而分类,下面来看看各种类分别都有哪些特点
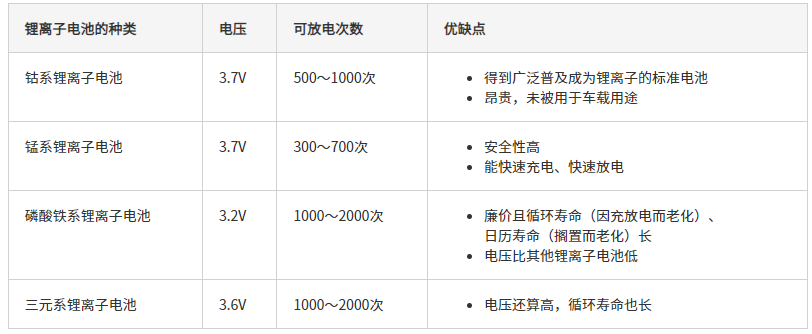
钴系锂离子电池:
正极使用钴酸锂。钴酸锂比较容易合成,便于使用,因而锂离子电池最早量产的是钴酸锂离子电池。但由于钴是稀有金属,价格昂贵,几乎没有被用于汽车零件。
锰系锂离子电池:
正极使用锰酸锂。优点是电压能与钴系锂离子电池差不多,而且制造成本廉价。缺点是充放电中锰可能会熔化于电解质,缩短电池的寿命。
磷酸铁系锂离子电池
正极使用磷酸铁锂。磷酸铁系锂离子电池的优点在于即使内部发热结构也难以损坏,安全性高,而且以铁为原料,制造成本比锰系更低。但是电压比其他的锂离子电池低。
三元系锂离子电池
三元系锂离子电池是为了减少钴的用量,使用钴、镍、锰三种材料制造的电池。现在三元系锂离子电池大多镍的比例较高。虽然电压比钴系、锰系略低,但能减少制造成本。不过虽说如此,各个材料的合成制备较难,稳定性低等。
04
锂离子电池的电化学
和所有化学电池一样,锂离子电池也由三个部分组成:正极、负极和电解质。习惯上,锂离子进入正极材料的过程叫“嵌入”,离开的过程叫“脱嵌”;锂离子进入负极材料的过程叫“插入”,离开的过程叫“脱插”。
正极半反应是:
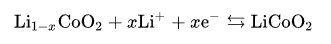
负极半反应是:
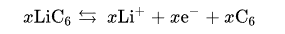
总体反应有局限性。过放电supersaturates锂钴氧化物,导致产生的氧化锂,可能是由以下的不可逆反应
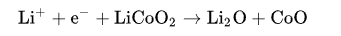
05
锂离子电池的产生电的工作原理
电池里有使用金属材料的正电极(正极)和负电极(负极),借由离子而导电的物质(电解质)充满在正负极之间。金属电极被电解质熔化,分为离子和电子,电子从负极向正极移动产生电流,这时便产生电。二次电池是在开始使用电池之前通过充电,预先将电子储蓄在负极,使用电池时储蓄的电子向正极移动从而产生电。
锂离子电池是预先在正极使用含锂金属化合物,负极使用能吸储锂的碳(石墨)。通过这样的结构,无须如传统电池一般由电解质熔化电极就能发电,从而减缓了电池本身的老化,不仅能储蓄更多的电,充放电的次数也得以增加。此外,锂是非常小而轻的物质,从而能使电池具有小型轻量化等各种优点。
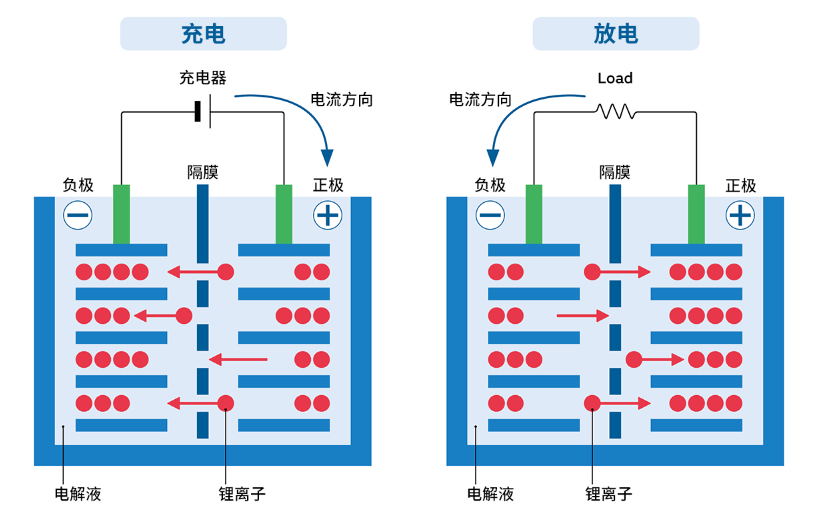
锂离子电池中的电解液可以是凝胶体、聚合物(锂离子/锂聚合物电池)、或凝胶体与聚合物的混合物。因为目前尚未发现能够在室温条件下有效运送锂离子的聚合物,所以大多数的“塑胶封袋”锂离子/ 锂聚合物电池事实上都是结合凝胶体和聚合物的混合型电池。
正极或负极必须具有类似海绵的物理结构,以释放或接收锂离子。在放电时,锂离子从负极材料移出至电解液,再像水进入海绵一样地进入正极材料,这个过程被称为嵌入(Intercalation)。充电的过程则完全相反。
正极
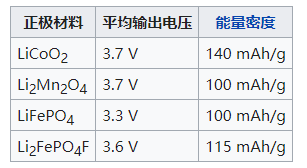
正极材料:可选的正极材料很多,目前主流产品多采用锂铁磷酸盐。不同的正极材料对照:
正极反应:放电时锂离子嵌入,充电时锂离子脱嵌。
充电时:LiFePO4 → Li1-xFePO4 + xLi+ + xe−
放电时:Li1-xFePO4 + xLi+ + xe− → LiFePO4
负极
负极材料:多采用石墨。新的研究发现钛酸盐可能是更好的材料。
负极反应:放电时锂离子脱插,充电时锂离子插入。
充电时:xLi+ + xe− + 6C → LixC6
放电时:LixC6 → xLi+ + xe− + 6C
电解质溶液
溶质:常采用锂盐,如高氯酸锂(LiClO4)、六氟磷酸锂(LiPF6)、四氟硼酸锂(LiBF4)。
溶剂:由于电池的工作电压远高于水的分解电压,因此锂离子电池常采用有机溶剂,如乙醚、碳酸乙烯酯、碳酸丙烯酯、碳酸二乙酯等。有机溶剂常常在充电时破坏石墨的结构,导致其剥脱,并在其表面形成固体电解质膜(solid electrolyte interphase,SEI)导致电极钝化。有机溶剂还带来易燃、易爆等安全性问题。
-
锂离子电池充电的问题2023-02-04 2721
-
锂离子电池的制作工艺与工作原理是怎样的2021-03-01 5356
-
锂离子电池主要有哪些类型2020-11-03 3338
-
锂离子电池的制造概述2017-02-27 4467
-
锂离子电池厂家推荐分享2017-01-05 5270
-
【转】锂离子电池的维护和保存技巧分享2016-08-18 4766
-
锂离子电池和锂电池的区别2015-12-28 5681
-
锂离子电池的工作原理和使用注意事项2014-10-29 6314
-
锂离子电池的基本组成及关键材料2013-07-03 4216
-
锂离子电池的性能2013-06-13 5480
-
锂离子电池的设计2013-05-20 3404
-
锂离子电池的类型2013-05-17 4964
-
锂离子电池黏结剂2013-05-16 2903
-
[讨论]讨论聚合物锂离子电池是否能替代锂离子电池2009-05-13 4924
全部0条评论

快来发表一下你的评论吧 !

