

用于单细胞谱系追踪图像引导的微流控系统
描述
细胞谱系追踪是生物学研究中一个长期未解决的问题。微流控技术具有解决这一问题的潜力,因为其能够以一种快速、可控和高效的方式操纵和处理单细胞。事实上,当与传统的成像方法相结合时,微流控系统可使实验人员对单细胞分裂进行长时间追踪。
据麦姆斯咨询报道,基于此,来自瑞士苏黎世联邦理工学院(ETH Zürich)的研究人员设计、制造并开发了用于追踪非贴壁单细胞谱系的自动化图像引导的微流控平台。该平台的基本特征包括:(i)具有用于单细胞捕获的集成微流控室;(ii)具备长时间监测细胞生长的能力;(iii)具有分离分裂后的姐妹细胞的能力;(iv)可以快速再分配姐妹细胞以监测第二次和第三次分裂事件;(v)能够提取细胞,并使用大规模平行RNA单细胞测序(MARS-seq)、唯一分子标识符(UMIs)和基于微孔板的单细胞RNA测序(scRNA-seq)流程进行下游转录组学分析。相关研究成果近期以“An image-guided microfluidic system for single-cell lineage tracking”为题发表在PLOS ONE期刊上。
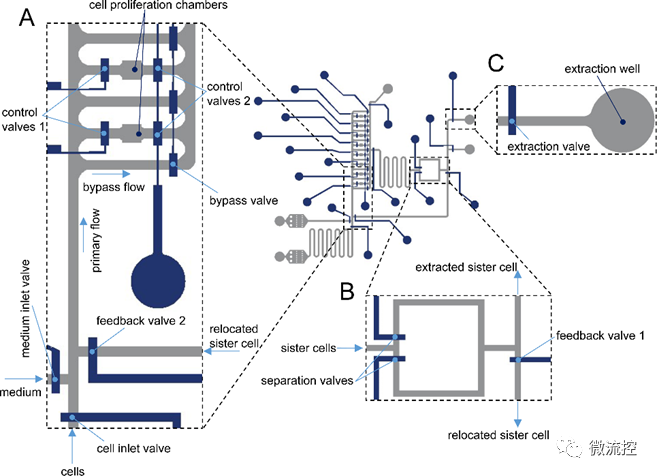
图1 微流控单细胞处理平台及实验流程
该研究所开发的微流控装置由控制层和流体层组成,每一层均由通道网络构成。微流控装置内的流体流动采用基于聚二甲基硅氧烷(PDMS)的气动微阀控制。根据控制层和流体层的相对位置,这种微阀可以设计为“上推式”或“下推式”。“上推式”微阀更适用于涉及在更深的流体通道内操纵真核细胞的应用,因为与“下推式”微阀相比,其能够减少流体的泄漏。而当微流控装置需要PDMS之外的不同材料作为衬底材料时(例如在载玻片上形成分子图案),“下推式”微阀更适合。在该研究所设计的微流控装置中,研究人员使用了一个“上推式”微阀结构,因为该微流控装置专门用于培养和操纵真核细胞。
此外,该双层微流控装置集成了8个腔室,用于两代姐妹干细胞的长期监测(> 24小时)和追踪,详见图1。首先,通过启动控制微阀1,可以阻止流体进入捕获区域,从而将单细胞捕获在增殖室中。同时,通过打开每个腔室两侧的旁路流道和控制微阀2,可以将新鲜细胞培养基输送给被捕获的细胞。
此外,姐妹细胞的分离、将分离后的姐妹细胞重定位到新的捕获室以及单细胞的提取也在该微流控装置中进行。具体而言,在分裂之后,姐妹细胞被操纵到一个包含两个控制微阀的分离区。其中一个控制微阀的驱动确保其中一个细胞可以被驱动到提取区域,而另一个细胞将保持被捕获,从而成功将姐妹细胞分离。分裂后分离的姐妹细胞在控制微阀的驱动下通过反馈通道流动,随后被重定位在单独的捕获室中。此外,该微流控装置的提取区域包括两个可独立寻址、直径为1 mm,并且深度为3 mm的开孔,用于收集姐妹细胞。

图2 单细胞增殖和姐妹细胞重定位
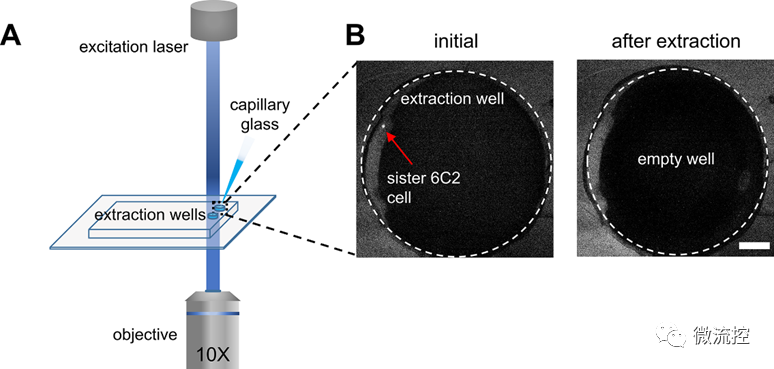
图3 姐妹细胞提取
为了验证微流控工作流程的有效性,研究人员利用该微流控装置对鸡红细胞白血病细胞系(6C2)和鸡红细胞原代祖细胞(T2EC)进行了两代以上的追踪,结果表明,两种细胞的存活率均超过90%。此外,姐妹细胞在分裂后成功分离,并且可以在500 nL的提取室中被成功提取,该提取室与下游单细胞RNA测序分析兼容。
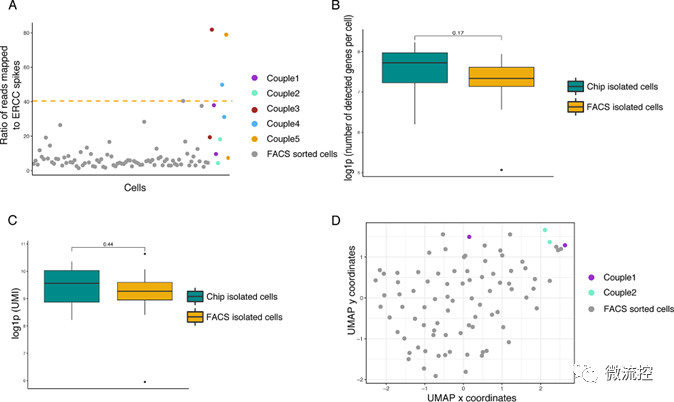
图4 单细胞RNA测序(scRNA-seq)数据可视化
综上所述,在该项研究中,研究人员开发了一种多层微流控装置和相关实验流程,用于在单细胞水平上追踪非贴壁细胞分裂。该微流控平台能够在8个独立控制的增殖室中同时捕获单细胞,分离分裂后的姐妹细胞并将其提取用于下游分析。研究结果证明,该微流控平台能够使用两种不同的细胞模型(即细胞系和原代细胞)追踪至少两代细胞。概念验证实验证实鸡红细胞白血病细胞系和鸡原代红细胞祖细胞可以在微流控芯片内增殖,并且其存活率高于90%。分离后的细胞被置于500 nl体积的提取室中,该提取室与下游单细胞RNA测序分析兼容。该研究开发的通用方法可以重现选定的单细胞和提取细胞的系谱信息,同时能够提供与常规的流式细胞荧光分选技术(FACS)所提供的质量相媲美的数据,以用于后续单细胞RNA测序分析。
总体而言,该研究开发的微流控平台为单细胞分辨率的单细胞谱系追踪研究提供了一个强大的自动化平台,可以用于追踪包括细胞系和原代细胞在内的非贴壁细胞。在未来,该微流控装置有望用于包括诱导分化和使用药物调节基因表达在内的微扰实验。此外,通过增加每个装置的平行增殖室数量、提高单细胞捕获的自动化水平以及实现细胞分裂和重定位的自动检测,可以显著提高该微流控装置的分析通量。
审核编辑:刘清
-
基于滑动原理分选不同尺寸单细胞的微流控装置2019-01-02 5392
-
微流控芯片在单细胞捕获中的应用2019-04-08 9302
-
微流控芯片单细胞克隆形成抑制实验用于乳腺癌干细胞特异性药物筛选2019-06-20 6399
-
厦门大学研发出全新高通量单细胞转录组测序方法2020-06-02 4291
-
10K Genomics是国内第一款液滴微流控单细胞测序仪2021-05-27 3406
-
新型的2D MOF纳米传感器集成的液滴微流控流式细胞仪2022-07-28 1713
-
基于微流控平台的单细胞通讯研究进展2022-11-29 1678
-
可用于单细胞分析的选择性液滴提取微流控装置2023-04-10 1715
-
北京基因组所开发出新型高通量单细胞多组学技术2023-04-20 1952
-
基于载酶金属有机框架的微流控平台实现单细胞代谢物分析2023-05-10 1591
-
一种用于测量单细胞瞬态响应的封闭式微流控芯片2023-08-03 757
-
基于液滴微流控的单细胞测序法可提升mRNA捕获效率2023-09-15 2828
-
一种用于微液滴中单细胞无标记分析的液滴筛选(LSDS)方法2024-03-26 1200
-
功率放大器在液滴微流控细胞分选中的应用2025-04-03 640
-
基于细胞微流控的阻抗测试解决方案2025-07-02 1093
全部0条评论

快来发表一下你的评论吧 !

