

电解质离子种类对电催化反应的影响—进展、挑战与展望
描述
1、背景简介:
电解质在电化学或光电化学反应中也是一个重要的组成部分,电解质离子可以影响电化学反应的活性和选择性。实验和理论研究广泛探讨了电解质离子(如碱金属阳离子、碳酸根阴离子)与反应物或催化剂表面在电催化反应(如产氢反应、产氧反应、还原反应、氧化水反应和CO2还原反应)中的相互作用机制。过去的研究表明,电化学反应的活性和选择性明显依赖于电解质离子的身份。然而,很少有综述全面而具体地讨论电解质阳离子和阴离子对常见电化学反应的影响。
2、文章概述:
近日,香港中文大学(深圳)邹志刚院士、涂文广教授和南京大学周勇教授总结了电解质离子的复杂化学反应过程和机制,并详细介绍了在理解各种电解质离子种类的作用及其在水分离、H2O2 生成和 CO2 还原等多种电催化反应中的影响机制方面的最新进展。该文还概述了电催化过程中电解质离子效应所面临的挑战和前景。
3、图文导读:
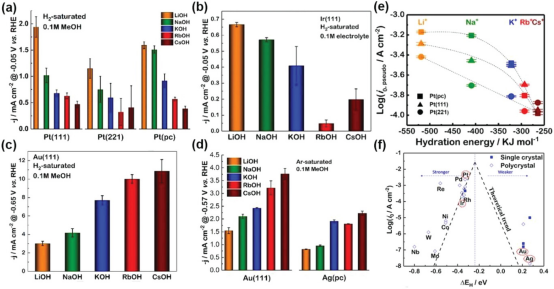
图 1. a-c) Pt(111)、Pt(221)、Pt(pc)、Ir(111)和 Au(111)在-0.05 V 电压下(与可逆氢电极 RHE 相比)在 0.1 m H2 饱和碱性电解质(即:LiOH、NaOH、KOH、RbOH、CsOH)中的 HER 活性比较、 e) Pt(111)、Pt(221)和 Pt(pc)的伪交换电流密度对数与相应碱金属阳离子的水合能的关系图。f) 不同金属表面的 HER 活性与氢反应中间体理论结合能之间的 "火山 "图。
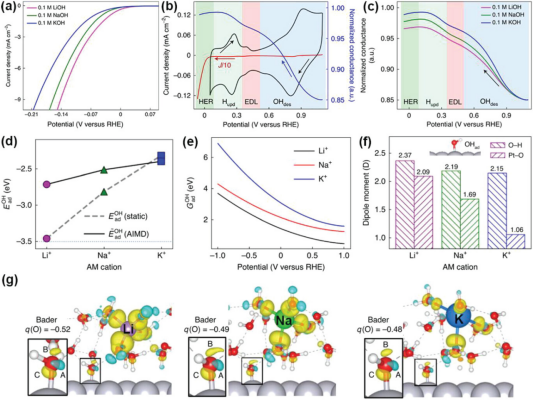
图 2. a) 在室温下,以5 mV s-1的扫描速率和每分钟1600转的旋转速度,在N2饱和的 0.1 m MOH(M = Li、Na 和 K)中的多晶铂圆片电极上收集的HER极化曲线。 b) 典型的循环伏安图(黑色)、HER 区域的负扫描分支(红色)和 ETS 频谱(蓝色)。羟基解吸 (OHdes)、EDL、氢欠电位沉积 (Hupd) 和 HER 区域用不同的背景颜色突出显示。 d) 静态计算和 AIMD 模拟得出的在 Li+、Na+ 和 K+ 存在下的EadOH。e) 在 1.0 VRHE至-1.0 VRHE的电位窗口中,存在三种阳离子时与电位相关的GadOH。 f) 基于Bader电荷的条形图显示了OHad的偶极矩。 g) 在引入 Li+、Na+ 和 K+ 阳离子后,Pt(111)-OHad-水界面的电荷密度差图。黄色和青色等值面分别代表电荷密度的增加或减少。
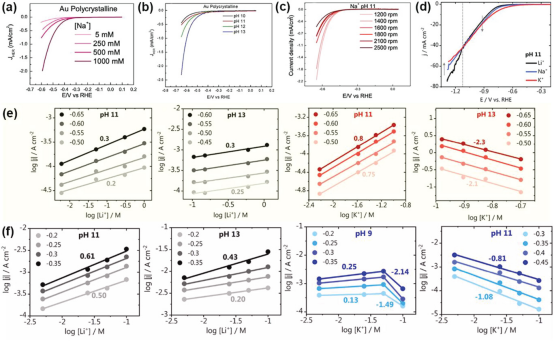
图 3. a) 在 0.001 m NaOH(pH 11)中,2500 rpm 时不同浓度 NaClO4(5、250、500 和 1000 mm)对金多晶上的 HER 所做的循环伏安图;b) 在 0. 1 m NaOH(pH 值为 13)、0.01 m NaOH + 0.09 m NaClO4(pH 值为 12)、0.001 m NaOH + 0.099 m NaClO4(pH 值为 11)、0.0001 m NaOH + 0.0999 m NaClO4(pH 值为 10)中,在 25 mV s-1 的氩气饱和环境中。c) 在 0.1 m 含 Na+ 的电解质中,pH = 11,以 25 mV s-1 的扫描速率测量不同的旋转速率;d) 在 0.001 m MOH(M = Li+、Na+ 和 K+)中,pH = 11,以 50mV s-1 的扫描速率测量。e) 在 pH 值为 11、13 和 13 时,阳离子浓度下的铂多晶。 f) 当阳离子为 Li+ 或 K+ 时,pH 值为 9、11、13 时阳离子浓度下的金多晶。
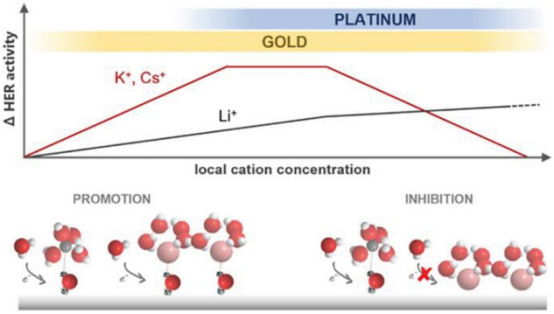
图 4. 阳离子浓度对 Pt 和 Au 比较中 HER 活性的影响示意图,以及弱(K+ 和 Cs+)和强(Li+)水合阳离子促进和/或抑制 HER 的机理图解。
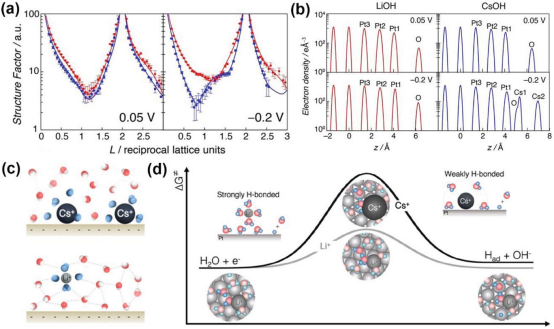
图 5. a) 0.1 m LiOH 和 CsOH 中 Pt(110) 在 0.05 和 -0.2 V 电压下的镜面 CTR 曲线与 RHE 的关系。实线表示基于优化模型的结构因子。 b) 在 0.1 m LiOH 和 CsOH 中,0.05 和 -0.2 V 时优化的 Pt(110) 界面模型的电子密度曲线与 RHE 的关系。c) 界面水分子、阳离子和界面之间的相互作用示意图。 d) 阳离子依赖型 HER 动力学的拟议机制总结图。
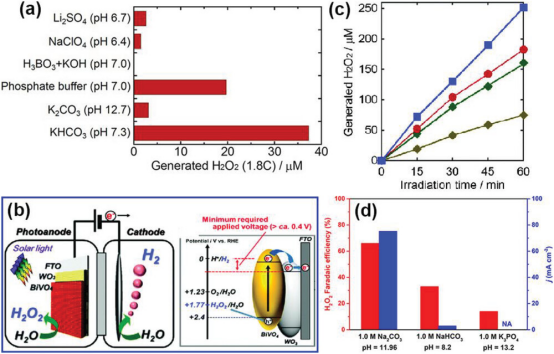
图 6. a) 在 3.0 V 电压下,使用不同的 0.5 m 水溶液和二氧化碳或氩气吹扫,在 FTO 电极上通过 2e- WOR 生成 H2O2。b) 在 0.1 m(深黄色)、0.5 m(绿色)、1.0 m(红色)和 2.0 m(蓝色)KHCO3 电解质溶液中产生 H2O2 的时间过程。 c) 使用 WO3/BiVO4 光阳极生产 H2O2 和 H2 的光电极系统的反应池插图和能量图。d) 在 1.0 m Na2CO3、1.0 m NaHCO3 和 1.0mK3PO4 电解质中分别测量的 CFP-60% 催化剂产生 H2O2 的法拉第效率和 H2O2 部分电流密度。
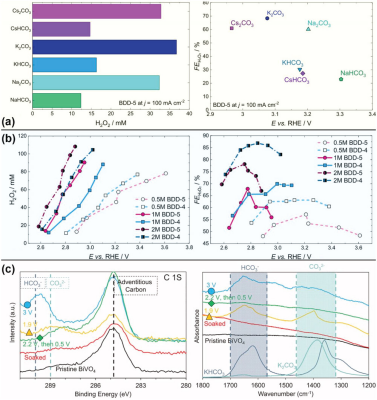
图7. a) 样品BDD-5在六种不同电解质(即 NaHCO3、1m Na2CO3、2m KHCO3、1m K2CO3、2m CsCO3 和 1m Cs2CO3)中电解产生H2O2 的浓度FE。 b) BDD-4 和 BDD-5 在 0.5、1和2 m K2CO3/KHCO3 电解质(盐比为 1:1)中的电化学性能。c) X 射线光电子能谱和傅立叶变换红外光谱,在 0.5 m KHCO3中以指定偏压实验10分钟,然后用水清洗。在≈290 eV处的峰值表示HCO3-,在≈289 eV处的峰值表示CO32-。
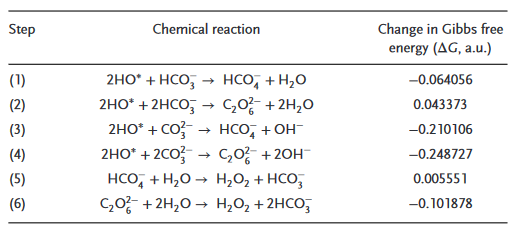
表1. 有K2CO3/KHCO3参与的拟议反应步骤和相应的吉布斯自由能变化。
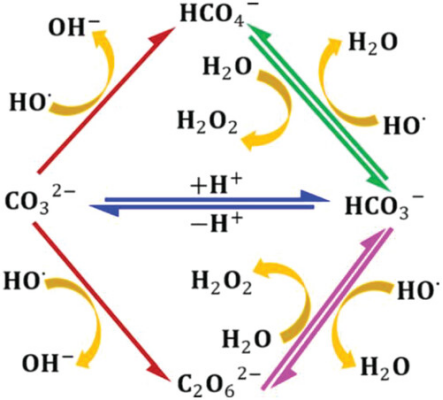
图示1. CO32-和HCO3-阴离子参与2e- WOR合成H2O2的拟议途径。
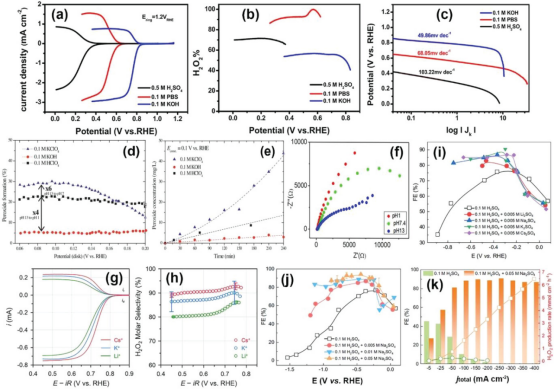
图 8. a) 1600 rpm 时的RRDE伏安图;b) H2O2选择性;c) 测试样品在氧气饱和的0.5 m H2SO4、0.1 m PBS和0.1 m KOH中的Tafel图。d) 在电位范围内不同 pH 值的三种电解质中,铂环电极上检测到的 H2O2生成百分比。 e) 三种不同电解质中H2O2浓度的实验时间变化。f) 在O2饱和电解质溶液中获得的奈奎斯特图:0.1 m H2SO4(pH 值为 1)、0.1 m PBS(pH 值为 7.4和0.1 m NaOH(pH 值为 13)。g,h) 催化剂在O2饱和的0.1 m MOH电解质中以1600 rpm的电极转速测量的ORR极化曲线;b) 相应的H2O2摩尔选择性。k) 以碳纳米管为催化剂的0.1 m H2SO4或0.1 m H2SO4 + 0.05 m Na2SO4电解质中H2O2 的FEs和产生率。
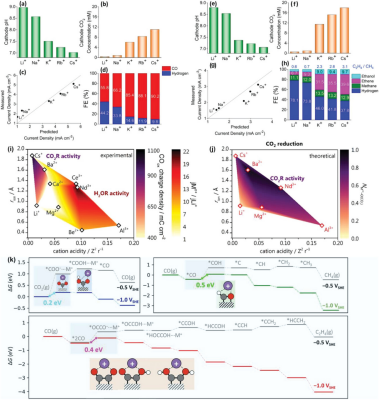
图 9. a-d) 在-1 V相对于RHE的条件下,银电极在 CO2 饱和的 0.1 m MHCO3(M = Li、Na、K、Rb、Cs)电解液中产生CO和H2的阴极 pH值、阴极CO2浓度、总电流密度和FEs的计算值。e-h)在 -1V versus RHE 条件下,Cu电极在CO2饱和的0.1 m MHCO3(M = Li、Na、K、Rb、Cs)电解质中产生的C2H5OH、C2H4、CH4和H2的阴极 pH值、阴极CO2浓度、总电流密度和FE值。i) 高过电位下CO2还原(紫色阴影)和H2O 还原(红色形状)性能与阳离子离子半径和阳离子酸度的色谱图。经许可转载。Ag(111)上CO2转化为CO、Cu(100) 上CO转化为CH4和Cu(100)上CO转化为CH4的反应自由能(∆G)图。阳离子配位的中间产物以插图表示。
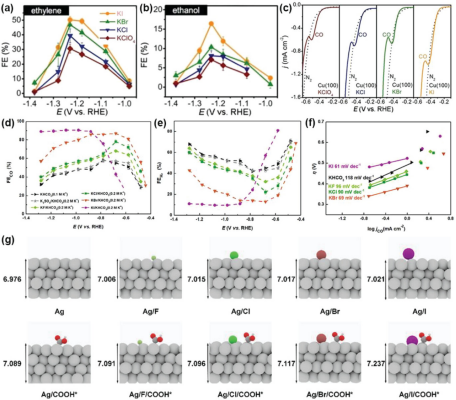
图10. a, b) Cu(100)电极在0.1 m KClO4、KCl、KBr和KI电解质中不同应用电位下产生的乙烯和乙醇的FE。d) CO的FE,e) H2的FE,f) 不同电解质下CO2RR在Ag电极上的Tafel图。g) Ag (111)表面吸附卤化物阴离子和中间体COOH* 后,计算得出的第一和第四层Ag原子层之间的距离。
审核编辑:刘清
-
不同类型的电池的电解质都是什么?2024-02-27 3527
-
固态电解质离子传输机理解析2024-01-19 5518
-
弱溶剂间相互作用提高电池电解质稳定性2023-03-13 3104
-
EcoMat: 拓扑半金属用于电催化析氢反应的研究进展2022-12-13 2128
-
介绍三金属电催化剂对C2醇的电催化机理2022-10-20 3717
-
钠离子电池的电解质分类2022-10-09 6299
-
析氢反应(HER)电催化剂在电解装置的广泛应用2022-09-28 11602
-
中国研究团队研究出用于CO2电催化转化的离子液体基电解质2021-04-07 3500
-
锂离子电池堆电解质的要求及对电池性能的影响2020-12-30 5388
-
将商业化锂离子电池中的液态电解质替换什么解质?2020-06-09 3161
-
电池电解液和电解质的区别_电池电解液和电解质的两种形态2020-04-16 25402
-
固体电解质的物理性质如何?2019-09-17 2496
-
电解质的作用是什么?2009-11-09 3968
-
电池内的电解质是什么?2009-10-20 1162
全部0条评论

快来发表一下你的评论吧 !

