

利用微流控技术“量身打造”各种细胞聚集结构
描述
微流控系统已广泛应用于各种体外组织工程模型中。近期,来自韩国成均馆大学的GeunHyung Kim提出了一种新的微流控系统,用于制造在核心区域充满各种形状(珠子、念珠和细丝)的细胞细丝。相关研究内容以“Formation of various cell-aggregated structures in the core of hydrogel filament using a microfluidic device and its application as an in vitro neuromuscular junction model”为题发表在Chemical Engineering Journal期刊上。
这些结构是利用注射生物墨水的两相流的瑞利-高原不稳定性(胶原蛋白/聚[乙二醇]二丙烯酸酯[PEGDA]的连续相和甲基丙烯酸化明胶(GelMA)的分散相)获得的。为了证明该系统在体外神经肌肉连接模型上的潜力,将含有C2C12的胶原/PEGDA生物墨水注入鞘区域,并将与运动神经元细胞(NSC-34)混合的GelMA混合到制备的细胞聚集物的核心区域。由于更大的机械转导,核心的念珠状NSC-34聚集物比核心区域的珠子和细丝聚集物表现出更高的细胞活力和更发达的神经源性基因表达。此外,当比较充满细胞的支柱(鞘区C2C12和念珠核心区NSC34)与具有相同细胞密度的正常生物打印支柱时,在充满念珠状细胞聚集物的支柱中,肌发生、神经肌肉连接(NMJ)和神经发生相关基因的表达显著上调。这些实验的结果证明了制造新的细胞负载核心鞘结构的潜力,可用于设计各种体外模型。
图1A显示了用于产生充满纤维支柱的3D细胞聚集形状的微流控装置的示意图。在该研究中使用了一个T型结微流控装置,其中分散相被注入垂直于连续相。在T连接系统中将胶原蛋白/PEGDA连续流动,而没有在分散流动中使用油和细胞装载GelMA(图1A、1B)。通过控制每个生物墨水的流变特性和流速以及原位光交联,在核心区域获得了三种不同的细胞聚集形状(球体、念珠和纤维)(图1C)。不同形状的制造可以归因于瑞利不稳定性,这种不稳定性会分散生物墨水的几种不稳定流(喷射流、念珠流和滴流)的稳定共流(图1D)。
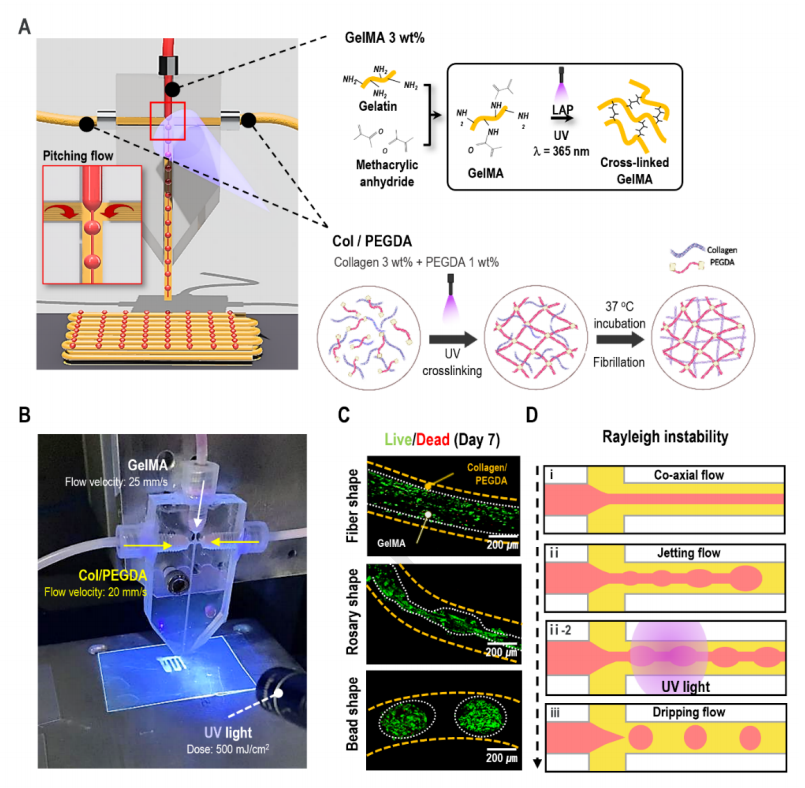
图1 设计一种制造细胞聚合形状的微流控系统
图2A显示了在蛋白质-PEGDA-水三元体系中,增加PEGDA作为结晶剂的浓度对蛋白质的影响的示意图。图2B显示了不同PEGDA浓度下胶原蛋白/PEGDA生物墨水的储存模量(G’)。增加生物墨水混合物中PEGDA的浓度可以提高G''的流变性能和屈服应力(σ),从而增强相邻胶原之间的相互作用。根据混合生物油墨的透光率和印刷能力来评价这一现象(图2C)。由于相分离,随着PEGDA的加入,打印能力显著降低。根据生物墨水的透光率和吸光度(图2D、2E)以及打印支柱的直径稳定性(图2F)对结果进行了定量评价。混合物生物墨水表现出与原始胶原蛋白完全相似的纤维性颤动温度,并且在10℃下进行光交联过程后,胶原蛋白/PEGDA生物墨水的G'显著增加(图2G、2H)。
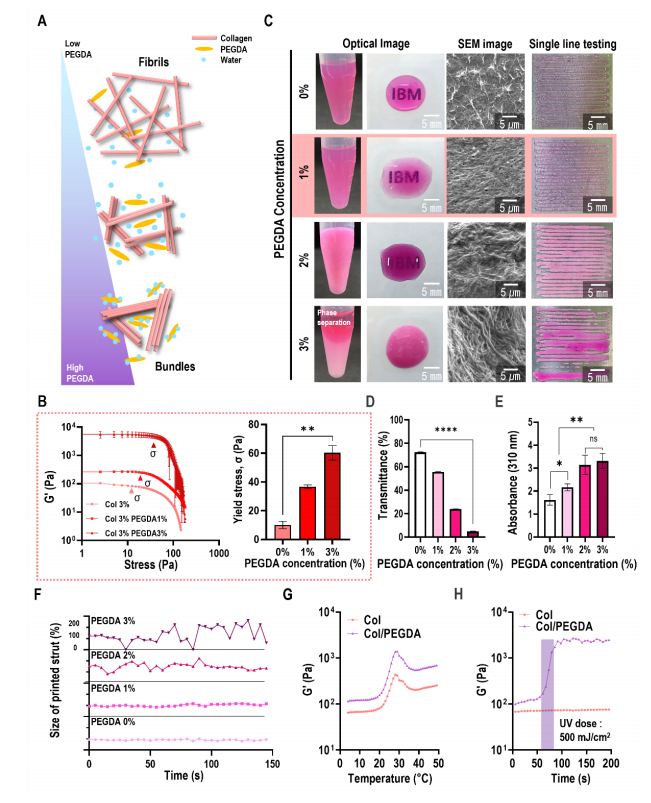
图2 优化胶原蛋白/PEGDA生物墨水的配方
在该研究中,研究人员固定了连续相(胶原蛋白/PEGDA生物墨水)的粘度(13.8 Pa)和流速(20 mm/s),并改变了分散相(充满细胞的GelMA生物墨水)的粘度和流速(图3A)。GelMA随着温度的升高进行了凝胶-溶胶转变(图3B)。通过控制细胞装载的GelMA加工温度,在核心区域获得了三种细胞聚集形状(珠子、念珠和细线,图3C)。通过改变GelMA在核心区域的流速,改变了GelMA区域制备结构(珠、念珠和纤维)的几何形状(图3D ~ 3F)。图3G显示了在GelMA(15℃)温度下的GelMA和Col/PEGDA输入速度的过程图,显示了分散相的各种结构形成。
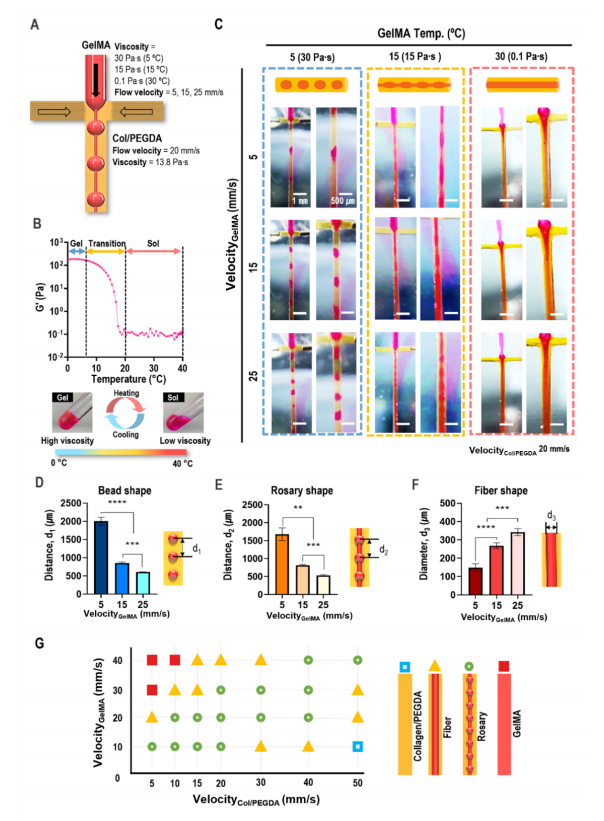
图3 在核心区域制造多种细胞聚集形状
为了观察分散流体在T型结微通道中的行为,采用流体体积(VOF)法模拟了该过程,微通道详细几何形状如图4A所示。采用液滴悬浮法测量了表面张力,这是该工艺的重要材料参数之一,其值如图4B所示。胶原蛋白在10℃时/PEGDA的粘度和GelMA在15℃和30℃时的粘度如图4C所示。GelMA的粘度是制备分散相念珠形的关键因素,GelMA生物墨的输入速度也是影响念珠结构的重要参数(图4D)。图4E显示了GelMA分散相的输入速度对念珠形状的结构几何形状的影响(念珠之间的细线直径r,波长λ,念珠直径R)。图4F显示了通道内念珠和珠状结构周围的速度和压力分布。结果表明,连续相对分散相施加的速度分布要快得多。图4G为GelMA生物墨水在固定粘度(15 Pa)下的GelMA生物墨水的计算工艺图和胶原/PEGDA生物墨水的固定材料参数,显示了分散的相的各种结构形状。实验和模拟处理图之间存在偏差,但GelMA处理温度和连续分散流体速度对核心区域的制造形状的影响也有类似的趋势(图4H)。 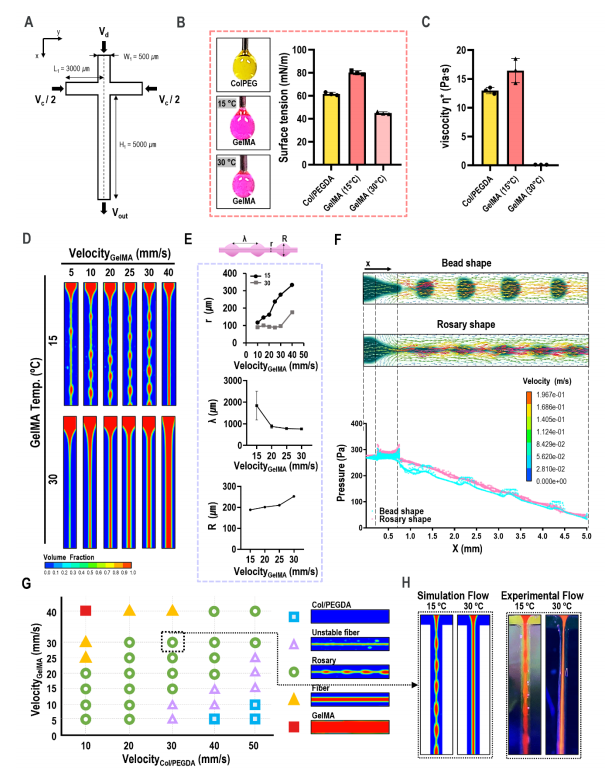
图4 实验结果和CFD模拟之间的比较分析,以评估核心区不同GelMA聚集形状的形成
使用了由分散相和胶原/PEGDA水凝胶连续相组成的支柱评估细胞聚集形状对生物活性的影响(图5A)。分散相为三个不同的细胞聚集形状,即珠子状,念珠形状[RS]和纤维形状[FS],其中GelMA以细胞密度为2×10⁵ cells/mL混合。图5B、5C显示了第3天和第7天的活(绿色)/死(红色)细胞图像和细胞活力,所有的支柱都显示出足够高的细胞活力,这表明微流控过程和原位交联条件对负载的细胞是安全的。RS支柱中发生了细胞间和ECM之间的强大相互作用(图5B、5D)。为了量化结构中的神经源性基因的表达,在第21天测量了第1天NEFH、NeuroG1、NeuroD1和突触蛋白1的mRNA表达(图5F)。
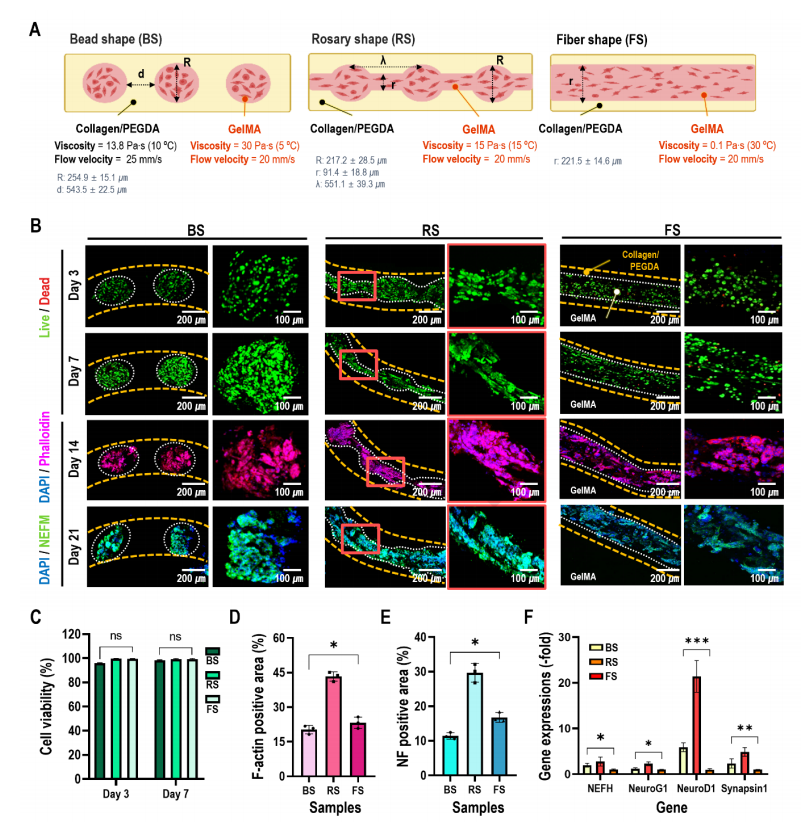
图5 各种NSC-34在核心聚集形状的体外细胞活性
如光学和免疫荧光图像(DAPI/MHC/NEFM)和RT-PCR结果所示,共培养的NSC-34和C2C12细胞的比例为1:100,显示肌原性、NMJ-和神经源性相关基因表达高度上调(图6A、6B)。
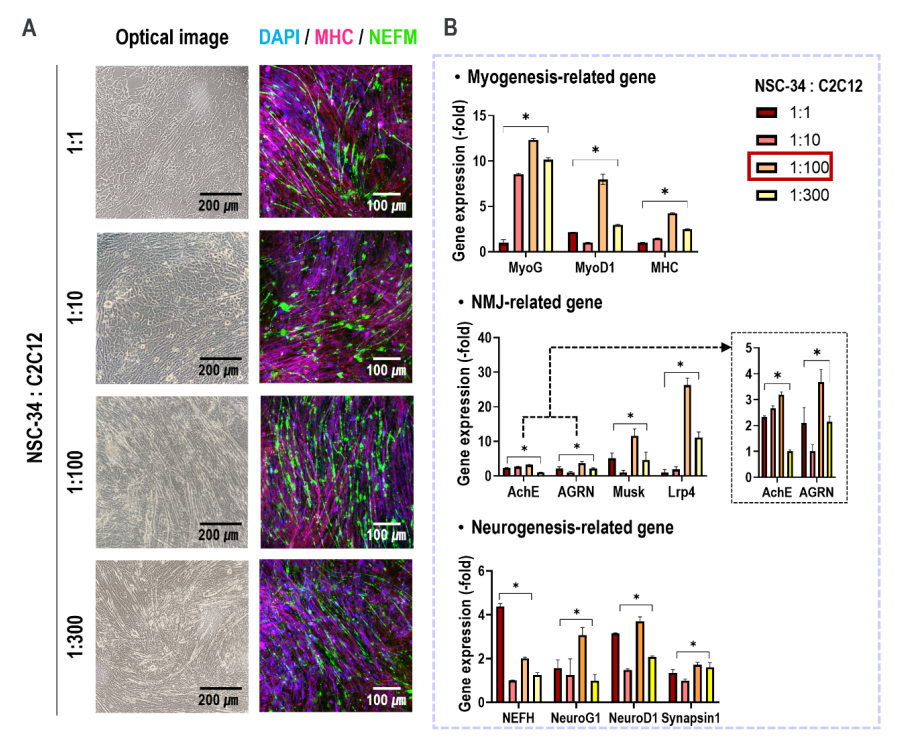
图6 不同NSC-34和C2C12混合物比值的体外细胞活性
作为对照,使用用胶原蛋白/PEGDA/GelMA生物墨水包裹的NSC-34和C2C12细胞的混合物来制造细胞负载结构(图7A)。图7B显示了通过MTT检测的HRS结构和对照的细胞增殖,混合念珠结构(HRS)中细胞的增殖明显高于对照组。图7C显示了用细胞追踪器染色的每种细胞类型(绿色:C2C12;红色:NSC-34)的荧光图像,在图像中对照组的细胞分布均匀,而在HRS结构中,含NSC的GelMA在C2C12细胞装载的胶原/PEGDA水凝胶中呈念珠状聚集。对照和HRS结构培养14和21天,观察了神经丝的核心亚基之一dapi/MHC/NEFM(图7D)。
在培养了这些结构之后,发现HRS结构比对照更能再生肌肉组织,由几个肌肉特异性基因(MyoG、MyoD1、MHC)(图7E)、NMJ特异性基因(AchE、Agrin、Musk和Lrp4)(图7F)和神经发生基因(NeuroG1、NeuroD1、NEFH和突触蛋白1)(图7G)决定。一般来说,肌肉特异性基因如MHC、MyoG和MyoD1的表达表明再生组织成熟为功能性肌纤维。NMJ特异性基因的表达为再生组织的功能成熟提供了进一步的证据,因为这些基因参与了NMJ的形成和维持。 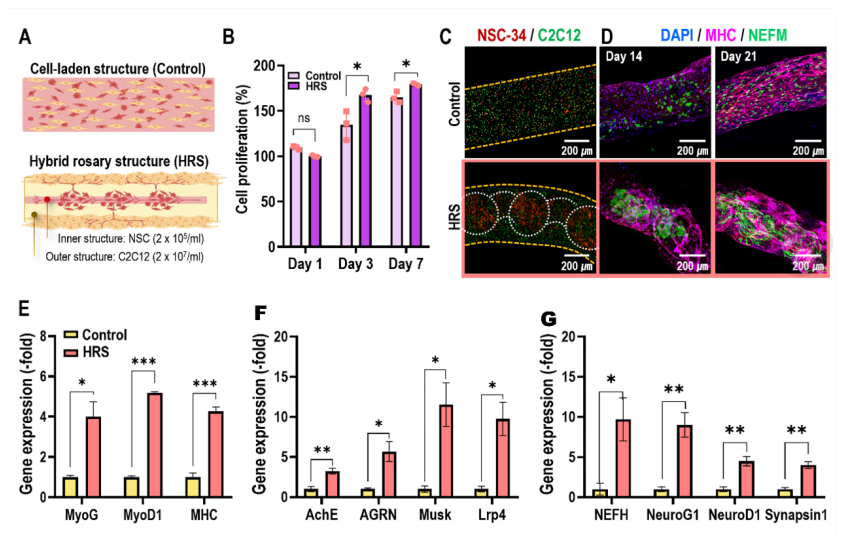
图7 比较正常细胞负荷结构和杂交念珠结构之间的体外NMJ形成
该研究使用T型微流控装置创建了一种填充不同形状的微尺度细胞聚集物的新型混合支柱,以研究细胞聚集物形状对细胞活动的影响。通过控制分散的相粘度和连续相速度,产生了球形、念珠状和线状的细胞聚集物。本研究结果显示,胶原/PEGDA支柱中的念珠状细胞聚集物在促进细胞活性方面最有效,包括增强神经源性活性,这是由于制造过程中细胞间的相互作用和制造过程中瑞利不稳定性产生的机械应力。为了证明该微流控装置的可行性,在核心中创建了基于GelMA的NSC-34细胞聚集物和连续阶段的C2C12细胞聚集物。
与传统的生物打印支柱结构相比,装载NSC-34的念珠结构表现出明显更高的肌源性和神经源性分化以及NMJ的形成。本研究结果表明,这种利用混合细胞装载结构的新的生物制造技术具有多种组织工程应用的潜力,包括生物芯片模型,并可能有助于增强组织再生。
审核编辑:刘清
-
一种基于多瓣结构微凝胶的单细胞组装和细胞3D共培养技术2018-04-19 5398
-
如何将微流控SERS技术应用于活细胞检测?2018-08-20 4065
-
新型微流控芯片利用局部电场高效“捕获”细胞2018-08-23 4745
-
微流控芯片细胞分析技术的分类及优点2018-10-10 12417
-
微流控芯片在单细胞捕获中的应用2019-04-08 9301
-
利用微流控技术制备高度贯通多孔微载体2019-06-30 4767
-
一种高效的微流控细胞芯片,通过快速筛选允许细胞实现病毒的分离和培养2022-06-07 4438
-
一种3D打印支架集成的“三明治”结构微流控装置2022-09-26 2290
-
微流控成像细胞分析技术MIC进展与突破2022-12-02 2288
-
利用惯性微流控技术实现微通道内非尺寸依赖的细胞可控三维聚焦2023-06-19 3702
-
宽带功率放大器基于微流控技术的细胞分选的应用2024-08-06 2742
-
Aigtek高电压放大器微流控细胞筛选测试2025-01-20 723
-
功率放大器在液滴微流控细胞分选中的应用2025-04-03 640
-
基于细胞微流控的阻抗测试解决方案2025-07-02 1093
全部0条评论

快来发表一下你的评论吧 !

