

F-P型光流控微腔生物传感器实现超低浓度分子构象变化过程检测
描述
随着(类)器官芯片等技术的发展及其药筛应用,以及分子尺度细胞生物学基础研究的深入,越来越需要针对单个(干)细胞或单个类器官细胞团簇的代谢等过程,进行快速分子检测,乃至实时在线生化监测。尤其是对蛋白质等生物大分子的连续、实时、在线而又特异识别的定量传感和检测,一直以来是有挑战的。其原因很大程度在于:包括光学、电学、机械等各种换能机制的各类已有生物大分子传感器,要实现特异识别,基本仍依赖耗时复杂的表面修饰,这是这些生物大分子传感器仍有多种功能限制和性能不足的根源之一。例如,全程传感测定费时、可检测分子尺寸受限、非特异吸附干扰等等;尤其是,限制了其对生物大分子的在线、连续乃至动态实时的特异识别传感分析,大部分须“用后即抛”。
很多生物分子测定技术如经典的酶联免疫吸附测定(ELISA)等,以光作为信息载体,基于光吸收比色、荧光发射、吸收或散射光谱等方式,实现蛋白等生物大分子的特异识别后的换能传感。近年来,光学微腔如回音壁模式(WGM)、光子晶体以及法布里-珀罗(Fabry-Pérot microcavity,F-P)腔等,由于高品质因子(Q)和对光学构型或界面光学参数变化的高灵敏度等优势,成为各类物理、化学和生物传感器的理想构型。其中,光流控WGM微泡腔传感器被广泛应用于生物传感器研究,并实现了超低浓度的生物分子特异性检测。然而,目前绝大部分生物光学传感器,尤其是基于免疫吸附等特异性识别的生物大分子光传感器,很大程度上依赖光学界面的探针分子表面修饰来实现特异识别能力,而仍难突破上述技术藩篱和挑战。
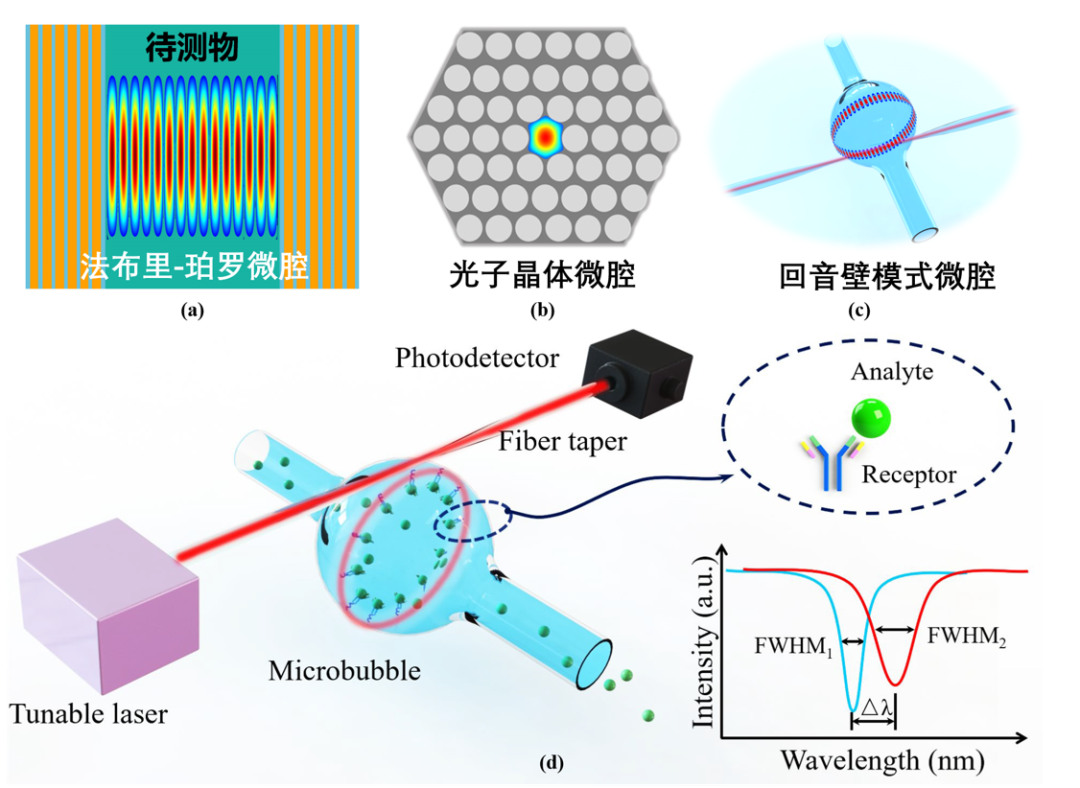
图1 三种常见的光学微腔结构及光流控WGM微泡生物传感器原理示意图
针对上述问题,为了构建一个针对单个(干)细胞或单个类器官细胞团簇的代谢等过程分析集成的检测平台,复旦团队近日研发了一种免修饰、高灵敏和高品质因子光流控法布里-珀罗型微腔生物传感器,这种传感器可以检测超低浓度(~ fg/ml)的生物分子构象变化过程,在类器官或单细胞衍生物分析、分子构象、临床医学、疫病诊断等领域具有广阔的应用前景。选用的无源传感方案,不需要对生物分子进行标记,不仅避免了荧光染料的光漂白问题,更便于与类器官或单细胞衍生物芯片系统相集成,实现实时在线动态检测和重复性利用。然而,无源F-P光学微腔存在无法对腔内的模场进行有效约束及两面反射镜无法保证高度平行而引入光学走离损耗等问题,致其Q值较低。因此,尽管无源F-P光学微腔具有很高的传感灵敏度,其低Q值导致光谱分辨率较低。该团队在研究光流控微泡生物传感器的过程中发现,微泡具有微透镜效应,且对光场具有很强的约束能力;在此基础上,研究团队利用这一透镜效应对F-P微腔内光场进行三维“裁剪”,证明微泡透镜不仅可以缩小微腔的模式体积(~ 6倍),而且能有效地减小腔镜倾斜角(容差高达5°)引起的光学走离损耗,从而实现高达10⁵的Q值;此外,微泡的中空结构为生物分子的检测提供传输通道,实现较强的光-物质作用,使其体折射率传感灵敏度可达679 nm/RIU(@950 nm),比传统的光流控微泡腔传感器高约50倍。
研究团队对F-P型光流控微腔生物传感器的折射率探测极限进行了表征,最终实验上可探测到的体折射率差(Δn)低至10⁻⁷ RIU;在此基础上,研究团队分别对免疫组分(人免疫球蛋白)和代谢组分(人血清白蛋白)的生物分子进行了无修饰、在线实时检测。与基于表面倏逝场传感机制的光学生物传感不同,该传感器检测的是溶液中由于生物分子特异性结合引起的体折射率变化。目前可实现5 fg/mL的人免疫球蛋白和0.5 pg/mL的人血清白蛋白超低浓度检测。相比于现有的分子构象检测技术(如圆二色谱、光学吸收谱等),F-P型光流控微腔生物传感器不仅能实时监测超低浓度分子构象的变化过程,而且只需要微量(~ 60 μL)的溶液体积。这项工作为今后在体内或体外(如单细胞或类器官的动态代谢物分析)进行在线、集成和动态生物分子分析提供了一条新的技术路线。
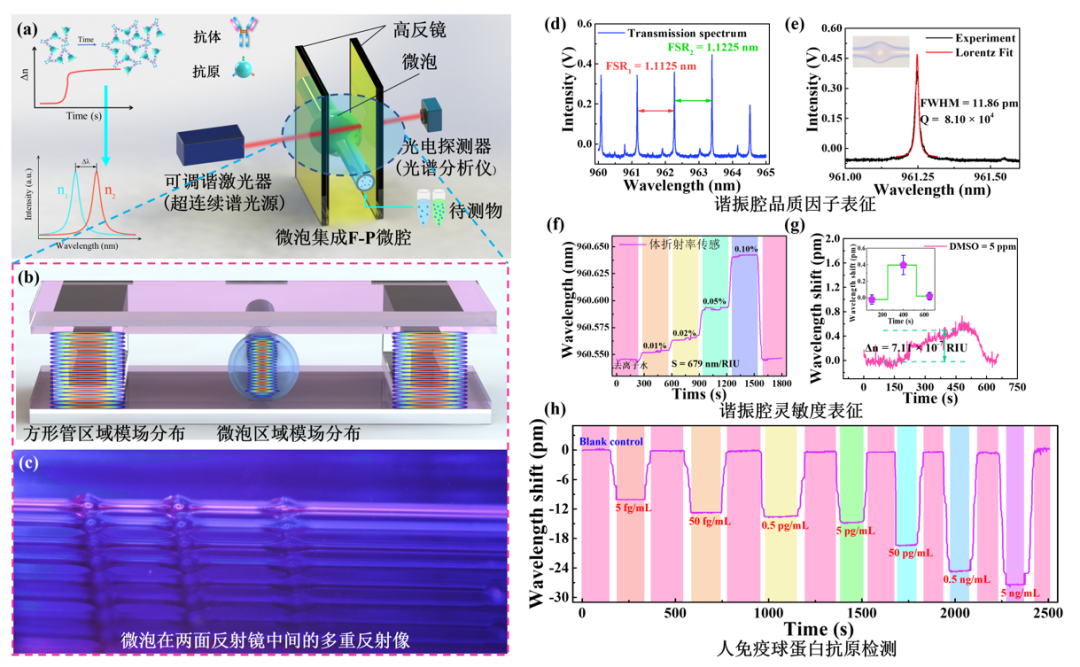
图2 三维构型法布里-珀罗光流控微腔生物传感器示意图
相关研究成果以“Highly sensitive, modification-free, and dynamicreal-time stereo-optical immuno-sensor”为题于近期发表在国际知名学术期刊Biosensors and Bioelectronics上。复旦大学光科系赵旭阳为该论文的第一作者,吴翔和孙允陆为论文的通讯作者,西南技术物理研究所王浟团队参与该项工作;研究团队感谢中国科学院上海微系统与信息技术研究所赵建龙/吴蕾团队的帮助。该研究工作得到了中国科学院战略重点研究计划、国家自然科学基金、上海市自然科学基金、中国北方工业集团有限公司激光器件技术重点实验室开放基金和上海市浦江项目的支持。
审核编辑:刘清
-
GMR生物传感器的原理及研究现状2018-11-01 3388
-
高效快速准确生物传感器技术成功分离赤芍抗内毒素成分2018-11-20 1728
-
生物传感器阵列自动检测仪研制成功2019-06-28 2533
-
基于生物传感器的医疗领域应用2019-07-16 2953
-
请问怎样去设计压电生物传感器检测电路?2021-04-14 2029
-
生物传感器原理(biosensor)2008-01-07 2716
-
生物传感器2008-01-09 1451
-
生物传感器的应用详解2017-02-07 13156
-
如何利用红外传感器追踪蛋白质构象变化设计出高效药物?2018-08-15 2178
-
生物传感器的结构组成2018-12-17 10468
-
一种新型双曲面鼓型微腔激光生物传感器2020-06-24 2608
-
生物传感器助力血糖监测行业变革2023-04-28 2827
-
F-P微腔的基本原理 法布里-珀罗光学微腔及其应用2023-08-27 30858
-
电化学生物传感器在生物检测领域的显著优势2024-04-29 2098
-
生物传感器:科技前沿的生物监测利器2024-11-20 5230
全部0条评论

快来发表一下你的评论吧 !

