

新型微针递送系统首次实现胃壁的分层精准递药
描述
肥胖及其伴发的代谢相关性疾病,包括2型糖尿病、高血压病、脑中风,甚至恶性肿瘤等,严重损害人类的生命健康,给全球医疗保健系统都带来了巨大的负担。一个令人担忧的现象是,每年有超过280 万人死于肥胖,而且这一数字还在不断增加。传统的治疗方法包括生活方式/药物干预和减重手术。然而,前者的疗效一般,容易反弹,而后者适用于特定人群,且会导致永久性改变。因此,需要寻找一种微创、可逆且疗效显著的方法,才能更好的解决这一全球性难题。肉毒杆菌神经毒素-A(BTX-A)是最有效的肌肉麻痹剂之一,它通过与肉毒毒素受体结合并被内吞入神经末梢,裂解其内的SNARE复合体, 从而影响突触囊泡与突触前膜融合,阻滞乙酰胆碱等神经递质的释放,中止兴奋性突触后电位,导致肌细胞和腺体细胞等效应细胞局部失活。
BTX-A 的作用具有特异性和可逆性,没有明显的副作用。既往研究发现,胃壁局部注射 BTX-A 可抑制胃蠕动,减缓胃排空,具有潜在的减重效果。然而,实际临床应用中,BTX-A注射所引起的体重减轻效果存在较大差异。这可能与胃壁不同层次的结构和功能不同,导致对 BTX-A 的反应也不尽相同。综上,为了充分发挥 BTX-A 的治疗效果,需要寻找一种更加合理且精准的给药策略,并阐明其内在机制。
2023年8月9日,中日友好医院减重糖尿病健康管理中心孟化教授课题组,北京化工大学机电工程学院庄俭副教授课题组和中日友好临床医学研究所彭亮教授课题组在Advanced Science期刊上在线发表了题为“Layer-Specific BTX-A Delivery to the Gastric Muscularis Achieves Effective Weight Control and Metabolic Improvement”的研究论文,该研究研发了一款新型微针递送系统,首次实现胃壁的分层精准递药。进一步研究发现胃壁肌层特异性麻痹,可以产生最佳的减重和降糖效果。
本研究创新性的研发出了一款新型微针递送系统,命名为胃壁分层特异性麻痹微针(LGP-MNs),用于将 BTX-A 精确递送到胃壁的不同层次(黏膜层,黏膜下层或肌层)。经过优化的 LGP-MNs 具有足够的强度与韧性,可以适应蠕动的胃壁结构,并且能够通过针尖的快速溶解将 BTX-A 均匀地输送到指定的胃壁层次,在局部达到较高的工作浓度。通过构建肥胖大鼠模型进行验证,发现与传统的普通针注射BTX-A相比,LGP-MNs 可以极大的提高操作的安全性。同时,针对不同胃壁层次的给药结果显示,BTX-A分层递药的确会产生不同的作用效果。其中,LGP-MNs 介导的胃壁肌层麻痹显示出最佳的治疗效果,包括更加明显的胃排空延迟,体重减轻、肝脏脂肪变性减弱、肠道菌群改善等。此外,该研究还首次发现只有胃壁肌层特异性麻痹时,才会出现胰岛素敏感性改善的现象。进一步分析表明,这可能与胃源性胰高血糖素样肽-1(GLP-1)(一种胰岛素分泌刺激物)的分泌显著增加有关。
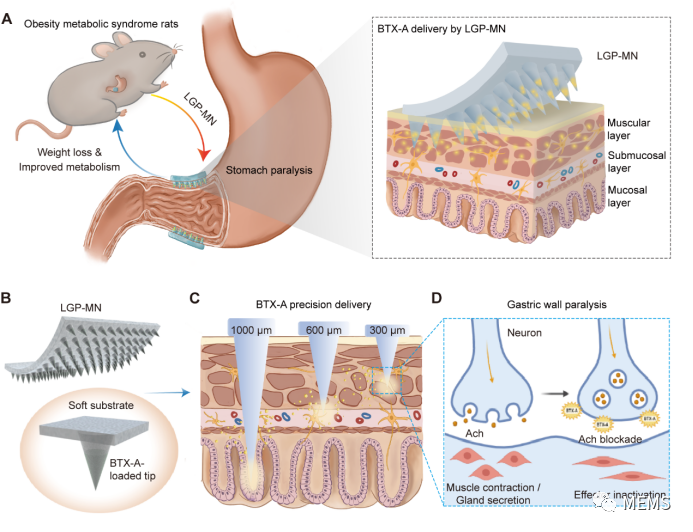
LGP-MNs的应用及作用机制示意图
综上所述,这项由LGP-MNs实现的转化研究可作为BTX-A进一步临床应用的主要理论基础。同时,精确靶向胃壁肌层的递药策略可以大大改进传统的BTX-A递送方法,结合内镜技术,作为一种新的微创疗法应用于临床减重,具有巨大的转化潜力。
中日友好医院减重糖尿病健康管理中心医师王思奇,香江学者博士后王玉琼和北京大学工学院博士研究生林龙为本文的共同第一作者,中日友好医院减重糖尿病健康管理中心孟化教授,北京化工大学机电工程学院庄俭副教授和中日友好临床医学研究所彭亮教授为本文的共同通讯作者。
审核编辑:彭菁
-
基于分层递阶智能控制的倒立摆研究2011-07-06 901
-
穿戴式皮下递药装置enFuse给患者带来更友善的递送药物方式2018-11-14 2576
-
利用中空微针实现高效皮内递送治疗非黑色素瘤皮肤癌2022-10-31 2860
-
可穿戴自供电载药电子微针系统,用于炎症性皮肤疾病治疗2023-04-04 2877
-
基于电沉积法制备的纳米微针实现药物在原代细胞内的有效递送2023-04-18 2343
-
利用微针机器人实现结肠给药的快速自定位和抗蠕动粘附2023-07-03 1446
-
微针机器人实现结肠给药的快速自定位和抗蠕动粘附2023-07-24 2690
-
基于微针的生物医学系统的设计、制造和应用研究进展2023-11-27 2289
-
基于医用胶带的可溶解倒钩微针,可提高皮肤附着力和药物递送效率2024-04-20 1932
-
ATA-2000系列高压放大器在饱超声微针阵列系统经皮给药实验的应用2025-08-04 484
全部0条评论

快来发表一下你的评论吧 !

