

新型微针可实现药物递送和生物标志物检测
描述
黑色素瘤是一种最令人担忧的皮肤癌,病因是黑色素细胞生长失控。虽然黑色素瘤患者可从现有的免疫疗法中得到帮助,但到目前为止,并非所有患者都能受益,有超过50%的患者对目前的免疫疗法药物没有反应,而在最初有反应的患者中,有许多也产生了耐药性。因此,除了开发更有效的免疫疗法,还需要医生能够判定哪些患者在开始治疗时反应良好,哪些患者保持或停止反应,以便做出最佳的治疗方案。
由于黑色素瘤患者皮肤癌变的损伤部位很容易察觉,所以根除癌变的有效方法可能是局部应用免疫疗法,而不是将药物注入患者血液进行系统性循环。此外,通过灵敏、连续地测量不同的生物标志物——标志着预期的免疫细胞激活和理想的炎症反应,来监测免疫系统对肿瘤部位治疗的反应,可以实现更好、更个性化的患者护理。
据麦姆斯咨询报道,近日,美国哈佛大学韦斯生物启发工程研究所(Wyss Institute at Harvard University)、麻省理工学院(MIT)和波士顿布莱根妇女医院(Brigham and Women's Hospital)组成的一支研究团队开发出一种新型疗法,该方法集成了微创、无痛的微针平台,能够从皮肤深层吸收细胞周围含有生物标志物的液体,同时采用超灵敏的单分子检测方法(如分子免疫阵列(singlemoleculearray,Simoa))检测罕见的但与疾病相关的生物标志物,新的检测方法灵敏度远高于传统方法。研究人员通过创建小鼠黑色素瘤模型,利用新型疗法治疗其癌变,从而为该新型疗法提供概念验证。该疗法局部作用于肿瘤病变部位,它结合了非侵入性聚焦超声(FUS),递送先前开发的纳米颗粒(NP)结合的炎症诱导蛋白激活剂——干扰素基因刺激因子(STING),在肿瘤部位产生热量,立即杀死肿瘤细胞。相关研究成果发表在Advanced Functional Materials期刊上。
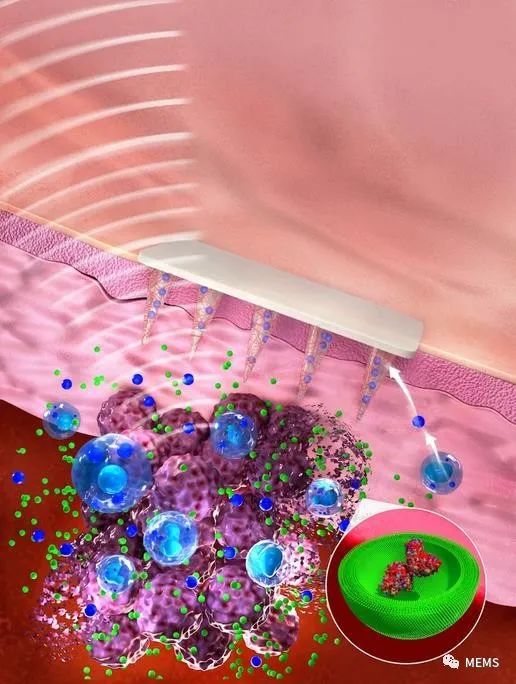
使用微针从黑色素瘤病变中采集生物标志物分子,并通过超灵敏的单分子检测方法进行检测
领导这项研究的哈佛医学院(HMS)医学副教授、麻省理工学院医学工程与科学研究所(Institute for Medical Engineering and Science,IMES)的首席科学家、哈佛大学韦斯生物启发工程研究所助理教员Natalie Artzi博士说道:“利用这种新型疗法,使用微针可以快速读取黑色素瘤的治疗反应,并能进行有效的药物筛查和患者分层,可最大限度地提高治疗效果。”
局部免疫疗法
Artzi及其团队成员利用以前的一些开创性方法和专业知识,首先开发了一种针对黑色素瘤的局部应用免疫疗法。在最近出版的论文中,他们提到了一种在免疫细胞中激活该蛋白的更有效方法,该方法建立在炎症诱导蛋白激活剂——干扰素基因刺激因子——有助于杀死肿瘤细胞这一已知事实的基础上。干扰素基因刺激因子的天然激活剂(激动剂)在体内不够稳定,需要高剂量给药,但是这会产生副作用。该研究团队的解决方案是通过纳米颗粒递送多个拷贝的合成干扰素基因刺激因子激活剂——合成环状二核苷酸(CDN),通过易于穿过质膜的纳米颗粒,在工程酶促反应的帮助下,将物质释放到细胞内。这种环状二核苷酸-纳米颗粒治疗剂可以直接注射于癌变皮肤或附近皮肤,以增加肿瘤中的药物浓度。
该论文的第一作者、BioDevek初创公司的研究科学家Daniel Dahis博士在以色列理工学院(Israel Institute of Technology)教授、医学成像专家、该论文的合著者Haim Azhari博士的指导下,与Artzi一起通过该项目完成了研究生工作。他说:“在该项研究中,我们通过聚焦超声结合干扰素基因刺激因子激活剂在肿瘤微环境(TME)中递送,以促进对垂死肿瘤细胞抗原的处理,同时协调更广泛的免疫反应。”
该研究团队首先表明,聚焦超声治疗可使皮肤小面积温度瞬时升高至60°C,增强了环状二核苷酸-纳米颗粒治疗在培养皿中免疫细胞和癌症细胞的共培养、以及在小鼠黑色素瘤肿瘤中的效果,他们采用了这种联合治疗法。重要的是,在治疗后60天,所有只接受聚焦超声治疗的动物都已死亡,而只接受环状二核苷酸-纳米颗粒治疗的动物中有75%依然存活,而联合治疗法使该受试组动物达到100%的存活率。
深入挖掘皮肤生物标志物
为了研究联合治疗法的存活要点是否体现在肿瘤部位的生物标志物水平上——这在未来可能转化为对接受免疫疗法的人类患者反应的监测,Artzi的研究团队之前开发了一种由透明质酸制成的新型微创微针,原则上可用于同时递送药物和检测生物标志物。该微针可到达皮肤的真皮层,聚合物在此处会与皮肤细胞周围的液体(即皮肤间质液(ISF))相遇,它会像海绵一样,吸收少量皮肤间质液。Dahis说:“仅用微针获得的几微升皮肤间质液就可提供丰富的生物标志物信息,因为正常皮肤细胞、局部免疫细胞和癌症细胞不断分泌不同的信号分子和代谢产物。取回微针后,可以简单地溶解微针的尖端,将捕获的分子释放到试管中,以便我们开始生物标志物分析。”
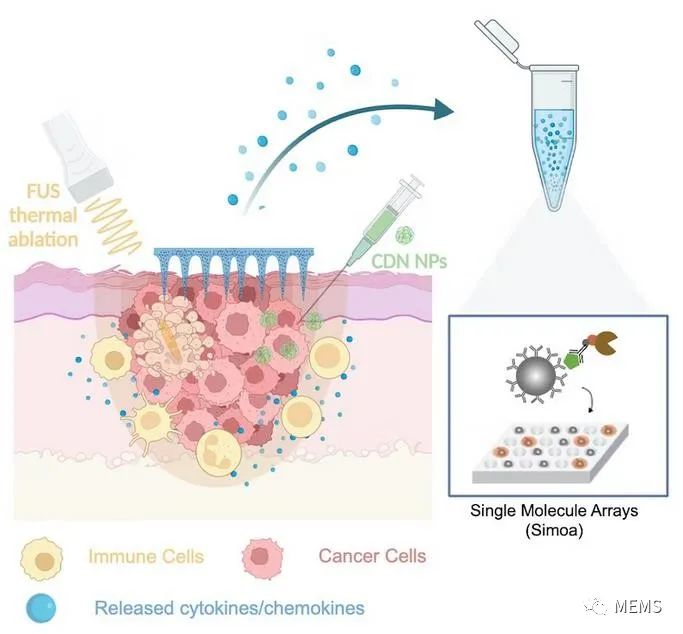
研究人员设计了一种基于新型微针的策略来监测对局部应用的黑色素瘤免疫疗法的免疫反应
然而,尽管研究人员发现聚焦超声明显增加了环状二核苷酸-纳米颗粒在肿瘤中引发的免疫反应,但使用传统方法几乎无法检测到或根本检测不到许多有意义的生物标志物,例如被激活的干扰素基因刺激因子蛋白激活基因。为了克服这一瓶颈,Artzi的研究团队与韦斯生物启发工程研究所核心教员David Walt博士联手,David Walt博士之前开发了具有超灵敏生物标志物检测能力的分子免疫阵列技术。分子免疫阵列本质上允许研究人员用一种特异性抗体分子捕获有意义的生物标志物蛋白,该特异性抗体分子与一个比抗体本身大得多的磁珠相连。然后,在第二类检测抗体的帮助下,将结合蛋白“夹”在多孔板的各个孔中,每个孔只能容纳一个磁珠。抗体探测器可在孔中产生荧光信号的酶标记。因此,分子免疫阵列能够在单分子水平上对单个生物标志物蛋白进行数字计数,这远远超过了常用检测方法的灵敏度。
Walt团队的合著者Tal Gilboa博士开发了四种分子免疫阵列检测方法,以检测由干扰素基因刺激因子激活的分子表达:干扰素-b(IFN-b)、人巨噬细胞趋化蛋白-1(MCP-1)和枯否细胞(KC),它们都能吸引免疫细胞进入肿瘤,以及一般炎症标志物白细胞介素-6(IL-6)。事实上,这使研究人员能够在微针提取的皮肤间质液样本中检测到这些生物标志物,与常用的检测方法相比,灵敏度提高了100到1000倍,并且这些测量结果反映了血液样本中相同生物标志物的平行分子免疫阵列测量。Dahis说:“令人震惊的是,具有最明显促炎反应的动物也是存活时间最长的动物。”
哈佛医学院(HMS)Hansjörg韦斯生物启发工程研究所教授、布莱根妇女医院的病理学教授、霍华德·休斯医学研究所(HHMI)教授Walt说:“Artzi实验室卓越的微针技术包含工程纳米结构,原则上可以实现药物递送和微量采样——这是一个全新的治疗概念,为黑色素瘤的治疗提供了理想的、非侵入性且全面的解决方案。”Walt与合著者Rushdy Ahmad博士共同领导了韦斯生物启发工程研究所诊断加速器——旨在缩短包括癌症在内的多个疾病领域所需的诊断时间。
新型微针可同时实现药物递送和生物标志物检测
韦斯生物启发工程研究所创始董事、医学博士Donald Ingber介绍道:“这项工作是我们在韦斯生物启发工程研究所努力实现的跨学科合作和尖端技术融合的一个典型例子。这一新进展有可能通过直接评估个体患者的治疗效果,将癌症免疫疗法的质量提高到一个新的水平。”
医学博士Donald Ingber是哈佛医学院和波士顿儿童医院(Boston Children's Hospital)犹大·福克曼(Judah Folkman)血管生物学教授,也是哈佛大学约翰保尔森工程与应用科学学院、Hansjörg韦斯生物启发工程研究所仿生工程教授。
审核编辑:彭菁
-
上海大学:研发电化学生物传感器检测神经系统疾病生物标志物2024-06-28 1641
-
基于医用胶带的可溶解倒钩微针,可提高皮肤附着力和药物递送效率2024-04-20 1910
-
基于微针的生物医学系统的设计、制造和应用研究进展2023-11-27 2273
-
纳米孔测序可检测数十种疾病生物标志物2023-10-12 1641
-
用于便携式远程痕量生物标志物检测的自供电传感装置2023-09-14 2012
-
新型可穿戴皮肤传感器检测人体汗液中炎症生物标志物CRP2023-06-27 878
-
基于空心微针的等离子体传感器检测真皮间质液中的生物标志物2023-05-11 1958
-
基于电沉积法制备的纳米微针实现药物在原代细胞内的有效递送2023-04-18 2322
-
识别癌症标志物的DNA纳米机器综述和分析2021-01-04 3348
-
能够检测早产生物标志物的3D打印装置2019-06-03 3885
-
豆腐成为药物递送微载体2019-02-02 2802
-
用于检测并筛选疾病生物标志物的液滴微流控技术2018-06-12 5432
-
肿瘤标志物(TM)的含义与检测原理的分析及案例解析2017-09-24 2004
全部0条评论

快来发表一下你的评论吧 !

