

一种准固态镁离子电池(QSMB)设计
电池技术
描述
01
导读
近年来,除了锂离子电池,可充电的多价离子电池-镁离子电池吸引起了越来越多的关注。与锂离子电池相比,镁离子电池具有更高的材料丰富度、更安全、成本更低的优势。然而,镁金属以其钝化行为而臭名昭著,这会阻碍氧化还原反应的发生,尤其是在极易还原的电解质中。为了防止镁负极的钝化,大部分可充电镁离子电池的研究使用由复杂盐和有机溶剂组成的非水液态电解质。然而,有机镁离子电解质的导电性较差,限制了其扩散动力学,并需要较高的温度来保持电池性能。它们还需要无水和无氧环境,并由于毒性和易燃性而带来严重的安全风险,类似于传统的锂离子电解质。
02
成果简介
当前,非水性的镁离子电池离子导电性差,而水性电池的电化学窗口较窄。本文设计了一种准固态镁离子电池(QSMB),通过限制氢键网络实现真正的多价金属离子储存。QSMB的能量密度为264 W·h kg-1,几乎是水性镁离子电池的五倍,电压平台为2.6至2.0 V,优于其它镁离子电池。此外,在零下22°C的低温下,经过900个循环后,它仍保持90%的容量。QSMB充分利用水性和非水性系统的优势,为设计高性能的镁离子电池和其他多价金属离子电池提供了创新的方法。相关工作以“Next-generation magnesium-ion batteries: The quasi-solid-state approach to multivalent metal ion storage”为题发表在Science Advances上。
03
关键创新
通过限制氢键网络实现多价金属离子储存。
04
核心内容解读
拓宽电压窗口并增强离子电导率
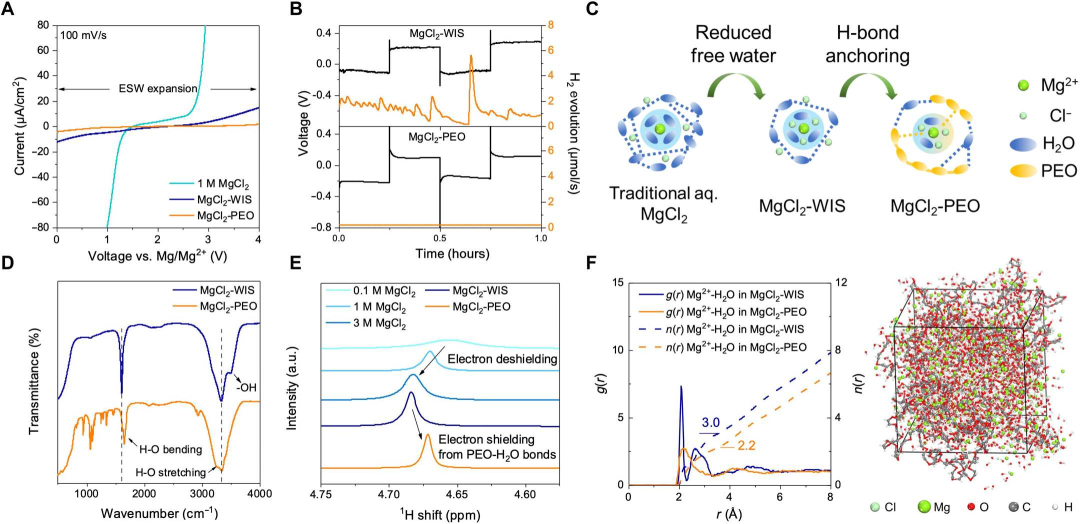
图1 PEO的氢键锚定效应。(A)1 M MgCl2、MgCl2-WIS和MgCl2-PEO在100 mV s-1扫描速率下的ESW。(B)镁对称电池循环过程中H2通量的原位OEMS测量。(C)传统水相MgCl2、MgCl2-WIS和MgCl2-PEO中氢键网络和溶剂化鞘的示意图。0.1、1和3 M MgCl2、MgCl2-WIS和MgCl2-PEO的(D)FTIR光谱和(E)1H NMR谱。(F)Mg2+-H2O的径向分布函数g(r)和综合配位数(ICN) n(r)分布(左)以及MgCl2-PEO的最终MD模拟模型(右)。@The Authors
与传统水溶液相比,PEO聚合物网络的使用扩大了电池的电化学稳定窗口(ESW),在提高电池的电化学性能方面起着主要作用。MgCl2-PEO的ESW明显比1M MgCl2和MgCl2-WIS更宽,因为HER和OER的起始点在0至4.0 V(vs Mg/Mg2+)之间几乎无法被检测到(图1A)。通过原位在线电化学质谱(OEMS)测量,MgCl2-WIS中的Mg对称电池循环时偶尔出现H2气体尖峰,而在MgCl2-PEO中,H2的生成可以忽略不计(0.15 μmol/s,图1B)。MgCl2-PEO表现出良好的电化学稳定性,并且无需超高盐浓度即可抑制HER,这可以归因于PEO的强氢键锚定作用。与MgCl2-WIS相比,MgCl2-PEO的FTIR在1608和3330 cm-1处的峰位移表明了H─O键的增强,它们分别代表了H─O键的弯曲和拉伸振动(图1D)。1H NMR谱显示MgCl2-PEO中H2O的向上位移峰,这表明H原子周围的电子密度较高,PEO和H2O之间共价H─O键的加强(图1E)。
通过分子动力学(MD)模拟对这些实验结果进行了证实。由于强烈的H2O-PEO协同作用,溶剂化的镁离子在MgCl2-PEO中似乎发生了部分脱水。与MgCl2-WIS不同,在Mg的第一层溶剂化壳中出现一个清晰的尖峰(2.1Å),在MgCl2-PEO中,Mg-H2O的g(r)曲线显示出一个较弱、较宽的峰(2.2Å)(图1F)。当PEO存在时,Mg-H2O在3.5Å径向距离处的积分配位数(ICN)从3.0降至2.2。由于PEO配位破坏了水网络,大约27%的溶剂化水分子离开了Mg离子的溶剂化鞘结构。
抑制质子插入
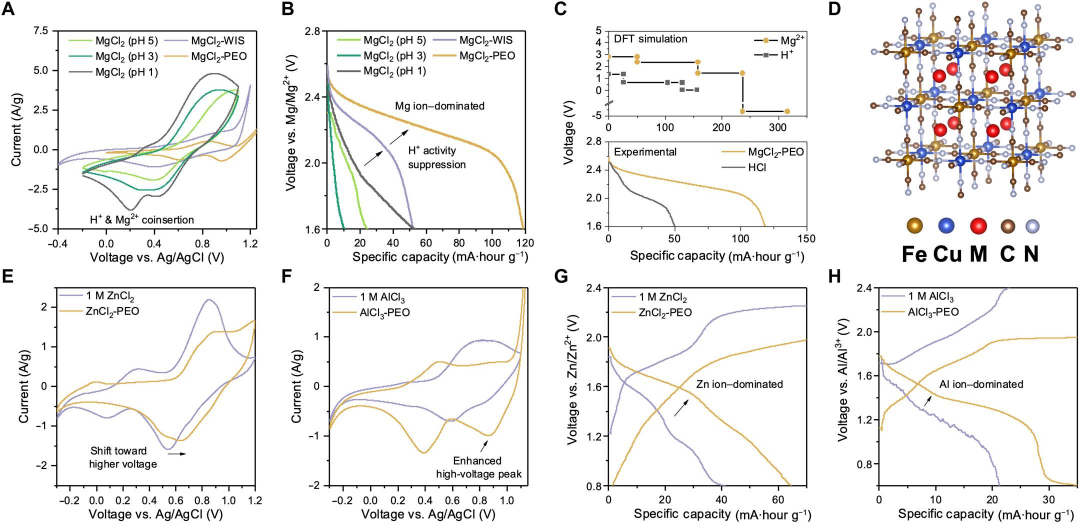
图2电化学实验和模拟研究表明CuHCF中的质子插入受到抑制。(A)CuHCF在10 mV/s扫描速率下的CV曲线和(B)Mg/CuHCF全电池在不同pH值的MgCl2水溶液、MgCl2-WIS和MgCl2-PEO中的恒电流放电曲线。(C)通过DFT研究模拟的Mg和H离子的插层电压。(D)M2Cu[Fe(CN)6]的晶体结构(常规晶胞),其中M=Mg2+或H+。(E和F)CuHCF在10 mV/s 扫描速率下的CV实验和(G和H)1 M ZnCl2、ZnCl2-PEO、1 M AlCl3和AlCl3-PEO下锌离子和铝离子电池的恒电流循环曲线。@ The Authors
在不同pH值的MgCl2水溶液中对CuHCF正极进行CV测试(图2A),发现质子和镁离子共插入过程由两个电压相似的还原峰组成,证明了它们的竞争关系。在传统的MgCl2水溶液(pH1-5)中,在高电压(>2.0V)下不存在Mg2+主导的放电平台,因为Mg2+嵌入受到质子活性的限制(图2B)。根据第一性原理的密度泛函理论(DFT)模拟,与H-CuHCF相比,Mg-CuHCF的形成能较低,这表明Mg存储比质子插入更有利且更稳定。因此,Mg离子在模拟中表现出更高的嵌入电压,这与实验放电曲线很好地吻合(图2C和D)。显然,抑制质子插入可以促进更高性能的镁离子存储过程。使用PEO作为氢键锚定物,可以在准固态锌离子和铝离子电池中类似地实现电压增强。与1 M水溶液相比,在基于PEO的ZnCl2和AlCl3电解质中获得了更高的电压还原峰(图2E和F)。随着质子插入CuHCF的过程减弱,可以促进高压多价金属离子嵌入,从而提高电池放电期间的电压和容量(图2G和H)。
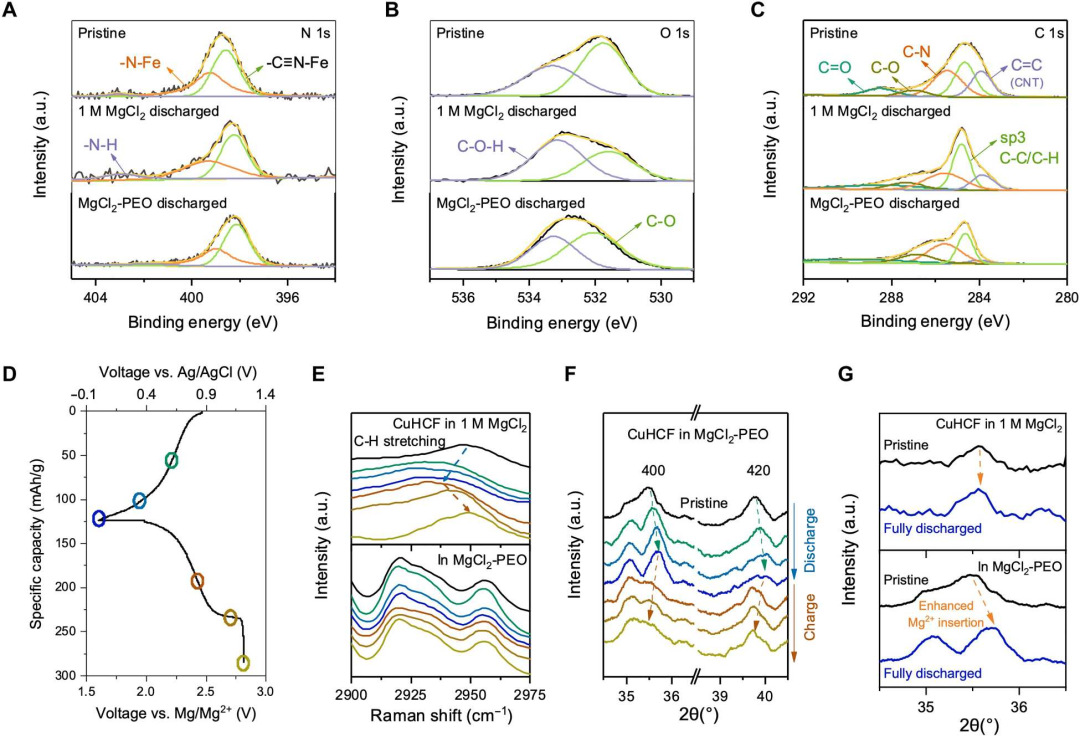
图3 在1 M MgCl2和MgCl2-PEO介质中,对不同充放电状态下的CuHCF正极进行表征。(A-C)N 1s,(B)O 1s和(C)C 1s的非原位XPS光谱。(D)Mg/CuHCF电池的典型恒流循环曲线,显示相应充电状态下的原位实验:(E)原位激光拉曼光谱和(F和G)原位XRD表征和比较。@ The Authors
当电池在1 M MgCl2中完全放电时,CuHCF的XPS N 1s谱显示质子插入后N─H键增加,但在MgCl2-PEO中放电时,没有观察到原始状态的变化,仅存在来自晶格本身的─C≡N─Fe和─N─Fe键(图3A)。在CuHCF的O 1s谱中,在1 M MgCl2中放电时O─H键的增加表明质子也与官能团配位(图3B)。原位拉曼实验表明,在放电过程中,在2948 cm−1附近的C─H伸缩带峰中心位置向更低波数位置发生了位移,并在充电时逐渐迁移回原始状态(图3D和E)。
为了进一步研究CuHCF在离子存储过程中的结构演变,进行了原位XRD实验。当MgCl2-PEO系统放电时,CuHCF晶格的立方结构的(400)和(420)峰显示逐渐转向更高角度(图3F),这表明离子插入引起的晶格膨胀。在充电过程中,随着离子的脱出和晶格的收缩,峰值会移回到较低的角度。在完全充电状态下,由于复杂阴离子的插入,峰值超过了其原始位置,导致结构发生改变。如图3G所示,这种结构变化在MgCl2-PEO中比在1 M MgCl2中更为明显。
高压双镁离子存储
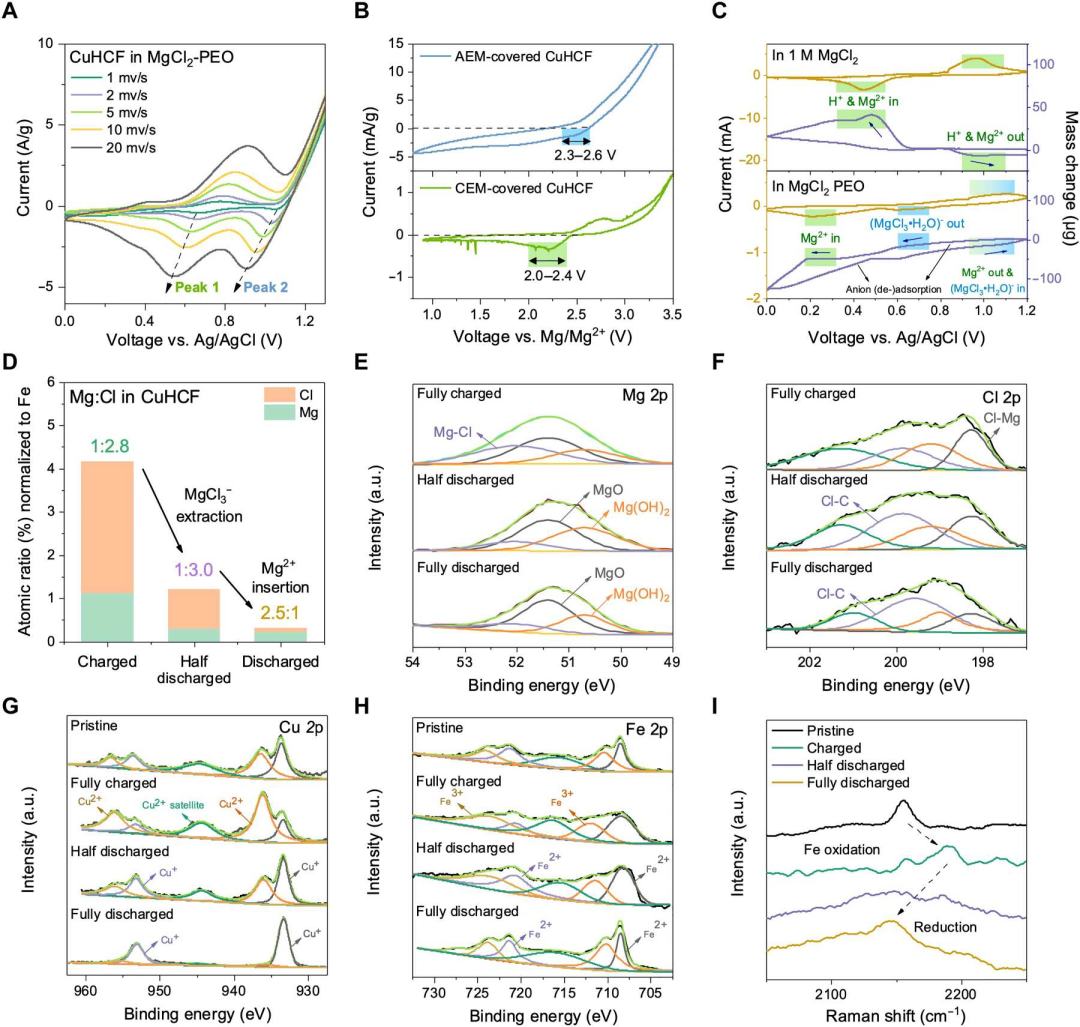
图4 CuHCF中的双镁离子储存。(A)MgCl2-PEO中的CuHCF正极在1-20mV s-1范围内变化的扫描速率下的CV曲线。(B)Mg/CuHCF全电池的CV曲线,其中CuHCF正极分别被AEM和CEM覆盖,扫描速率为1 mV s-1。(C)在1 M MgCl2和MgCl2-PEO中原位CV扫描期间CuHCF电极质量变化的EQCM测量。(D)通过SEM-EDS获得不同充电状态下CuHCF中Mg和Cl的原子比。(E-I)在MgCl2-PEO中不同充电状态下CuHCF正极的表征。(E)Mg 2p、(F)Cl 2p、(G)Cu 2p、(H)Fe 2p的XPS光谱和(I)拉曼光谱。@ The Authors
受到H插入的限制和电化学稳定性的增强,在电池循环后,在CuHCF正极中发现了Mg2+和MgCl3-两种电荷载体的储存。对CuHCF进行的一系列CV实验显示出两个主要的还原峰,分别位于约0.9 V和0.5 V(vs Ag/AgCl)位置(图4A)。使用覆盖有阴离子交换膜(AEM)的CuHCF,仍然保留了高电位还原峰,对应于2.3-2.6 V(vs Mg/Mg2+),而在覆盖有阳离子交换膜(CEM)的CuHCF中获得了一个较低电位的还原峰,位于2.0-2.4 V(vs Mg/Mg2+)(图4B)。为了识别存储的特定阴离子和阳离子种类,对CuHCF进行了原位电化学石英晶体微天平(EQCM)测试,以测量其在CV扫描期间的质量变化(图4C)。由于MgCl3-离子在电池充电过程中插入,非原位XPS结果显示Mg 2p和Cl 2p光谱中都有无机Mg-Cl峰(图4E和F)。XPS Cu 2p光谱揭示了Cu的氧化,与原始状态相比,Cu2+峰增强(图4G)。Fe同时被氧化,Fe 2p光谱中Fe3+相对于Fe2+峰的增强(图4H)以及拉曼光谱中2156 cm-1谱带向上移动至2188 cm-1(图4I)。
准固态电池的电化学性能
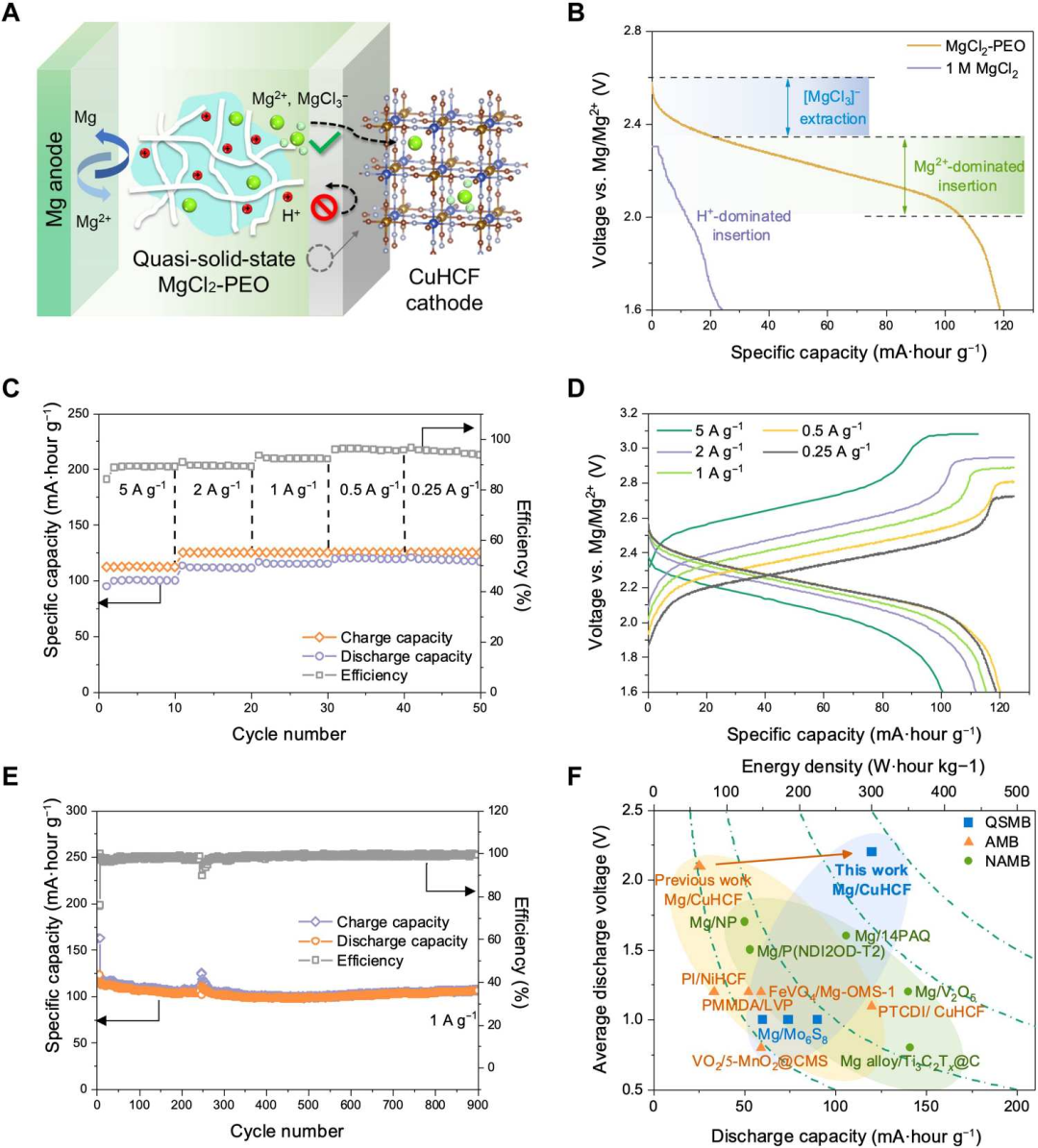
图5 全电池的电化学性能。(A)使用镁金属负极、MgCl2-PEO电解质和CuHCF正极的电池机理的示意图。(B)在0.25 A g−1下的电池放电曲线及相应的机理。(C)不同电流密度下的恒流放电-充电曲线。(D)包括比容量和库仑效率在内的倍率性能。(E)在1 A g−1下的电池长循环稳定性。(F)与其他可充电镁电池的性能比较,包括QSMBs,NAMBs和AMBs。@ The Authors
图5A显示了QSMB的示意图。在0.25 A g−1的电流密度下,所组装的电池有一个显著的放电电压平台,在2.6至2.0 V之间具有120 mA h g−1的比容量(图5B)。在1 M MgCl2系统中,这种明显的性能提升可归因于MgCl3-和Mg2+的双离子(脱)插层机制在抑制质子插入的情况下得到促进。电池性能在更高的电流密度范围(从0.25至5 A g-1)进一步评估。随着电流的增加,放电电压呈现更低的值,并在2.4到1.6 V之间具有100 mA h g-1的放电容量,即使在高达5 A g-1的电流密度下也是如此,在0.25 A g-1时可实现高达95%的库仑效率(图5C和D)。图5F比较了这项工作与其他可充电镁离子电池的性能,包括其他QSMB、AMB和NAMB。该QSMB表现出更高的电压平台,几乎是传统AMB的两倍,并且循环稳定性比大多数NAMB更长。
极端环境耐受性
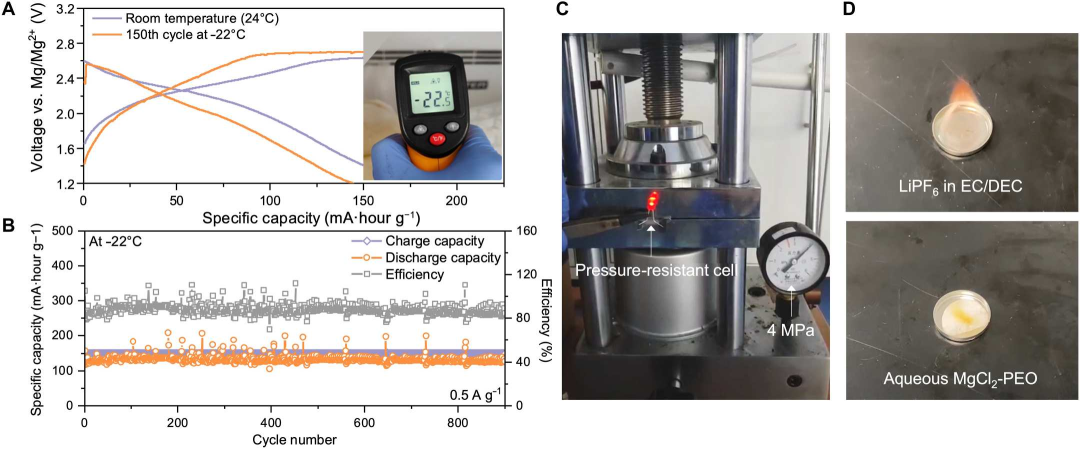
图6 QSMB的低温、压力和可燃性测试。(A)电池在室温和-22°C下的恒电流循环曲线。(B)-22°C、0.5 A g-1下的电池长循环稳定性。(C)电池在4 MPa高压下点亮LED灯泡。(D)易燃有机锂离子电解质和不易燃MgCl2-PEO电解质。@ The Authors
QSMB在极端工作条件下,如极低温、高压和火灾中也表现出极好的耐受性。而传统的锂离子电池在寒冷气候下的冰冻温度下会出现功率输出降低和永久性损坏的问题,这种电池在-22°C的温度下表现出与室温相当的性能,并且即使在0.5 A g-1下进行900次循环或25天的循环后,仍然没有任何性能退化的迹象(图6A和B)。此外,QSMB表现出很强的耐高压负载能力,并在4 MPa下成功点亮了发光二极管(LED)(图6C)。可燃性测试表明,点燃的棉签在与MgCl2-PEO接触时会熄灭,而碳酸乙烯酯/碳酸二乙酯中的商用LiPF6会立即被点燃(图6D)。该QSMB的防冻、耐压和不易燃特性为实用、稳健和安全的电池技术奠定了坚实的基础,该技术可能在未来实现广泛的商业应用。
05
成果启示
在这项工作中,揭示了一种增强QSMB中高压Mg离子(脱)嵌入的策略方法。由于PEO的氢键锚定能力,抑制H+插入正极并促进MgCl3-和Mg2+离子嵌入。与传统的AMB相比,QSMB表现出更高的电压平台(2.6-2.0V),在0.25 A g-1的电流密度,2.6-1.6 V的电压范围内,比容量为120 mA h g-1。与NAMB相比,半固体电解质具有更快的扩散动力学和1.24 mS cm-1的高离子电导率。在1 A g−1下循环900次后,电池仍保留88%的容量,克服了NAMB中常见的不稳定问题。此外,QSMB不仅可以促进所需的离子嵌入,还具有极佳的冷冻耐受性。这项研究为设计用于高电压和耐低温镁离子电池的先进电解质提供了合理的策略,并在其他多价金属离子电池中具有潜在的应用。
审核编辑:刘清
-
日本开发出“超离子”固态锂电池2011-08-08 2818
-
苹果的新专利--全固态电池2015-12-23 4593
-
一种2芯锂离子电池电量监测计LTC41502019-02-13 6821
-
镁燃料电池原理研究2010-09-14 9383
-
镁离子电池技术新突破,研制出“硒化钪镁尖晶石”一种高效的电解质2017-11-29 2282
-
镁空气电池的工作原理_镁空气电池的使用寿命2018-02-02 24216
-
什么是固态电池,全固态电池到底是一种什么样的技术2018-03-17 53667
-
国外发现一种新型镁电池比传统锂离子电池拥有更强的蓄电能力2019-03-19 3998
-
国外公布一种让锂离子电池获得更高能量密度的方法 可实现良好的循环性能2019-09-06 1314
-
新型镁基双离子电池成功研发,拓宽镁离子电池电极材料的选择范围2020-05-07 3903
-
镁电池领域取得了重大突破2020-12-02 10493
-
固态电池能否取代锂离子电池?2022-12-01 2569
-
固态钠离子电池与固态锂离子电池对比2023-10-21 5816
-
固态电池有无隔热层?固态电池需要散热吗?2024-05-06 7583
-
基于2D/2D纳米复合材料的高性能镁/锂离子电池协同阴极设计2024-05-23 1710
全部0条评论

快来发表一下你的评论吧 !

