

如何利用光热泵贴片实现细胞内大分子定向传递?
描述
将外源性大分子(例如糖类、蛋白质、基因等)传递到细胞和组织中近年来被用于细胞和基因治疗。目前,相关研究已经开发了各种不同的细胞内大分子传递策略,包括化学方法(如脂质体、多阳离子等)和物理机械方法(如电穿孔、光穿孔、纳米针等)。然而,目前仍缺乏一种高效、非破坏性且适用于体内/体外的通用大分子传递策略。
光热方法具有高通量、广泛的适用性、非破坏性和远程操作的优势。然而,光热方法难以实现外源性分子的定向传递,这限制了细胞内传递效率。尽管一些研究人员已经尝试通过人为挤压来实现外源性分子的定向传递,但光热介导的细胞内传递效率仍受操作时间差异的限制。因此,通过激光实现外源性分子的定向传递成为设计体内/体外通用细胞内传递策略的关键。
近期,苏州大学化学化工与材料科学学院的通讯作者陈红教授和江苏百赛飞公司的王蕾博士合作,开发了一种称为光热泵(PTP)贴片的新型技术,用于高效、非破坏性地将治疗性大分子传递到目标细胞和组织中,适用于体外和体内应用。在这种方法中,通过激光照射,细胞膜发生可逆性破裂,与此同时,"外源性分子储库"也发生收缩,从而实现了大分子的定向传递入细胞,最终达到了高效的细胞内传递。PTP贴片被认为是一种通用结构,可用于实现高效、非破坏性的体外/体内细胞内大分子传递。在体内经皮细胞内传递实验中,研究团队证明了这一技术的有效性。通过使用PTP贴片和由表皮细胞产生的外泌体,目标基因被高效地且无创地传递到表皮细胞和真皮细胞中。相关论文以“Universal Strategy of Efficient Intracellular Macromolecule Directional Delivery Using Photothermal Pump Patch”为题,发表在Advanced Materials期刊上。第一作者是苏州大学化学化工与材料科学学院的Heming Tang博士。
PTP贴片原理
基于热膨胀和收缩的响应特性,研究人员提出了一种称为光热泵(PTP)贴片的新技术,通过激光驱动外源性分子的定向传递,并将其应用于体内/体外细胞内大分子传递。研究人员设计了带有许多“外源性分子储库”的PTP贴片。在激光照射下,贴片中的光热材料引发局部细胞膜破裂,同时扩张聚二甲基硅氧烷(PDMS)以驱动孔径收缩,为外源性分子传递提供了瞬时的定向驱动力,从而实现了高效的大分子传递(图1A)。在体内经皮基因传递中,PTP贴片可以将质粒脱氧核糖核酸(pDNA)高效地传递到表皮细胞,然后通过由表皮细胞产生的外泌体,将目标基因传递给真皮细胞(图1B)。
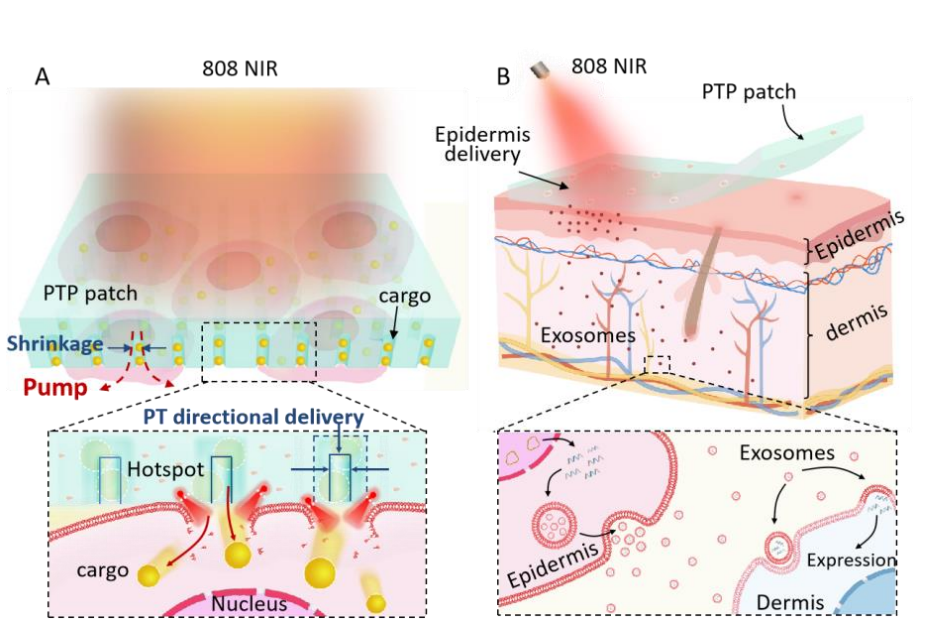
图1 细胞内大分子定向传递的体外/体内原理示意图,通过光热泵贴片(PTP贴片)实现
PTP贴片的光热效应
为了满足激光在体内/体外使用的安全标准(ANSI Z136.1-2014),研究人员设计了一种新的策略,通过将金纳米棒用聚多巴胺壳包裹(GNR@PDA)来制备光热材料。这些材料在透明的聚二甲基硅氧烷(PDMS)中均匀分布,使其保持优良的透明度和光热特性。通过激光的光热效应,PTP贴片中的PDMS材料发生微小的热膨胀,导致孔径尺寸减小,从而引发细胞膜的破裂和外源性分子的定向传递。这使得PTP贴片成为一种高效、非破坏性、高适用性的细胞内大分子传递方法。
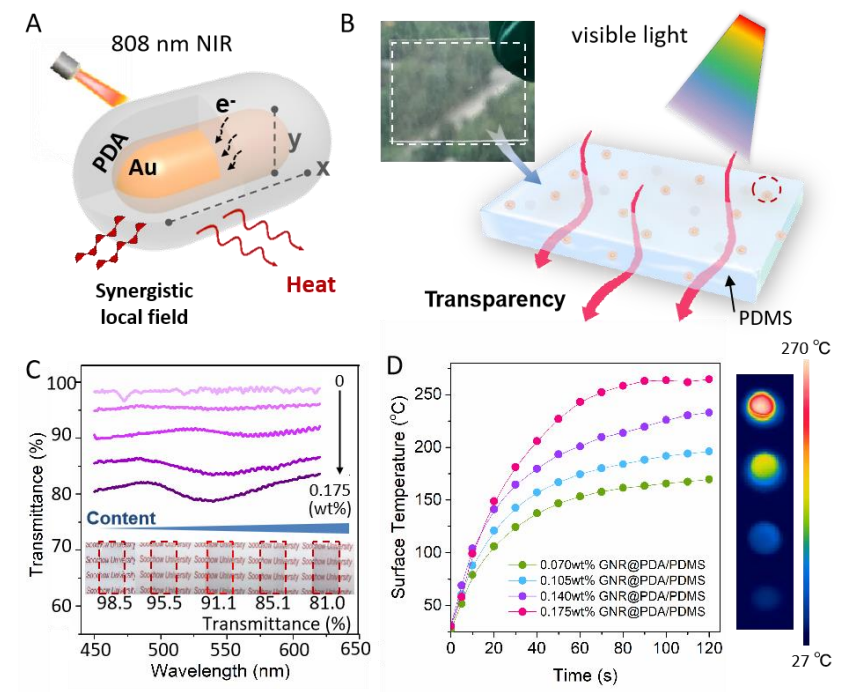
图2 (A、B)具有良好光热特性的透明光热材料示意图;(C)通过掺杂不同含量的GNR@PDA将PDMS制备的光热材料的可见光透过率;(D)以2.89 W/cm²的功率密度制备的掺杂不同含量GNR@PDA的PDMS光热材料的光热曲线
PTP贴片高效实现细胞内传递
在该研究中,研究人员通过微细图案表面设计,创造了能够与细胞膜、光热材料和外源性分子直接接触的环境。实验证明,PTP贴片能够有效地将外源性分子(如荧光染料、蛋白质和基因等)传递到细胞内,实现高效的细胞内传递。此外,研究人员还证明了PTP贴片在体内的应用潜力,可以通过皮肤转导的方式将基因传递到皮肤细胞中,同时证明了贴片的生物应用安全性。
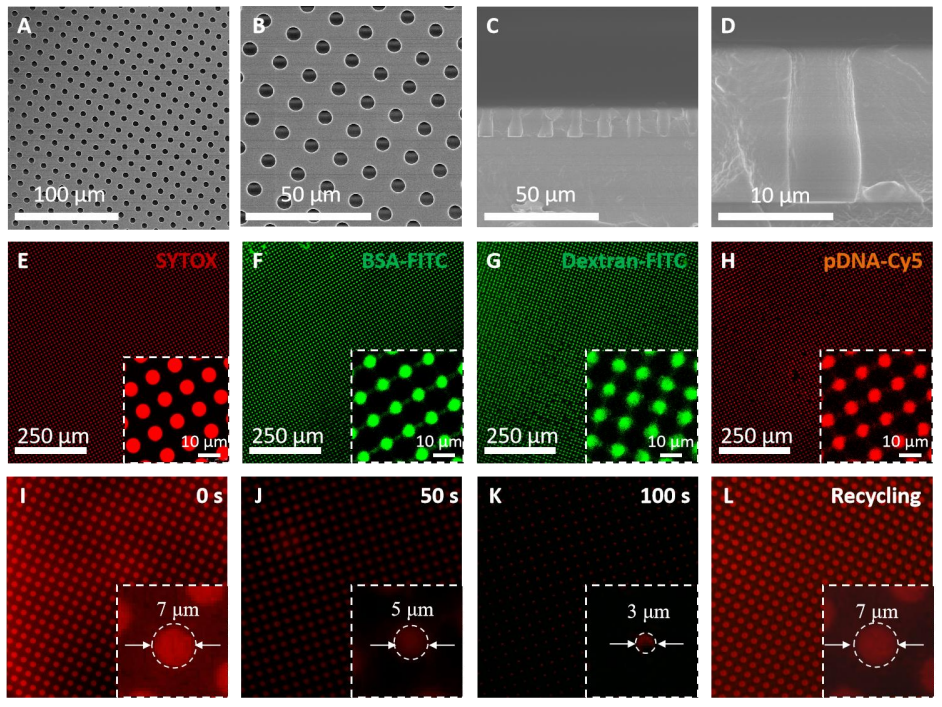
图3 (A-D)设计的图案表面的扫描电子显微镜图像;(E-H)不同外源性分子加载在表面上的共聚焦荧光图像,包括SYTOX(红色),异硫氰酸荧光素标记的牛血清白蛋白(FITC-BSA,绿色),荧光素标记的葡聚糖(绿色)和Cy5标记的质粒DNA(红色);(I-L)PTP贴片中外源性分子的光热驱动传递过程。随着照射时间的增加,孔径尺寸和荧光强度逐渐减小
综上所述,这项研究提出了一种新颖的光热泵贴片技术,用于实现高效、非破坏性的体内/体外细胞内大分子传递。研究人员指出,PTP贴片为治疗皮下毛囊、血管、神经以及皮下肿瘤等提供了新的可能性。此外,研究人员还展示了PTP贴片在转导免疫检查点阻滞治疗药物等方面的潜在应用,为治疗皮肤疾病提供了广阔的平台。
审核编辑:刘清
-
晶泰科技与优时比达成大分子药物AI平台合作2025-01-14 1123
-
如何利用工程改造的生物纳米孔实现混合体系中糖分子的结构鉴定呢?2023-09-05 1137
-
荧光RNA传感器用于检测人体细胞内靶标展现药物筛选的潜力2023-07-28 1066
-
基于电沉积法制备的纳米微针实现药物在原代细胞内的有效递送2023-04-18 2335
-
光热测厚技术助力法国标致雪铁龙无底漆涂装方案2022-12-14 1117
-
一种利用可快速溶解的微针实现无痛注射的方法2022-03-25 2740
-
浙大分子影像领域国家自然科学基金重点项目启动2021-01-04 2202
-
太赫兹光谱在生物大分子研究中的应用详细说明2020-12-02 1064
-
太赫兹(THz)光谱在生物大分子研究中有何应用?2019-05-29 2892
-
历经五年“锤炼”出纳级探针,可刺入单个细胞内了解分子运行情况2018-11-07 5853
-
单细胞内活性物质的准确检测对揭示其在生命活动中的重要作用2018-10-27 4332
-
分子细胞学技术2010-05-12 881
-
有序介孔分子筛的生物大分子固定化研究2009-10-26 717
全部0条评论

快来发表一下你的评论吧 !

