

用于促进生物膜清除和糖尿病伤口愈合的多酶级联双层微针反应系统
描述
生物膜的存在仍然是慢性伤口愈合的重要障碍,包括糖尿病伤口。生物膜的胞外聚合物(EPS)屏障致密,导致药物渗透性差,使生物膜的清除成为一项具有挑战性的任务。此外,高葡萄糖水平会阻碍伤口愈合的过程。
近日,西北大学范代娣教授团队首次将酶生物膜破坏与基于氧化石墨烯的化学动力学治疗(CDT)相结合,开发了一种多酶级联微针(MN)系统。微针尖快速溶解,并将α-淀粉酶和葡萄糖氧化酶负载的金属有机框架MIL-101 (M@G)输送到生物膜内部。α-淀粉酶分解EPS结构,使细菌变得脆弱,并产生葡萄糖作为下一个级联反应的底物。
接下来,Gox利用EPS降解产生的葡萄糖,在伤口部位产生大量的H₂O₂,然后通过MIL-101转化为活性氧(ROS)。该系统通过顺序破坏EPS,在伤口处消耗葡萄糖,并自供H₂O₂产生ROS来清除耐甲氧西林金黄色葡萄球菌(MRSA)生物膜,从而降低葡萄糖浓度,同时减少细菌感染和炎症反应。
此外,促血管生成肽功能化水凝胶(Gel-Q-M)作为支持促进胶原沉积和血管生成,从而加速慢性伤口愈合。因此,构建的微针平台在体外具有良好的抗生物膜和血管生成性能,可以有效清除生物膜,减少炎症,促进糖尿病伤口愈合。相关论文以“Amulti-enzyme cascade microneedle reaction system for hierarchically MRSAbiofilm elimination and diabetic wound healing”为题发表在ChemicalEngineering Journal期刊上。
考虑到糖尿病伤口中的血管阻塞和肉芽组织再生,该研究使用接枝有促血管生成肽QHREDGS的明胶水凝胶作为微针的背衬层。在伤口愈合阶段释放多肽可促进血管新生以及胶原沉积。总之,双层微针设计考虑了伤口愈合的不同阶段,通过分级破坏EPS,降低伤口处的葡萄糖浓度,自我供应H₂O₂以产生ROS,并释放肽以促进血管生成,提供了解决生物膜感染和慢性伤口愈合的有前景的战略平台(图1)。
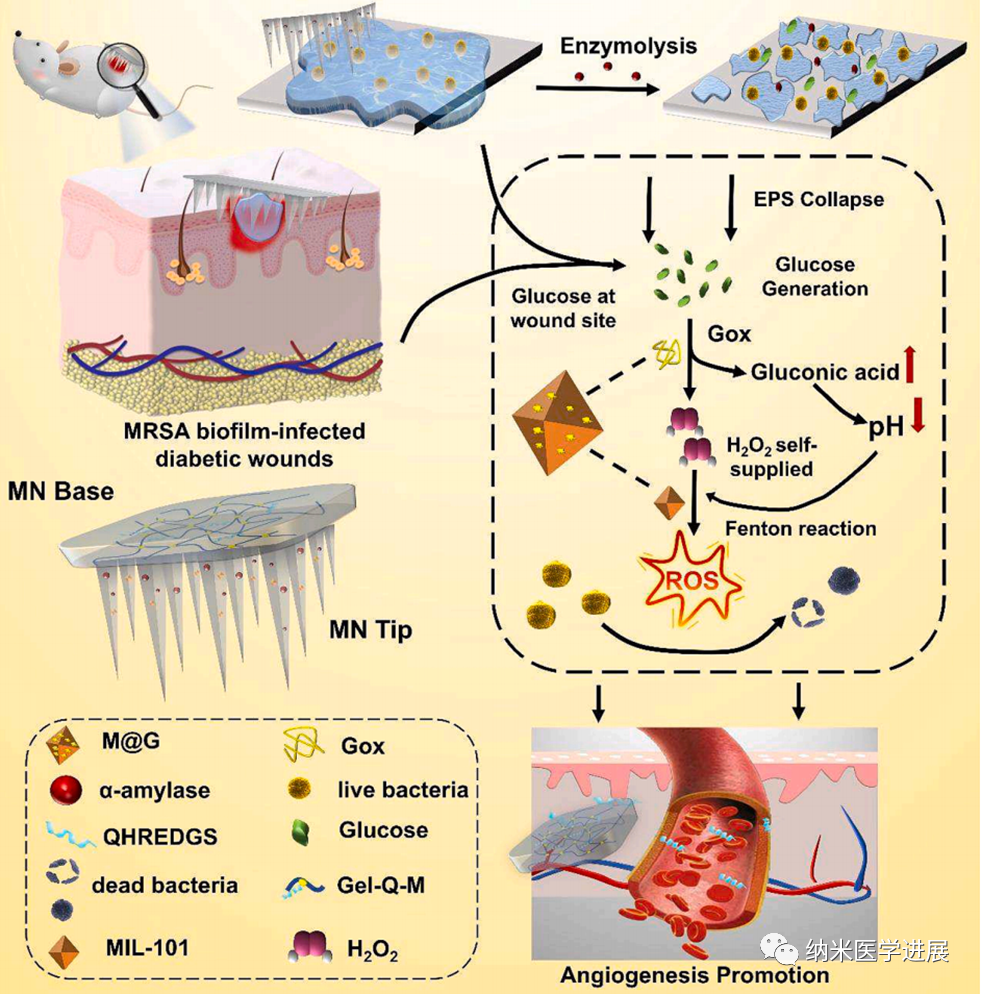
图1 多酶级联双层微针贴片清除MRSA生物膜,并促进糖尿病伤口愈合的示意图
随后,研究人员利用TEM、SEM、Zeta和XPS等多种方法对MIL-101和M@G表征进行了系统性地分析。
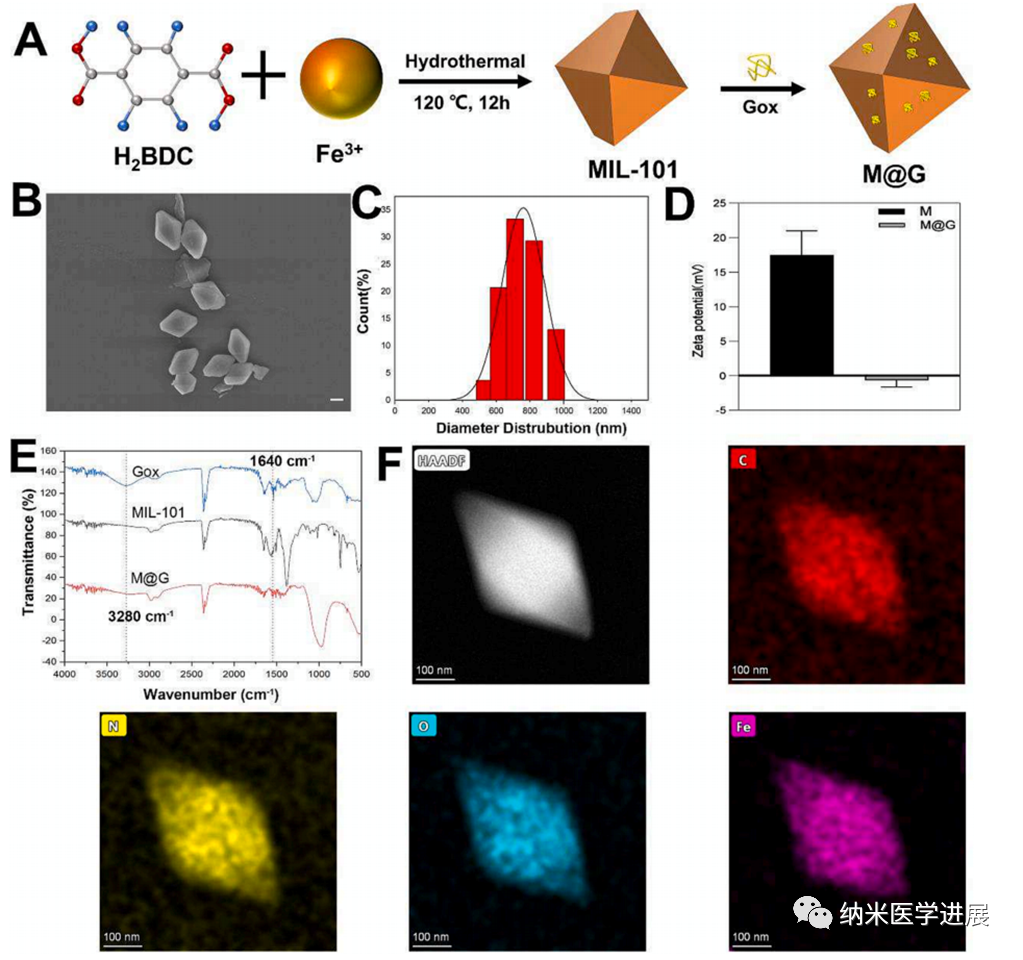
图2 材料的表征
此外,研究人员对合成的MIL-101的芬顿活性进行了验证。用TMB比色法检测不同条件下羟基自由基的产生。无色的TMB可被羟基自由基氧化成蓝色,在652 nm处显示出清晰的吸收峰。如图3D,在不存在H₂O₂的情况下,羟基自由基的产生几乎检测不到。加入H₂O₂后,在酸性溶液中羟基自由基的产生量远高于中性溶液,表明合成的MIL-101具有优异的芬顿活性,酸性条件能显著增强活性氧的产生。在负载Gox之后,评估在葡萄糖存在下M@G的级联催化效应。如图在相同浓度的M@G下,随着葡萄糖浓度的增加,·OH在652 nm处的吸收峰显著增大。
接下来,研究人员使用实时pH计、TMB法和ESR测量验证了级联反应过程中pH的变化和H₂O₂和·OH的形成。如图3F,溶液的pH在12小时内从5.8继续降低至4.2。此外,随着反应的进行,中间体H₂O₂的产生逐渐增加(图3G)。同时,M@G的浓度越高,葡萄糖消耗越多(图3H),产生的H₂O₂越多。结果表明,葡萄糖可以连续氧化生成葡萄糖酸和H₂O₂,pH的降低和过氧化氢的产生也为MIL-101催化芬顿反应提供了适宜的酸性环境和底物。其次,以5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)为捕集剂,用ESR方法验证了反应体系中·OH的生成。如图3I所示,·OH的典型的1:2:2:1特征峰谱,峰强度随葡萄糖浓度的增加而扩大,表明级联反应成功地产生了羟基自由基。上述结果表明,所构建的M@G纳米粒子可以通过自身供给的H₂O₂和葡萄糖诱导的级联催化反应产生羟基自由基。
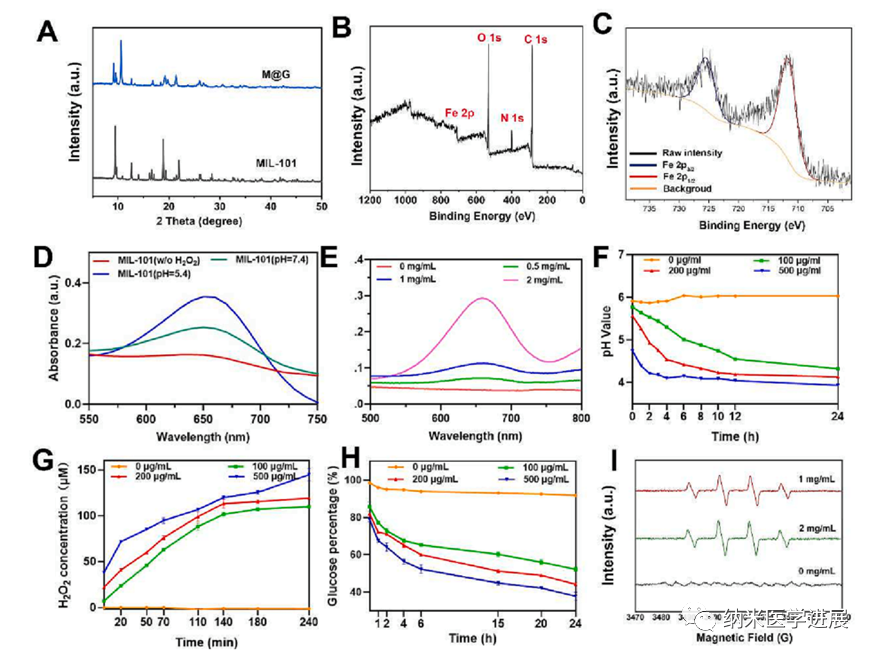
图3 MIL-101与M@G的催化活性表征
整个双层微针贴片(WMN)由10 × 10的针尖阵列组成,并且背衬是直径为1 cm的圆形。SEM图像显示尖端是均匀的和金字塔形的(高度约700 µm,基部直径约300 µm,针间距约300 µm)。为了验证该微针贴片的机械性能,将含有罗丹明B染料的微针应用于离体新鲜大鼠皮肤。插入后3分钟移除背衬部分显示出清晰的红点阵列(图4F)和相应的皮肤H&E染色。图4G还显示出了针尖的形状,证明针尖成功地插入皮肤中。压缩试验进一步用于测量微针的机械强度,在200 μm位移下,纳米颗粒加载微针的机械强度略高于未加载微针,这与文献报道的一致。机械力为0.39 N/针,其足以穿透皮肤和生物膜(图4H)。使用琼脂糖模拟皮肤研究微针贴片的溶解。如图4I,微针尖端在三分钟内逐渐溶解以快速释放抗菌剂和抗生物膜剂。
从3 min~ 5 min,Fe³⁺的累积释放逐渐达到一个平台,表明大部分负载M@G已被释放,且少量增加可能是由于M@G位于尖端与背部界面连接处。为了观察药物的分布,以FITC标记的Gel-Q-M为背衬,罗丹明B为模型药物在针尖处,图中的荧光图像。4J显示红色荧光富集在尖端部位,而背衬显示绿色荧光,表明两种染料的均匀分布。此外,值得注意的是,背衬层的UV照射时间的选择直接影响水凝胶的交联程度,并因此影响肽的释放。因此,肽从FITC标记的Gel-Q-M微针贴片的释放通过测量在不同UV照射时间下的荧光强度来表征。增加的交联时间延长了肽释放时间(图4K)。
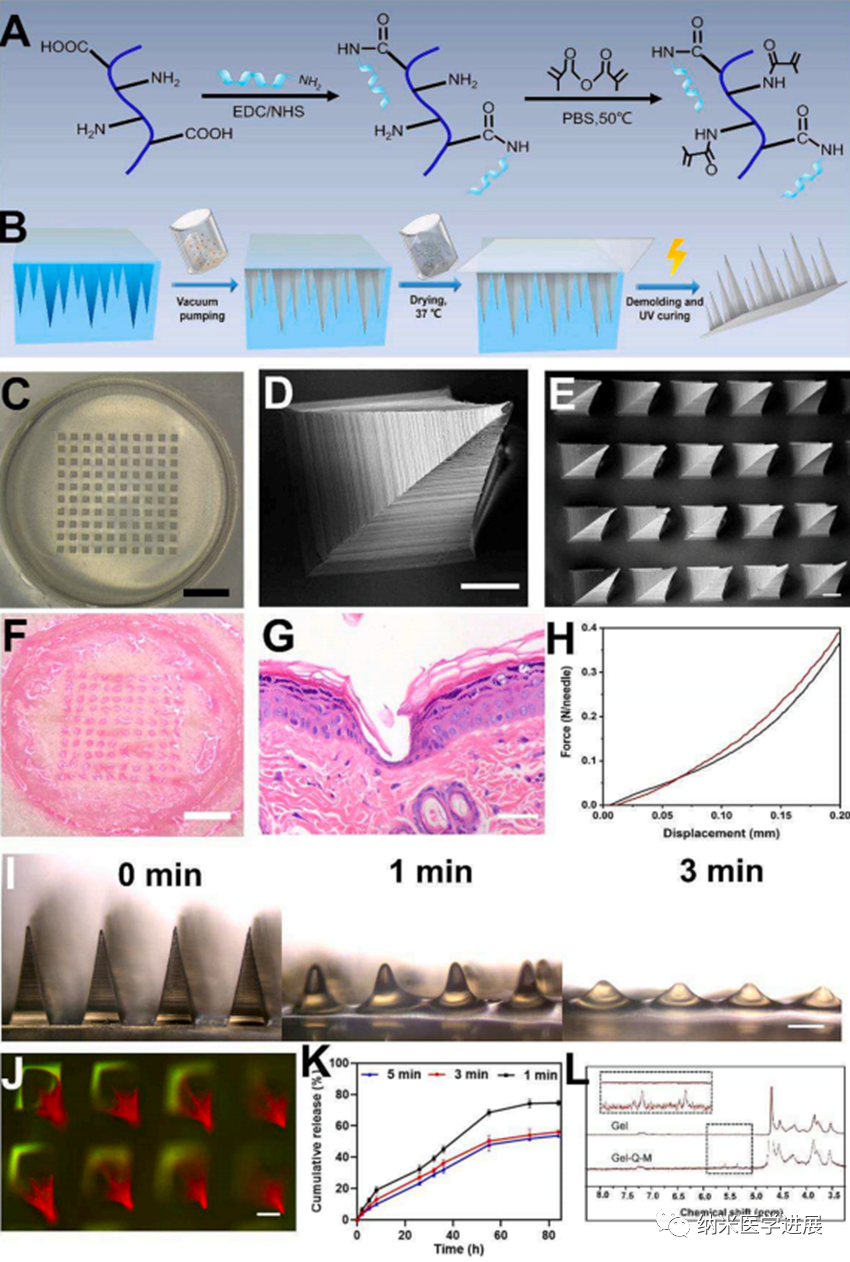
图4 微针的制备与表征 鉴于M@G的优异级联催化作用和产生羟基自由基的能力,研究人员接下来验证了微针贴片的体外抗菌能力。图5和图6展示出了强大的抗菌能力和细菌生物膜清除能力。此外,细胞实验(图7)表明M@G也被证明具有优异的生物相容性和促进血管生成能力。
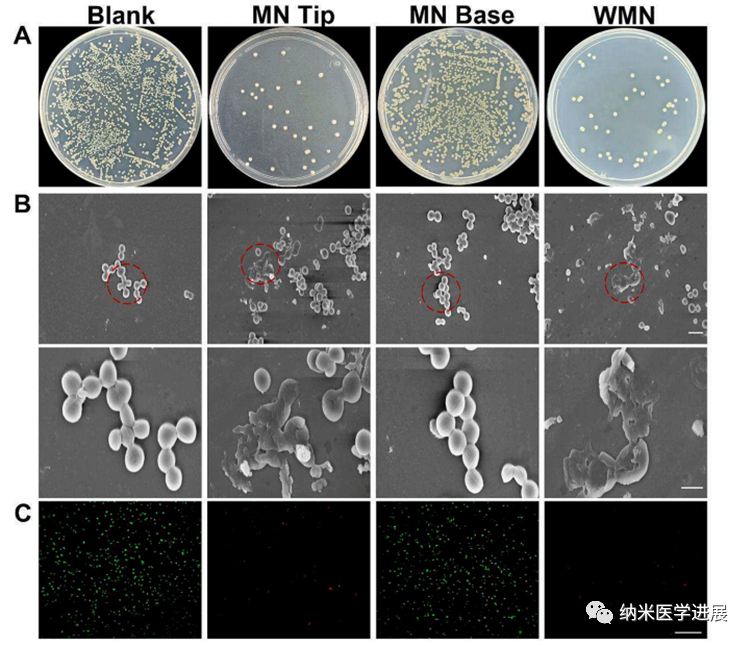
图5 体外抗菌性能
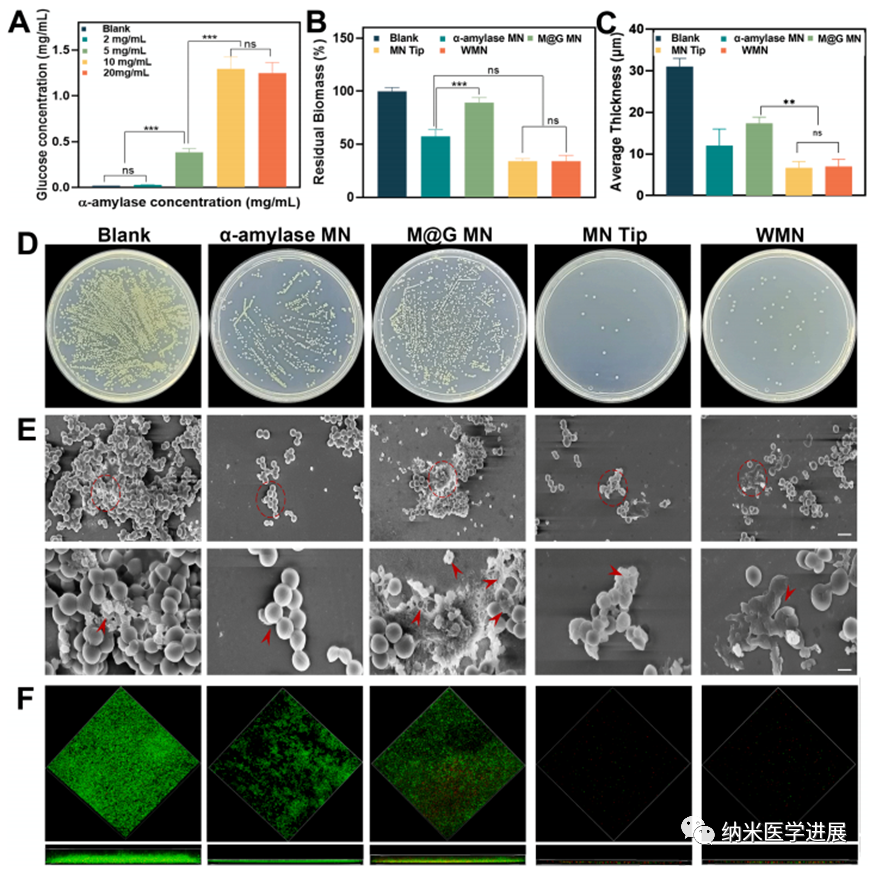
图6 微针体外生物膜清除能力
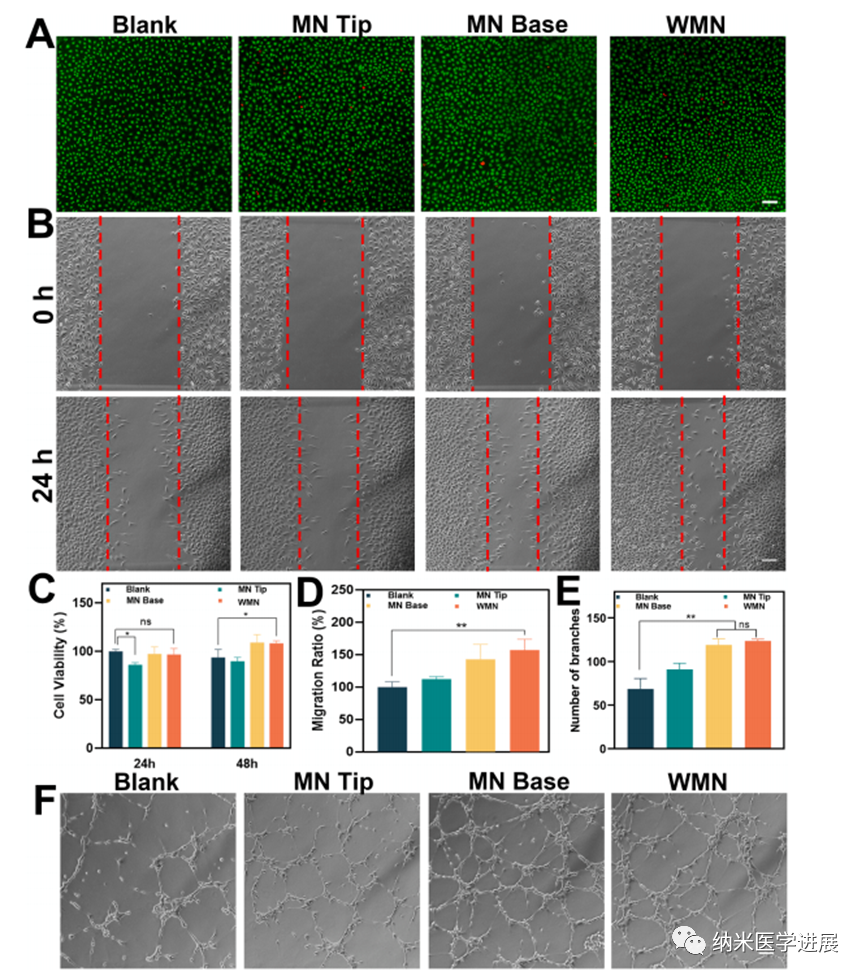
图7 微针体外生物相容性及促血管生成能力的评价
接下来,研究人员通过在I型糖尿病大鼠的皮肤上构建MRSA生物膜模型来评估微针贴片的体内抗生物膜和伤口愈合能力(图8)。在治疗后第9天,双层微针组的伤口面积显著小于其他三组,并且伤口在第12天基本上完全闭合,这证明双层微针贴片在促进生物膜感染糖尿病伤口的伤口愈合中是有效的,这归因于尖端的抗生物膜的协同作用和背衬层的血管生成作用。此外,多酶级联降低了伤口部位的葡萄糖浓度,这也可能有助于加速伤口愈合。
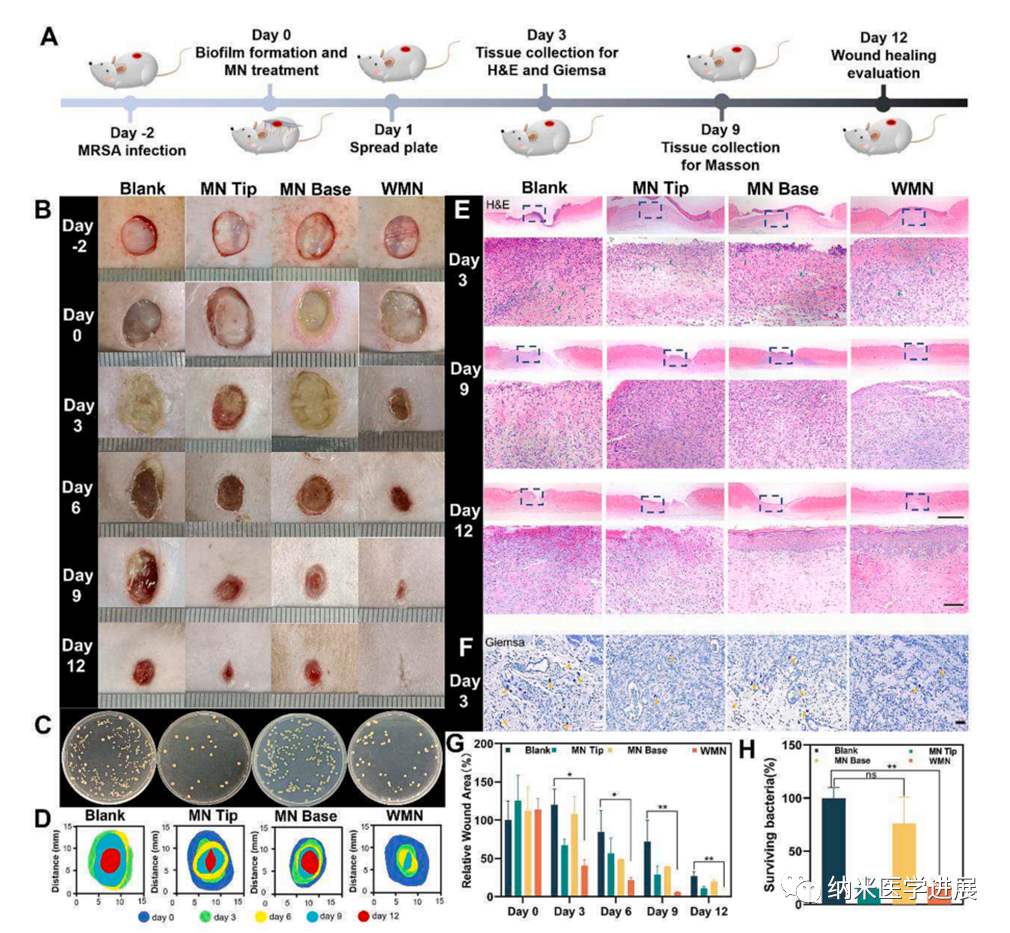
图8 微针体外生物相容性及促血管生成能力的评价
综上所述,该研究将酶促生物膜破坏与Gox偶联CDT结合构建了微针系统,用于清除MRSA生物膜,促进糖尿病伤口血管生成,加速伤口愈合。微针的尖端穿透生物膜,将负载转移到内部。释放的α-淀粉酶为后续酶促反应提供葡萄糖底物,同时降解EPS。
随后,存在于伤口中的α-淀粉酶生成的葡萄糖被M@G的Gox氧化生成大量的H₂O₂,在M@G的芬顿作用下产生高毒性OH,清除生物膜。该系统可以产生自供的H₂O₂,而不需要添加外源H₂O₂。这不仅破坏了生物膜结构,而且为级联反应提供了底物,在产生H₂O₂的同时降低了伤口中糖尿病的浓度,一举两得。此外,从背衬层逐渐释放的促血管生成肽平衡了伤口愈合的组织重塑阶段。通过将多种功能集成到微针贴片中,可以显著改善生物膜感染糖尿病伤口的治疗。
审核编辑:刘清
-
ML之Sklearn:利用八种ML算法对根据糖尿病数据集预测新个体是否患糖尿病2018-12-20 4050
-
rFGF212—2型糖尿病的新治疗靶点2019-09-25 1847
-
生物酶膜反应器实时监控系统2009-07-08 698
-
智能创可贴:内置处理器,可以追踪伤口的愈合情况检查是否感染和发炎2018-08-12 2828
-
物联网IoT装置如何帮助人们管控糖尿病2018-12-23 2006
-
糖尿病机器学习算法获得临床测试2020-04-25 2486
-
集成糖尿病管理系统解析2020-07-03 1215
-
医疗手机应用程序也能检测糖尿病2020-07-09 1152
-
Apple Watch 就能预测糖尿病2020-07-13 1943
-
双层可分离式微针技术用于慢性伤口的程序化治疗2022-07-13 2753
-
基于透明质酸微针的胰岛素智能给药系统,用于糖尿病治疗2023-06-02 2825
-
如何利用科技发展治愈糖尿病2023-07-03 1144
-
用于糖尿病创面的防疤痕愈合的自供电酶联微针贴片2023-07-30 3395
-
用于生物膜感染糖尿病伤口愈合的防治一体化纳米酶微针2023-08-17 3209
-
生物膜的电路中time常数的计算方法2024-07-15 1493
全部0条评论

快来发表一下你的评论吧 !

