

可穿戴无创葡萄糖传感器最新应用进展(综述)
电子说
描述
当前,华为、苹果等全球企业和机构,在开发新型可穿戴电化学传感器上投入了大量的精力,该类型传感器不同于传统的有创监测,可以无创持续监测体液中的生物标志物,在疾病预防、诊断和管理上有重大的应用前景。在糖尿病患者人数日益增多的趋势下,无创持续监测葡萄糖浓度在糖尿病管理中显得尤为重要。 综述近几年可穿戴式无创葡萄糖传感器的发展及其在糖尿病管理中的应用,并简要介绍几种检测不同体液(汗液、泪液、唾液)的电化学葡萄糖传感器的发展和原理。阐述可穿戴传感器在糖尿病管理上的优势以及在研究开发过程中所面临的挑战,最后展望了可穿戴式无创葡萄糖传感器的发展前景及其商业化的趋势和在未来市场中的潜力。
来源:IVD分享库
※
引言
糖尿病是以血液中葡萄糖浓度升高为特征的疾病。世界卫生组织指出,糖尿病影响着全世界数十亿患者的健康,患者如果得不到及时治疗,会导致严重的并发症,如肾衰竭、失明、中风等。糖尿病的根治仍为当前医疗的难题,而持续监测病人的葡萄糖浓度是了解糖尿病进展的重要手段。在众多体液中,血液最常被用于葡萄糖监测。因此,大多数葡萄糖检测仪通过采血来实现血糖监测。该方法多为有创检测,其局限性在于反复采血过程中引起的疼痛感以及存在感染风险。
近10年来,为实现严格监测葡萄糖浓度的目的,葡萄糖传感器领域涌现出众多优异的科研成果。文中首先介绍电化学葡萄糖传感器的工作原理,随后对可穿戴无创葡萄糖传感器的研究进展及发展趋势进行总结。
01
葡萄糖传感器的工作原理
目前葡萄糖传感器主要为电化学传感器,其中可以根据是否使用葡萄糖氧化酶分为酶传感器和无酶传感器。除电化学传感器外,还可以通过无线电波(微波频段)的方式,对葡萄糖进行检测。
1、葡萄糖酶传感器
1962年,Clark和Lyons发明了第一个生物传感器,他们将葡萄糖氧化酶固定在氧电极表面的半透渗析膜上,实现了葡萄糖监测。
由于能够承受不同温度和pH,葡萄糖氧化酶常被用于构建葡萄糖生物传感器。电化学酶传感器用于葡萄糖监测的酶常为葡萄糖氧化酶。根据检测过程中传感器的电荷传递机理不同,可分为三代,分别为经典葡萄糖酶电极、媒介葡萄糖酶电极以及直接葡萄糖酶电极,其工作原理如图1和图2所示。
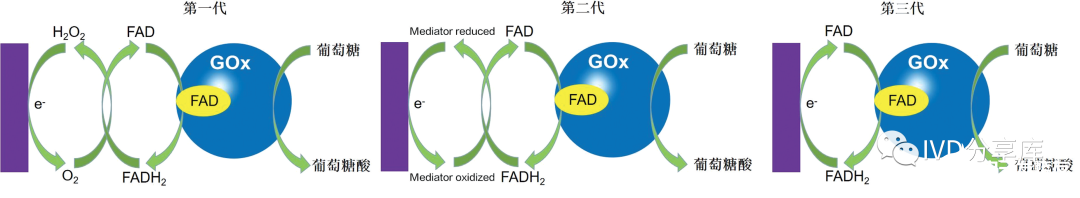
图1、电化学酶传感器的工作原理
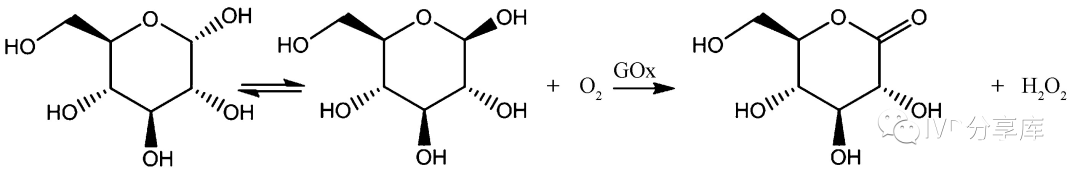
图2、以葡萄糖氧化酶为催化剂进行葡萄糖氧化反应
经典葡萄糖酶电极:在葡萄糖氧化酶存在的条件下,葡萄糖和氧气反应生成葡萄糖酸和过氧化氢,葡萄糖的浓度与过氧化氢或者氧气的浓度成线性关系,因此通过电化学的方法监测过氧化氢或氧气的浓度就可以实现葡萄糖浓度的检测。一般而言,葡萄糖氧化酶不具备与电极表面直接电子传递的能力。主要由于葡萄糖氧化酶上的黄素腺嘌呤二核苷酸活性位点与电极之间存在空间位阻效应。因此,葡萄糖氧化酶需要氧化还原电子对来实现与电极表面的电子传递,这是一种氧气依赖,即该电极在氧气不足时无法实现对高浓度葡萄糖的测定,而且过高浓度的过氧化氢也会导致葡萄糖氧化酶失活。另外共存的电化学活性物质如对乙酰氨基酚,抗坏血酸以及尿酸等都会影响到该葡萄糖生物传感器的检测。这主要是由于过氧化氢检测过程中所需要的高电位造成的。目前有两种策略应对这一问题,一种是结合具有电催化活性的物质(如普鲁士蓝或者贵金属等)来降低过氧化氢的氧化还原电位;另一种策略是在电极表面修饰抗干扰的半透膜来抵抗干扰物质的影响。
媒介葡萄糖酶传感器:由于在第一代葡萄糖生物传感器中存在氧气依赖和电化学活性物质干扰的问题,在第二代葡萄糖生物传感器中,科研人员尝试寻找替代底物。因此,氧气被电子受体所取代,电子受体可以加速酶的氧化还原活性位点与电极之间的电子传递,并且在低电压的条件下,具有快速的电极动力学响应和良好的可逆性。然而,由此带来的电极潜在的毒性和相关的不稳定性阻碍了其在体内的应用。常用的媒介有:铁氰化物、聚合物、酚类、导电有机盐类和二茂铁及其衍生物等。媒介存在的方式有两种,一种是溶解在检测溶液中,另一种是固定在生物敏感膜内,前者不利于商品化,而后者成为一种趋势。
直接葡萄糖酶传感器:在无媒介存在下,通过在酶与电极之间可直接电子传递的葡萄糖传感器,将酶共价键合到化学修饰电极上,或将酶固定到多孔电聚合物修饰电极上,使酶氧化还原活性中心与电极接近,直接电子传递就能够相对容易地进行,从而使电极的响应速度更快、灵敏度更高。通常采用的固定化酶材料为有机导电聚合物膜、有机导电复合材料膜、金属纳米颗粒或金属和非金属纳米颗粒等。
除了常用的葡萄糖氧化酶外,葡萄糖脱氢酶也常用于葡萄糖监测。基于葡萄糖脱氢酶的葡萄糖传感器:葡萄糖脱氢酶是用于葡萄糖分析的另一类酶。葡萄糖脱氢酶根据辅酶进行分类,主要有黄素腺嘌呤二核苷酸,吡咯并喹啉醌,烟酰胺腺嘌呤二核苷酸等。虽然葡萄糖脱氢酶不受到氧气的影响,但是黄素腺嘌呤二核苷酸-葡萄糖脱氢酶和吡咯并喹啉醌-葡萄糖脱氢酶的选择性都低于葡萄糖氧化酶,都会受到麦芽糖、乳糖、半乳糖的影响而产生测量值偏高的现象。
2、无酶传感器
电化学无酶传感器:因为酶葡萄糖传感器受限制于pH范围、温度和湿度等条件,所以研究无酶电化学葡萄糖传感器显得尤为重要。目前无酶葡萄糖传感器的研究较多,其传感材料通常是金属纳米材料与导电支撑材料相结合。目前用于制备电化学无酶葡萄糖传感器的材料主要有金属、合金、金属氧化物、导电聚合物、碳纳米管、石墨烯和分子印迹聚合物等。
基于常规材料构建的无酶葡萄糖电化学传感器:铂和金是无酶葡萄糖电化学传感器中最早使用的电极材料,但检测灵敏度较低。Mastsumoto等在汞砷化镓修饰的金电极上观察到葡萄糖的两个氧化峰,且氧化峰电流远大于裸金电极。过渡金属铜和镍也被用于葡萄糖电化学传感器电极的研制,Salimi等通过Nafion将镍粉修饰到碳陶瓷电极表面,在低电位条件下,表现出对于葡萄糖良好的催化氧化活性。与单质铜电极非酶葡萄糖传感器相比,利用氧化铜、氧化亚铜材料修饰的玻碳电极检测葡萄糖时, 传感器也具有更高的灵敏度。
基于纳米材料构建的无酶葡萄糖电化学传感器:近年来,随着材料制备技术的发展,各种铂及金的纳米多孔结构、铂纳米管阵列、金及铂纳米颗粒、碳纳米管、铜及镍纳米颗粒等都被用于无酶葡萄糖电化学传感器的设计与构建。Lv等通过水热法和煅烧结合的方法制备出具有中空纳米笼结构的材料,用于葡萄糖监测,研究结果表明磷化钴纳米笼对葡萄糖具有优异的电催化活性。该传感器具有宽的线性范围、低的检测限。Liu等通过阳极氧化法在钛片上制备二氧化钛纳米管阵列,并以此为基底制备镍纳米颗粒, 该传感器对葡萄糖的线性检测范围为11~4986μM。
3、无线电波测量葡萄糖
该方法的基本原理是谐振器谐振频率与葡萄糖浓度近似成线性关系,通过对葡萄糖溶液和血液的复介电常数与葡萄糖浓度、频率之间的关系进行分析可得,较高的工作频率可使传感器对葡萄糖浓度的变化更加敏感。如2018年公布的产品GlucoWise就运用了该原理。GlucoWise通过拇指和食指之间的区域或耳垂,传输65GHz范围内的高频无线电波,这些区域有足够的血液供应,而且相对较薄,能使波可以穿过组织。GlucoWise设备另一侧的传感器接收到这些信号,并收集和分析血液特征的数据。
02
可穿戴无创葡萄糖传感器的类型
因为皮肤覆盖了人体的大部分,皮肤装置在各种可穿戴生物传感器中受到最多的关注,表皮生物传感器可以通过采集体液,实时分析表皮生物体液中的生物标记物,达到连续监测的目的。该平台能够随时采集表皮上的生物体液,且不会使穿戴者感到不适。
可穿戴无创葡萄糖传感器基于对不同类型生物体液进行采集分析,主要可以分为以下四种类型:用于检测组织液、汗液、泪液、唾液的葡萄糖传感器。
1、检测组织液的葡萄糖传感器
第一台由美国食品药品监督管理局批准的无创葡萄糖检测设备是一款被称为葡萄糖检测手表的产品。该葡萄糖检测手表是一种腕表式的结构,通过电化学检测的原理来测量经过反离子导入方法提取的组织液中的葡萄糖浓度。
除血液外,无论是在准确性上还是在速度上,组织液是获取葡萄糖浓度的最佳来源。组织液分布在皮肤细胞的周围,通过毛细血管内皮的直接扩散为皮肤细胞提供营养。这也使得血液和组织液中葡萄糖浓度存在着可靠的相关关系。供给ISF的毛细血管直径只有5-10μm。高表面积与体积比、高毛细血管密度、低流量、血压都有助于简化血液和ISF之间的流体和分析物交换,因此许多分析物在血液和组织液之间的浓度几乎相等。
反离子导入法主要是通过在皮肤上施加缓和的电流来实现皮肤与电极之间离子的迁移。皮肤表面带有负电荷,带有正电荷的钠离子向阴极移动,同时导致中性的葡萄糖分子也向阴极移动。葡萄糖检测手表从提取的组织液 中得到的葡萄糖的浓度大约是血液中的千分之一。因此,葡萄糖检测需要更加灵敏的检测系统。葡萄糖检测手表的临床测试结果显示该手表可以实现家庭血糖的日常监测。葡萄糖检测手表于2000年左右上市,但是出于多种原因被迫撤出市场,主要是由反离子导入引起的皮肤刺激、过长的预热时间(2-3h)以及需要校准等问题。为了实现商业化无创组织液葡萄糖传感器,目前的研究方向主要集中在如何构建可靠、有效的无创葡萄糖检测平台上。
通过反离子导入方法提取组织液中葡萄糖的方法研究较为广泛,但目前的挑战是其复杂的结构和不稳定性。2021年Yao等展示了一种简单的双电极无创血糖传感器,该传感器分别以石墨烯/碳纳米管/ 葡萄糖氧化酶复合织物和石墨烯/碳纳米管/ Ag/Agcl复合织物作为工作电极和对电极。通过反离子导入法提取组织液,首先在两电极之间加载一定的电流,然后在相同的两电极上通过安培法检测组织液中的葡萄糖浓度。该传感器的可行性在猪皮肤、裸鼠和人体上得到了验证,计算得到的血糖浓度与商业化血糖仪高度一致。
2020年Baghelani等报道了一种基于微波平面谐振器技术的零功耗、高灵敏度的无创可穿戴葡萄糖监测传感器。该传感器结构包括可贴在患者皮肤上的无芯片标签传感器和嵌入到智能手表中的阅读器。当测量组织液中葡萄糖浓度变化时,该微波传感器能在葡萄糖浓度的生理范围内较高精度检测葡萄糖。
Hakala等提出了一种基于磁流体动力学全新的组织液的提取方法。磁流体动力学是由外加磁场和电场产生的洛伦兹力引起流体流动的物理现象。使用猪皮作为体外模型,他们发现磁流体动力学相比于反离子导入提取更快,与反离子导入法相比,磁流体动力学将提取的葡萄糖总量增加2倍,活性提取量增加13倍。磁流体动力学减少了皮肤组织液毛发取样所需的能量,从而降低了在提取部位发生皮肤反应的风险。该技术可以通过探索不同的电极形状、大小和距离来进行优化,以提高使用磁流体动力学获得葡萄糖的提取效率。如果磁体移动到更靠近皮肤表面,则磁体排列的尺寸可以减小。这些小磁铁可以安装在便携式设备中,如腕带或带有葡萄糖敏感电极的运动手表中,适合应用于可穿戴设备的无创葡萄糖监测。
可穿戴的组织液葡萄糖传感器在过量出汗时的性能依然需要评估。在锻炼过程中,糖尿病患者容易出现低血糖,需要特别关注血糖浓度。这就要求组织液类型的葡萄糖传感器能够区分来自于汗液和组织液的葡萄糖信号。另外,反离子导入法的效率也不能因为过多出汗所导致的皮肤阻抗的变化而变化。这些都是葡萄糖检测手表在使用者运动过程中的不足,也是导致其退出市场的主要原因。组织液中的葡萄糖测定与血液中相比,存在延迟现象。因此,为了实现对低血糖/高血糖的有效监测,针对可穿戴的组织液葡萄糖传感器,需要重点评估其在运动出汗过程中性能,且还需要关注组织液葡萄糖浓度检测延迟的现象。
2、检测汗液的葡萄糖传感器
汗液是化学传感应用中最易获得的生物体液。汗液中含有大量代谢产物、电解质、微量元素和少量大分子。因此,汗液分析能够用于人体生理健康的无创监测,并实现疾病的诊断和有效管理。糖尿病患者体内的葡萄糖浓度比正常人高,出汗时糖尿病患者会比健康人有更多的葡萄糖随着汗液排出,因此可以通过分析汗液来监测患者体内的葡萄糖浓度。
然而,汗液葡萄糖的精确测量面临很大的挑战,如温度和pH值变化、受到其他生物标记物或旧汗液的污染、采样体积小和不可控的蒸发速率等。另外,汗液葡萄糖浓度较低(0.02~0.6mM),需要更高灵敏度的传感器。Pott等研究发现汗液葡萄糖浓度和血糖浓度具有显著的相关性,汗液中葡萄糖浓度约为血糖浓度的1%~2%,且汗液对血糖浓度存在约8min的滞后。
①电化学酶传感器
在葡萄糖酶传感器中,金通常作为非常有效的工作电极基底材料。Bhide等考虑到葡萄糖测试在现实场景中的干扰物的情况,将金-氧化锌薄膜结合到柔性衬底上,从而得到可同时检测葡萄糖和乙醇的可穿戴传感器,可以在人体汗液中可靠地检测葡萄糖浓度。该传感器有助于糖尿病患者监测他们的葡萄糖水平,并限制患者的酒精摄入。
针对传统的可金薄膜电极制备复杂且操作繁琐的问题,Wang等采用紫外介导化学镀膜技术制备的薄膜金电极葡萄糖传感器结构简单、成本低,同时表现出良好的长期稳定性和可重复性。可穿戴葡萄糖传感器制备过程中,如何保持酶的稳定性以及传感器整体的机械性能也很重要,Lin等合成了一种用于有效固定葡萄糖氧化酶的多孔膜结构用于葡萄糖在线检测。该传感器可以实现20h无信号漂移的连续检测,且可以和相应的微流控传感贴片结合。
在提高葡萄糖检测灵敏度方面,Yu等利用金纳米针结构作为信号放大策略,采用电化学沉积法将纳米金针沉积在工作电极表面制造了一种实时监测汗液中葡萄糖和乳酸浓度的传感器。酶的固定通过交联剂聚乙二醇聚缩水甘油醚在电极表面进行,能够比戊二醛更有效地保持酶的活性。在电极上的沉积增加了比表面积,固定更多酶,从而提高了检测灵敏度。
考虑到高性能光纤型可穿戴传感器的开发对下一代智能纺织品的实时和临床外健康监测具有重要意义。Zhao等报道了一种基于弹性金纤维的三电极电化学平台,该纤维具有高电导率、能固定活性酶等特性,达到了可穿戴纺织葡萄糖生物传感的标准。即使在大应变下,传感性能也可以保持。
为了解决传感器的可拉伸问题,Zhai等在弹性基底上生长蘑菇状的金纳米结构,制备了具有伸缩性的电极,该传感器能够在各种机械变形下保持较高的传感性能。并且在对人工汗液的葡萄糖检测中能达到较好的灵敏度。
除了金以外,碳也常作为电极材料运用在葡萄糖酶传感器中。Yoon等开发了一种基于乙酸处理的激光诱导石墨烯电化学葡萄糖传感器。该处理显著地增加了碳-碳键的比率,有效地增加了导电性。另外,还促进了高催化活性铂纳米粒子的稳定和均匀分散,该汗液葡萄糖传感器能准确显示餐前餐后血糖水平的变化。Xia等构造了一种由碳纳米管-乙烯-乙酸乙烯酯共聚物薄膜复合而成的柔性多孔电极。由于其良好的三维导电纳米孔结构,该电极成功实现了无媒介条件下的直接电子转移。制备的传感器对葡萄糖具有优异的选择性和超高灵敏度。
针对汗液对温度和pH值的影响,Wiorek等将葡萄糖生物传感器与pH以及温度传感器集成在一个柔性微流控系统中,通过实时检测汗液的温度以及pH值的方式来实现对于汗液中葡萄糖浓度的校正,该传感器在运动的过程中依然可以得到可靠的葡萄糖浓度。
除了使用金、碳电极外,还有一些聚合物也常用于电极材料中。Karpova等将普鲁士蓝和葡萄糖氧化酶固定在全氟磺酸化的离子交联聚合物或烷氧硅烷凝胶中,制作了一种流动式的葡萄糖生物传感器,在未稀释的汗液情况下立即对其进行连续分析,从而实时无延迟的监测葡萄糖浓度。
针对汗液积累导致传感器性能降低的问题,Cao等提出了一种三维纸质的微流控电化学集成装置(3D-PMED)来实时监测汗液代谢物。该传感器通过将聚邻苯二甲酸乙二醇酯基底上的丝网印刷葡萄糖传感器与制造的3D-PMED集成得到。用红墨水模拟了3D-PMED中的汗流过程,证明其收集、分析和蒸发汗液的能力。通过人体实验,验证了三维汗液监测装置的实用性。
②电化学非酶传感器
非酶葡萄糖传感器也在迅速发展。针对一些特殊人群存在监测血糖较为困难的问题。Han等采用多电位分步沉积法在微电极表面制备了具有高密度珊瑚状铂-聚乳酸纳米颗粒,实现汗液中葡萄糖原位无创检测。因为铂纳米颗粒和聚乳酸之间的协同效应,该生物传感器表现出很高的电催化活性。
非酶传感器也存在制造技术的问题。Katseli等通过3D打印制备了可穿戴电化学环用于葡萄糖监测。该环由3个碳基塑料电极组成,集成在环形柔性塑料支架的内侧。工作电极通过电沉积金膜修饰,实现了人体汗液中葡萄糖浓度的检测。
Ma等用电沉积法在玻碳电极上合成了金纳米粒子与还原氧化石墨烯的复合材料,将该电极作为栅极电极,并与石墨烯通道一起组装到溶液门控石墨烯晶体管器件中,用于汗液无创葡萄糖检测。传感机制主要基于葡萄糖的加入会引起器件通道中电流的变化,其中金纳米颗粒表面的电氧化和氧化石墨烯的减少导致等效栅电压的变化,从而影响通道载流子浓度。
检测汗液中分析物的生物传感器存在如何兼顾小型化和高灵敏度的矛盾,Imamura等使用热塑性形状记忆聚合物制造金薄膜电极,具有分层褶皱结构,并转移到柔软的、可拉伸的基底上。最终比原来的电极收缩了30倍,但依然保留了它原来的表面积,并且拉伸到原来长度的210%时,进一步实现了电流密度的增强;在聚合物松弛后,灵敏度也依旧保持稳定。
针对镍有机框架结构(Ni-MOFs)堆叠MOF层的活性镍阳离子位点不足问题,Xuan等通过Ni-MOFs进行超声波诱导的纵向膨胀增加了其活性镍离子位点,提高了对葡萄糖检测的电流响应,揭示了不同葡萄糖检测通道的可能性。并根据此组装了一个全固态葡萄糖生物传感器,用于汗液的非酶葡萄糖检测。(固态电解质:PVA/NaOH;工作电极:超声的Ni-MOF)。
Zhu等通过在金电极上涂覆两种氟碳基材料,提高了传感器的选择性和鲁棒性。开发了一个完全集成的腕带,通过汗液连续实时监测运动过程中的葡萄糖浓度,并通过蓝牙将测试结果上传到智能手机应用程序上。
Zhu等制备了封装在共基咪唑啉分子筛骨架中的钯(Pd)纳米颗粒,并用作电催化剂。将非酶传感器和柔性印刷电路集成到汗带中,实时分析葡萄糖。该传感器在生理pH下分析葡萄糖,不需要额外的试剂,这使其在可穿戴、免维护的状态下通过汗液长时间监测葡萄糖。
针对皮肤拉伸状态下传感器的稳定性问题,Hong等将碳纳米管逐层沉积在金纳米片(AuNS)上,采用银纳米线氯化法制备了参比电极。并将可伸缩传感器与粘性硅弹性体封装在一起,形成了一个可附着在皮肤上的汗液传感器。该传感器对潮湿的皮肤也显示出良好的粘附性,可以附着在皮肤上同时检测汗液中的葡萄糖浓度和pH值。
Toi等报道了一种非酶、电化学传感器贴片平台,使用一种具有褶皱结构、可拉伸的纳米混合纤维(WSNF),其中金纳米褶皱覆盖了还原氧化石墨烯/聚氨酯复合纤维。由于金纳米褶皱和还原氧化石墨烯支持结构中所富含的氧功能基团的协同作用,该纳米纤维有效促进了葡萄糖氧化脱氢过程。将该WSNF传感器贴片缝在可拉伸的织物上并附着在人体上,可以连续准确地测量汗液中的葡萄糖浓度。
③多平台传感器
除了传统的电化学方法检测葡萄糖含量,还有如比色法、微波传感等检测方式,并且可将不同的检测方式集成在一个平台中。
Xiao等报告了一种基于微流控芯片的可穿戴比色血糖检测传感器。该传感器由5个微流控通道组成,从中心分支出来,并连接到微检测室。微通道可以将从表皮排出的汗液输送到检测室,检测室中含有预包被的葡萄糖氧化酶⁃过氧化物酶⁃邻联茴香胺试剂,用于检测汗液中的葡萄糖。研究发现,邻联茴香胺氧化引起的颜色变化比传统的葡萄糖氧化酶-过氧化物酶-KI系统更为敏感。该传感器可以同时进行5种并行检测。
基于微带天线的微波传感器虽然有着灵活性和无线通信兼容性的优点,但是由于传感器尺寸减小,在其生化监测的灵敏度上受到了限制, Xue等提出了使用纳米带基超材料来增强微波信号,还进一步构建了一种基于掺杂葡萄糖氧化酶的纳米条的微波酶生物传感器。通过将纳米条集成在柔性基板上,制作了一种用于汗液葡萄糖传感的可穿戴生物传感器。该传感器具有高性能、低检测极限、宽动态范围以及快速响应的特点。该新型纳米级微波生物传感器可以作为各种生物标记物超敏感检测的通用平台。
在生物燃料电池的启发下,Bandodkar等提出了一种混合传感系统,该系统包括计时微流控平台和比色分析平台,且无需电池。该传感器轻便、便宜,具有与皮肤兼容的形状,并实现了对葡萄糖、乳酸、pH和氯离子浓度的实时无创监测。
然而,上述的汗液葡萄糖传感器所需的汗液并非一直存在于皮肤表面。这个问题可以通过使用离子热释药系统进行按需汗液刺激来解决。可以将匹罗卡品或甲乙醇,通过离子导入穿过皮肤,从而导致局部的刺激汗液产生和随后皮肤界面传感器的葡萄糖检测,这种方法能使汗液采样的时间缩短。
3、检测泪液的葡萄糖传感器
眼泪中的生物标记分子可以直接从血液中扩散并显示出密切的眼泪-血液葡萄糖浓度的相关性。这些特性使人类眼泪成为医疗保健监测应用中的一种很有效的诊断生物液。高血糖会导致血液中的葡萄糖渗透进入到泪液中,人体眼角膜中存在着葡萄糖转运蛋白,这些转运蛋白通过渗透作用将葡萄糖转运到眼泪中。Sarin等的研究表明,正常人和糖尿病患者眼泪中葡萄糖浓度具有相关性,糖尿病患者眼泪中的葡萄糖平均浓度为0.92mM,远大于正常受试者眼泪中的葡萄糖平均浓度0.2mM。
泪液对血液葡萄糖浓度的响应同汗液一样,存在着滞后,March等研究发现,正常人在服用葡萄糖后,泪液中的葡萄糖浓度的变化比血液中的延后大约5min。
目前,基于隐形眼镜的传感器有两种类型:光学和电化学生物传感。文中主要综述了电化学生物传感器。
Chen等开发了一种基于单层胶体晶体的葡萄糖敏感型光子晶体材料。聚苯乙烯纳米粒子首先自组装成高度有序的单层胶体晶体,然后用4-硼苯甲醛功能化的聚乙烯醇水凝胶对这种二维模板进行包覆。当葡萄糖浓度从0~20mM变化时,这种传感器可以有效地衍射可见光,可见光的结构颜色可以从红色到黄色再到绿色,覆盖了眼泪和血液的生理范围。该传感器具有极好的葡萄糖检测灵敏度,在取代指刺糖尿病测试方面具有巨大的潜力。
荷兰NovioSense公司开发了一种眼泪葡萄糖生物传感器。NovioSense传感器安装在右下眼睑处。该装置由多根电线(电极)平行放置的柔性线圈,以制造一个长15mm和直径1.3mm的弹簧形状的安培电池。电极未涂覆铂/铱和聚酯酰亚胺涂层不锈钢,用作隔离器和间隔器。具有生物相容性多糖基水凝胶外膜提供了眼睛表面与金属弹簧之间的软界面,从而保护了设备,提高了用户的舒适度。该传感器还被用来测量人体基础泪液中的葡萄糖水平,在Ⅰ型糖尿病患者的临床研究表明,在4.5h的连续监测中,和血糖之间存在可靠的相关性。
Romeo等提出了一种低成本的柔性喷墨打印电化学传感器,用于泪液中葡萄糖非酶检测。在柔性衬底上采用喷墨打印电极。利用CuO微颗粒修饰电极,形成了一个灵敏、稳定和经济的非酶葡萄糖检测平台。在碱性环境下,氧化铜催化葡萄糖的电氧化机制依赖于氧化铜能电化学转化为强氧化性的Cu(Ⅲ)形式,如氧化铜CuOOH或Cu(OH)4-。这些Cu(Ⅲ)基物质迅速将葡萄糖氧化为葡萄糖酸内酯,葡萄糖酸内酯最终水解为葡萄糖酸。实验证明,该喷墨打印CuO微颗粒葡萄糖传感器在3~700μM的检测范围内表现出了良好的线性。
Sempionatto等报道了一种可穿戴的泪液生物电子平台,将微流控电化学检测器集成到眼镜鼻梁垫中。该泪液传感平台放置在眼区之外,将无线电子电路集成到眼镜框架中,是一种完全便携、使用方便的传感设备。该装置不仅可以通过泪液监测血液中酒精浓度,还可以监测葡萄糖和维生素的浓度。对于葡萄糖传感部分,使用普鲁士蓝墨水和葡萄糖氧化酶的混合物打印工作电极,使用Ag/Agcl油墨打印参比电极和电极连接件。在连续的葡萄糖测量中没有观察到表面污染的影响,在常规无创血糖监测具有良好的前景。
Lee等提出了一种无创的自我诊断设备,可以安全地收集泪液并测量其葡萄糖浓度。该设备由两部分组成:眼泪收集部分,通过眼睑与下眼睑结膜接触,收集泪液;条型葡萄糖传感器部分,通过对市面上可买到的测试条进行修改,在主要电极保持完好的情况下最大限度的减少反应室的体积(该测试条通过电化学的方法高精度和选择性的测量血糖)。用该仪器获得的泪液葡萄糖浓度估算的血糖浓度与临床上可用的血糖仪实际测量的血糖浓度高度相关。
Han等展示了一种通过泪液同时监测糖尿病和干眼症的无创前眼传感器系统。该传感器葡萄糖监测部分同样也使用测试条改造而成,与临床上使用的血糖仪相比,当采集的泪液体积为0.6~1.0μL的情况下,传感器系统对葡萄糖浓度的估计具有可接受的精度。
Keum等开发了一种智能隐形眼镜,该眼镜可以同时用于葡萄糖浓度监测和糖尿病视网膜病变的治疗。该隐形眼镜构建在具有生物相容性的高分子聚合物上,由超薄、柔性的电路以及微控制芯片所组成。该系统主要完成实时葡萄糖浓度监测、按需控制药物传递、无线电源管理以及数据通信等功能。在糖尿病兔子模型中,通过泪液测得的葡萄糖浓度得到了传统的血糖测试方法的验证。
Kim等研制了一种由葡萄糖氧化酶和氧化铈(Ⅲ)组成的纳米颗粒修饰的隐形眼镜。他们利用光谱学方法,发现隐形眼镜的反射光谱随葡萄糖浓度的变化而发生明显的变化,并建立了反射光谱与已知葡萄糖水平的相关曲线。能够区分间隔为0.6mM的葡萄糖溶液。
Badugu等开发了一种使用葡萄糖敏感型硅水凝胶的隐形眼镜用于监测泪液葡萄糖。他们合成了一个带有疏水侧链的葡萄糖敏感荧光团Quin-C18,从而使得该荧光探针可以固定在界面区域。该传感器能够在体外测量不同浓度的葡萄糖,Quin-C18与晶状体结合牢固,即使在多次冲洗后渗出也不明显。
但是,美国亚利桑那州州立大学的研究显示,泪液含葡萄糖量通常是血液中的葡萄糖量的2.00%~3.33%(血液中正常的葡萄糖浓度为3.9~6.1mM),对传感器的精度要求显然比传统的血糖仪要更高,并且,例如切洋葱或者情绪的变化导致大量的眼泪分泌等原因也可能会使得监测到的数据出现异常,泪液的分泌存在基础分泌和反射分泌之分。在刺激后泪水中水含量会明显增多,因为泪液总量原本就少,水含量的大大增加为眼泪葡萄糖监测的准确性增大了难度。
4、检测唾液的葡萄糖传感器
近年来,人们对唾液作为诊断液体的研究进展迅速。唾液中的许多生物标记物通过细胞外或细胞旁途径直接从血液中流出,反映人体的生理状态,也为葡萄糖分析提供了一种无创方法。由于唾液收集较容易,它已被广泛用于诊断生物传感器或便携式诊断平台的检测。此外,唾液诊断,特别是通过唾液代谢组学研究唾液中大量低分子量内源性代谢物,已成为包括糖尿病在内的许多疾病检测的重要工具。
Dhanya等的研究显示糖尿病患者的空腹唾液葡萄糖浓度比正常人高。但是唾液的分泌和唾液成分受到多因素的影响,唾液中的葡萄糖可能不完全是唾液腺的来源(如龈沟液)。因此通过唾液监测葡萄糖水平对传感器提出了更高的要求。
在糖尿病的情况下,激素和神经平衡的变化可能会影响到作为血液过滤器的唾液腺,并导致唾液葡萄糖分泌的增加。Soni等发现健康受试者的血液和唾液葡萄糖浓度之间具有相关性,且糖尿病患者的相关性更密切。因此,唾液葡萄糖可以为糖尿病患者提供一种无创的筛查途径。
Chen等报道了一种基于青铜的非酶传感器,用于监测唾液中的葡萄糖。葡萄糖在青铜电极上发生电催化氧化,在工作电极上施加一个负电压,通过质子的还原就会产生一个临时的碱性条件。青铜电极对葡萄糖氧化具有很高的选择性。采用裸青铜电极作为工作电极,保证了传感器的鲁棒性。对唾液葡萄糖的电化学测定不需要额外的试剂,电极可以通过简单的机械抛光而再生,能够长期使用。传感器的线性范围为0~320μM,灵敏度为480μA mM-1 cm-2,检测下限为6.6μM。该传感器也被集成到用于监测唾液葡萄糖的智能牙刷中。
Carmona等开发了一个基于奶嘴的可穿戴平台,使用基于葡萄糖氧化酶-普鲁士蓝电极的生物传感器,用于新生儿唾液中的葡萄糖监测。当婴儿吮吸奶嘴时,嘴的运动使唾液有效地泵出,并促进唾液单向地流向外部电化学腔。该设备经评估已用于Ⅰ型糖尿病成年患者的葡萄糖糖检测,并被证明与其血糖水平有良好的相关性。设备的检测极限为0.04mM,灵敏度为(0.69±0.04)nA mM-1 cm-2。
Coyle等开发了一种非酶电化学葡萄糖传感器,该传感器在金蜂窝状框架结构表面又生长了相应的针状Co3O4材料,这种复合纳米材料在20μM~4mM的葡萄糖浓度范围内表现出优异的传感性能,并且该传感器对唾液中常见的生理污染物(如皮质醇和多巴胺)具有良好的选择性和较低的检测下限(20μM)具有很高的无创检测的应用前景。
同样使用Co3O4材料,Wang等采用异步水热法合成了结构尺寸均匀的四氧化三钴纳米颗粒。电化学结果表明,基于Co3O4纳米颗粒的葡萄糖传感器具有灵敏度高(2495.79μA mM-1 cm-2)、检测限超低(9.3nM)、响应速度快、选择性好、重现性好等特点。同时也证明了Co3O4纳米颗粒对人体血清和唾液中葡萄糖的良好检测性能,显示了Co3O4纳米颗粒在葡萄糖无创检测中的应用潜力。
孟维琛等采用聚二甲基硅氧烷为柔性基底,以均匀涂布的银纳米线为导电层,利用电化学方法将钯纳米粒子均匀沉积在银纳米线上,制备出新型钯-银纳米线柔性电极。对葡萄糖的线性范围分别为0.02~0.50mM和1~4mM。
Lam等制备了一种无创、高灵敏度的交叉指状电极,该传感器以唾液为样品测量人体的葡萄糖浓度。该传感器采用常规光刻和化学气相沉积相结合的方法制备,且仅用常规光刻无创的方法来检测少量样本(0.5μL)。Dong等以无水乙醇和NiCl2·6H2O为原料,采用温和水热法在碳布上原位生长了NiCl(OH)纳米片状阵列。以碳布为工作电极,在碱性条件下对葡萄糖进行检测。该电化学传感器的灵敏度为8052.0μA mM-1 cm-2,线性范围为0.001~3.45mM,检测下限为0.29μM,响应时间小于5s,可有效检测人体血清和唾液中的葡萄糖。Arakawa等研究了一种能够抗干扰的醋酸纤维素膜用于葡萄糖传感器,实现了唾液中葡萄糖浓度的监测。该传感器检测范围为1.75~10000μM可覆盖唾液葡萄糖浓度的检测范围(20~200μM)。Castro等描述了利用工艺切印技术开发的用于葡萄糖和亚硝酸盐唾液诊断的微流体纸基装置。此外,还介绍了将微流体纸基装置集成到牙套中作为可穿戴传感器监测血糖的方法。该装置包含两个葡萄糖和亚硝酸盐检测区和一个由微流控通道连接的采样区。从健康个体和牙周炎或糖尿病患者中收集唾液样本,然后用所提出的装置进行分析。结果与预期一致,使用该装置可以在诊断为糖尿病的患者唾液中发现更高的葡萄糖浓度值,在诊断为牙周炎的患者唾液中发现更高的亚硝酸盐浓度,通过监测摄入巧克力后唾液中的葡萄糖浓度,也成功地证明了该装置的有效性。但口腔中,干扰因素远多于其他体液,因为口腔是饮食过程的必经通道,在口腔中无法避免的会残留食物残渣,各种汤汁饮料,与唾液混合。这会影响传感器的检测精度,这需要葡萄糖唾液传感器有着很高的选择性,能够分辨不同来源的成分。
上述部分检测体液的葡萄糖传感器信息如表1所示。
表1 检测体液的葡萄糖传感器

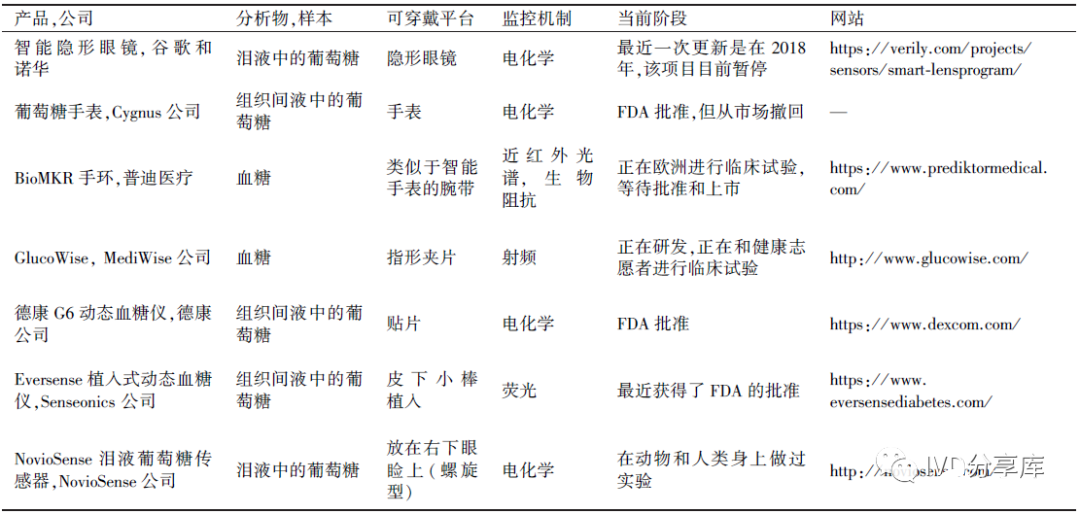
如今一些可穿戴无创监测葡萄糖的产品信息如表2所示。
表2 可穿戴无创监测葡萄糖产品
03
展望和结语
对于我国当前严峻的糖尿病现状,传统的监测、治疗和护理方法已经不能满足要求,需要新的医疗方法和途径来完善糖尿病管理体系,提高糖尿病治疗的效率。近几年来,柔性电子技术发展迅速,通过结合传感器技术集成可穿戴柔性电子设备,在医疗领域已经逐渐从实验室研究走向临床应用。随着葡萄糖传感器的精度越来越高,选择性越来越强,无创监测人体血糖趋势将成为必然。这种极具未来前景的传感器,在如今的发展中除确保必要的精度和选择性,还面临着诸多挑战。
1、安全性
可穿戴葡萄糖传感器已应用于医疗领域,因此传感器的安全性是重中之重。安全性包括了电气安全、材料安全、结构安全、是否具有生物副作用以及隐私安全等方面问题。前四者保障使用者在佩戴传感器检测血糖的过程中,不会受到传感器的伤害,同时还能保证传感器的稳定性和提高数据的可靠性。由于这类传感器检测的数据涉及敏感的个人隐私信息,需严加防护其安全,避免给使用者带来威胁。
2、供能
供能是另一类挑战。传感器的功耗主要来自3个方面:①为检测生物标记的传感器供电;②数据处理;③无线通信。找到合适的能量来源十分重要,电池过大会影响传感器穿戴的舒适性和便捷性,电池太小也会导致传感器续航能力差,因此兼顾传感器穿戴时的舒适度和续航能力是一大挑战。
3、数据可靠性
由于传感器检测的数据将运用在患者后续的治疗上,不可靠的数据只会恶化患者的病情。相比较于传统有创测血糖的方式,测量组织液、汗液、泪液和唾液这些体液中的葡萄糖浓度,极易受到外界因素干扰,且葡萄糖在体液中的含量也会与血液中血糖的含量存在相关性的差异,这就需要传感器拥有更好的选择性和更高的灵敏度,以及采取更好的避免干扰的措施。如何提高传感器的选择性和灵敏度则是解决该挑战的关键。
该类型的传感器在糖尿病管理上的应用,尚需突破时间、空间和地域等因素的限制,找到满足个性化护理服务需求契机。作为有很好发展前景的检测技术,我国也需要加强研发力度,进一步推动该传感器的发展,使之能够成为更有效服务糖尿病管理的利器。
审核编辑 黄宇
-
从糖尿病管理到环境监测:葡萄糖传感器的多元应用探索2024-08-13 2011
-
微针葡萄糖传感器贴片 可至皮肤深层持续监测2024-06-20 2934
-
浅谈可穿戴无创葡萄糖传感器的四种类型2023-06-08 2372
-
汗液葡萄糖无酶传感器用于监测汗液中葡萄糖浓度2023-06-07 2626
-
综述:基于金属纳米材料的可穿戴无创葡萄糖传感器研究进展2023-05-12 1918
-
蚕丝基柔性葡萄糖传感器研究进展2023-05-11 807
-
葡萄糖药液质量检测的视觉成像方案研究2021-04-18 2965
-
如何实现温度的酶注射式葡萄糖生物传感器检测方法的应用分析2020-03-13 1139
-
多孔酶膜构建的汗液葡萄糖传感器用于无创的健康监测2019-06-30 4522
-
AFM :多孔酶膜构建的汗液葡萄糖传感器用于无创的健康监测2019-06-27 4315
-
泪液葡萄糖传感器有望让可穿戴无创血糖监测仪成为现实2018-11-21 2354
-
纳米颗粒复合材料增强的葡萄糖生物传感器2010-12-29 540
-
微型葡萄糖微传感器的研制及其应用2009-07-11 722
-
新型葡萄糖氧化酶电极与毛细管电泳的联用2009-06-24 593
全部0条评论

快来发表一下你的评论吧 !

