

基于溶解性微针的透皮给药方案,用于改善血糖控制和患者依从性
描述
天门冬氨酸胰岛素(IAsp)和德谷胰岛素(IDeg)作为第三代胰岛素,起效时间更快或作用期更持久,可以用于模拟生理条件下胰岛素的分泌。微针(MNs)是一种可以用于透皮给药的器件,可以让糖尿病患者轻松地进行透皮胰岛素治疗,同时显著减轻注射疼痛。
近期,北京化工大学郭新东教授和荷兰格罗宁根大学Mohammad-Ali Shahbazi共同研究了溶解性微针联合IAsp或IDeg治疗作为每日多次胰岛素注射的替代方案,旨在改善血糖控制和患者依从性。此外,通过研究微针的力学性能、微针中封装的胰岛素结构稳定性和透皮应用特性,该研究评估了负载胰岛素的微针在糖尿病治疗中的实用性。在糖尿病大鼠体内进行的实验表明,负载IAsp和IDeg的微针具有与皮下注射相当的血糖控制能力。此外,该研究还进一步研究了负载胰岛素微针在不同饮食条件下的治疗特性和应用策略,为未来的临床试验提供新信息。综上所述,微针有可能改善血糖控制、低血糖风险和方便性之间的平衡,为患者提供更简单的治疗方案。相关研究以“Functional insulin aspart/insulin degludec-based microneedles for promoting postprandial glycemic control”为题发表在Acta Biomaterialia期刊上。
如图1所示,载药微针整齐地排列在贴片上,大小一致,前端尖锐。药物在微针上的分布主要集中在微针尖端(图1A),表明采用相同的制造工艺,胰岛素溶液可以选择性地封装在微针的尖端,以提高透皮给药效率和供应到体内的剂量精度。扫描电镜照片显示该研究制备的微针表面光滑,没有裂缝(图1B3、1C3)。
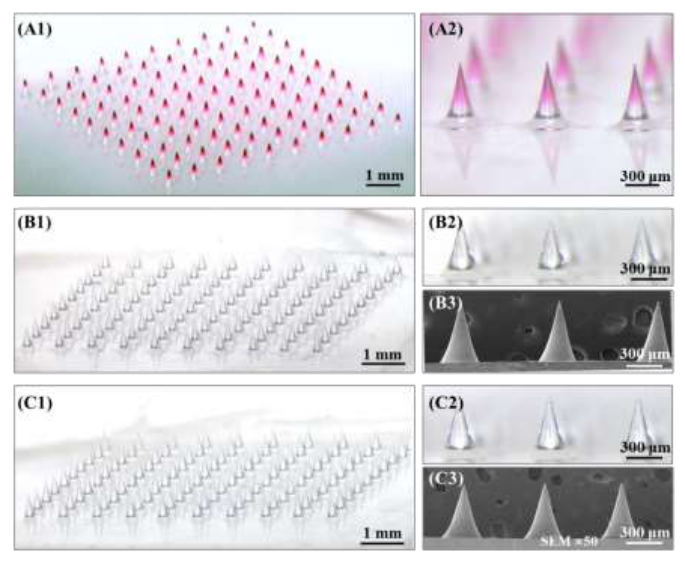
图1 制备的载药微针形态
从微针中溶解的胰岛素CD谱与原溶液CD谱高度一致,在208 nm ~ 209 nm和220 nm ~ 225 nm附近有两个小峰(图2),表明胰岛素在二级结构中基本保持稳定。
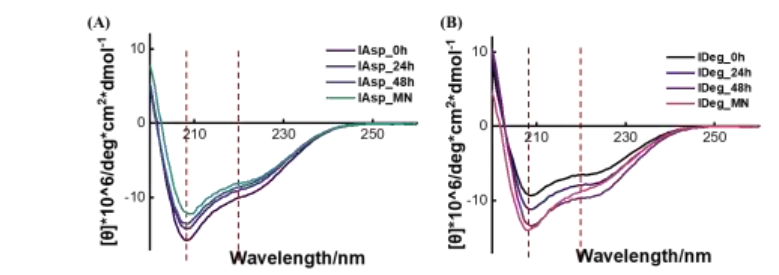
图2 Asp和IDeg经过不同处理后的圆二色光谱(CD)
与谷氨酰胺(GLN)的氮原子相连的氢原子作为氢键受体,接受聚乙烯醇(PVA)的氧原子形成氢键,而丝氨酸(SER)侧基团中的氧原子可以作为氢键供体,与PVA的氢原子相互作用(图3A、3B)。虽然A链中半胱氨酸(CYS)残基的侧基没有相互作用位点,但其碳基结构也使其成为氢键供体,吸引PVA形成氢键(图3C、3D)。通过定义蛋白质二级结构(DSSP)程序在100 ns的模拟中进一步分析两种胰岛素的二级结构的演变,结果表明含有PVA分子的胰岛素二级结构分布保持稳定,特别是对肽链的螺旋构象结构域的分布(图3E、3F)。通过分子动力学证实微针材料可以通过氢键与IAsp和IDeg相互作用,但不会影响胰岛素的二级结构稳定性。
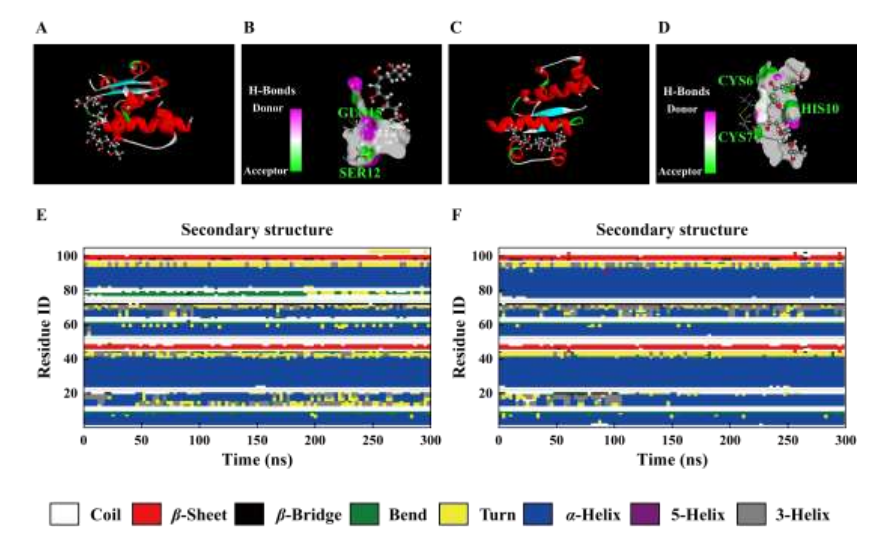
图3 PVA与胰岛素相互作用研究
通过对微针施加轴向压缩力(图4A),并将微针插入活体动物皮肤,该研究分析了所制备微针的力学性能,包括断裂强度和插入能力。微针的力-位移曲线显示作用力持续增加,只导致微针弯曲而不断裂(图4B、4C)。皮肤插入试验进一步证实载药微针透皮应用成功,在大鼠皮肤上产生的不可磨灭的穿刺部位(图4D)以及表皮层内的穿透腔(图4E)。光学相干断层扫描(OCT)图像证实治疗部位无皮肤病相关副作用,给药60 min内迅速恢复正常(图4G、4H)。这些结果表明,该研究制备的负载胰岛素微针足够强,可以有效地插入皮肤,同时也具有良好的耐受性,不会引起皮肤问题。
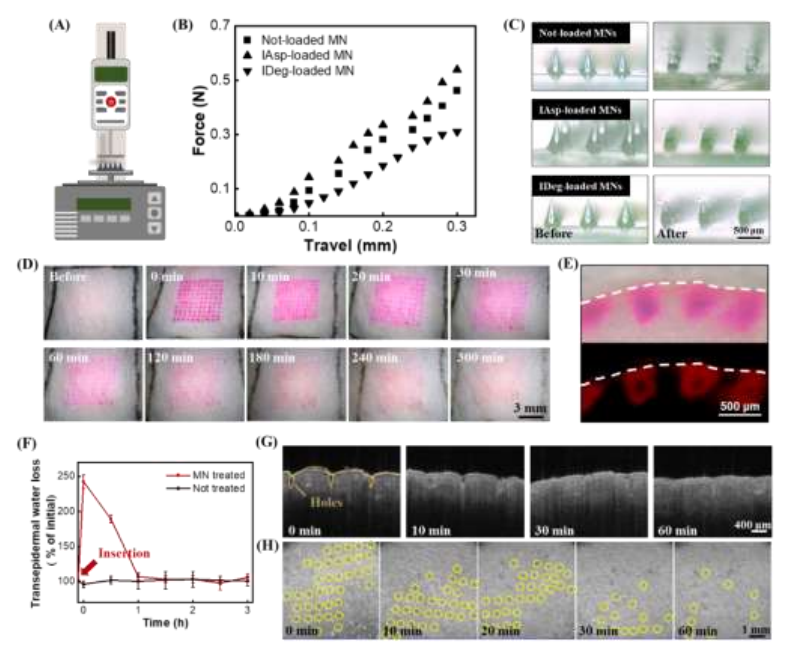
图4 负载胰岛素微针的特性分析
OCT图像显示,负载IAsp和IDeg的微针可以在450 μm ~ 500 μm的深度有效穿透大鼠皮肤,随后在与皮肤内的间质液接触后溶解(图5A)。应用后,针尖在3 min内溶解,大约一半的针高在5 min内溶解在皮肤中(图5B、5C),表明胰岛素的释放模式在很大程度上取决于基质物质的溶解。数据显示,负载IAsp和IDeg的微针有相似的释放趋势,约80%的胰岛素在前30 min内释放,在120 min内达到水平斜率,证明胰岛素的释放模式在很大程度上依赖于基质物质的溶解(图5D)。这些证据表明,含负载胰岛素的微针在透皮应用后迅速溶解,使有效载荷扩散到皮肤下,并被体循环吸收。
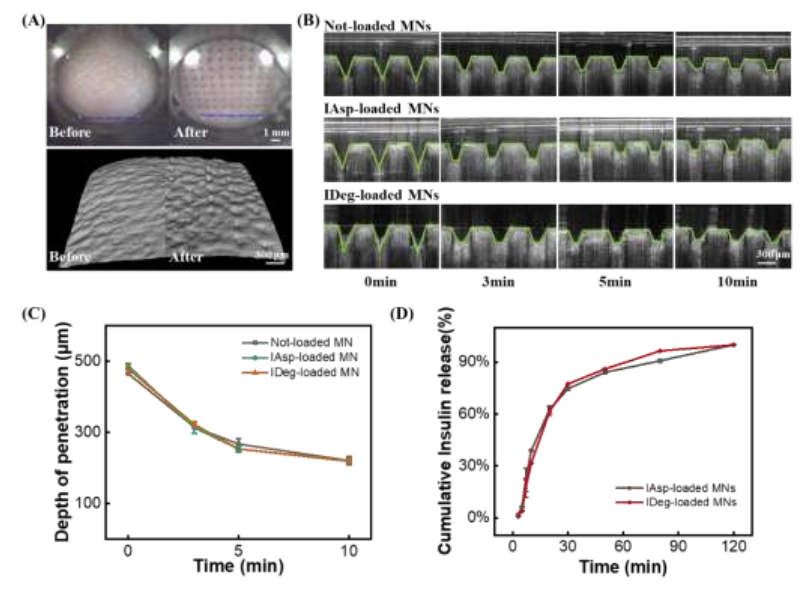
图5 微针溶解动力学的体外研究
为了确定负载IAsp的微针对血糖管理的治疗特性,在禁食条件下,将微针贴片给予链脲佐菌素诱导的糖尿病SD大鼠(图6A)。在该方案中,糖尿病大鼠在微针治疗前禁食6小时以上,仅筛选血糖水平超过16.7 mmol/L的大鼠,随机分为微针治疗组、SC注射组和安慰剂组(图6B)。微针注射组和SC注射组的血糖水平在给药30 min后均有显著下降趋势,并在1小时内迅速下降到初始水平的20%左右(图6C)。结果还表明,负载IAsp的微针在降糖给药方面与皮下注射有相似的效果,可在短时间内达到降糖目的。
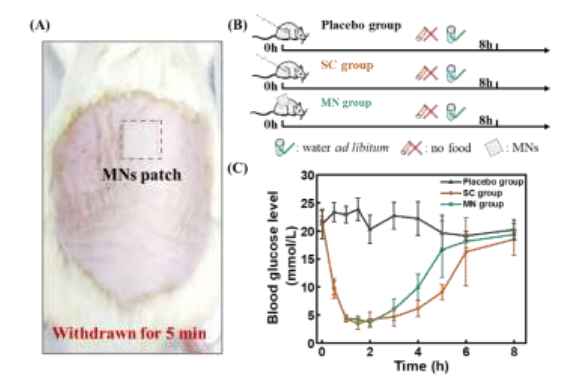
图6 负载IAsp的微针在禁食条件下治疗糖尿病大鼠
在餐前给药方案中,糖尿病大鼠在餐前0.5小时给予负载IAsp的微针贴片(微针组)、剂量匹配的SC IAsp(SC组)和PBS注射(安慰剂组)(图7A1)。用负载IAsp的微针处理的大鼠在给药后30 min内血糖下降,随后在进食后恢复到初始水平(图7A2)。SC胰岛素注射也表现出类似的低血糖趋势,表明基于微针的胰岛素给药系统通常是精确、有效的。通过调整给药/喂养方案,以改善餐后血糖管理。给药时间保持在8:00、12:00和17:00,而每次给药后立即给药2g饲料(图7B1)。
有效降低的血糖水平和维持长期的正常血糖证明,与餐前给药方案相比,该方案表现出更好的IAsp作用和食物吸收的同步性(图7B2),显示了在减少餐后血糖振荡和预防糖尿病后期并发症方面的潜在适用性。食物摄入量增加的实验大鼠表现出更明显的日内血糖波动和频繁的高血糖(图7C1、7C2)。血糖水平下降的第一个1小时治疗后迅速反弹到高血糖状态,证明胰岛素剂量足以抵消膳食消费和覆盖餐后血糖波动。因此,在未来负载胰岛素微针的临床应用中,应强调根据患者的特点量身定制治疗策略。
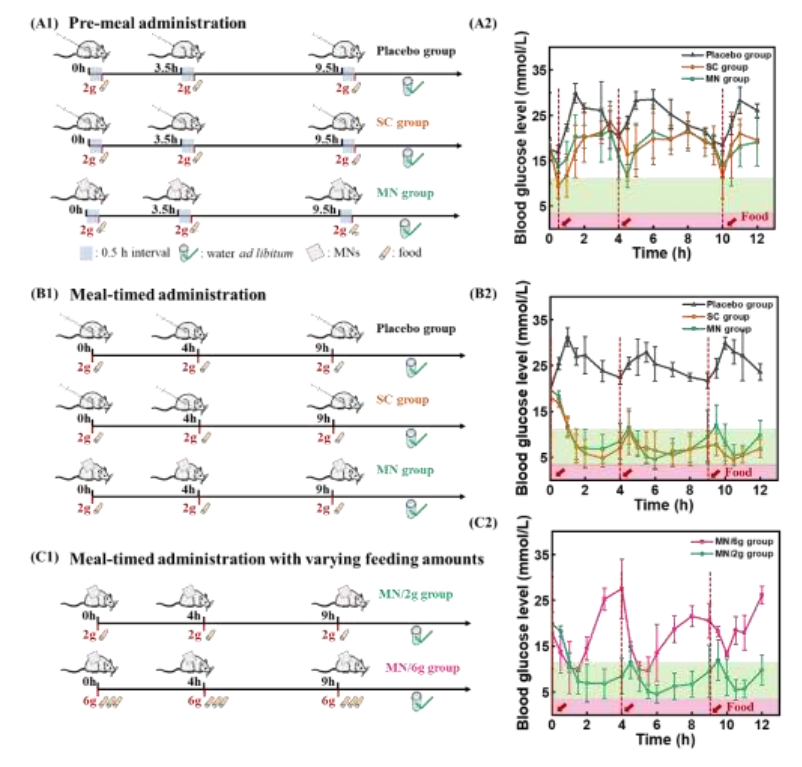
图7 负载IAsp的微针用于糖尿病大鼠的多餐方案
考虑到IDeg效应的缓慢发作,所有组糖尿病大鼠在进食前1小时进行治疗,并测量其血糖水平(图8A)。与安慰剂组相比,微针组能够控制餐后血糖的突然飙升,加上IDeg的渐进作用,血糖水平恢复到正常范围(图8B)。血糖水平统计数据的箱形图显示,实验期间安慰剂组的平均值始终高于负载IDeg的微针组和IDeg注射组(图8C)。安慰剂组大鼠的平均血糖水平在试验期间逐渐升高,这意味着IDeg处理组的值也会升高(图8D)。总的来说,用含IDeg的微针处理的大鼠血糖水平低于安慰剂组的大鼠,且随着食物摄入量的增加而增加(图8E)。对于餐前0小时测量的血糖水平,微针组下降到初始值的80%,显著高于餐后2小时测量的血糖水平(图8F),证实IDeg在基础血糖控制方面的优势。应用这种特性来指导基于微针的胰岛素给药系统,可以更好地管理糖尿病。
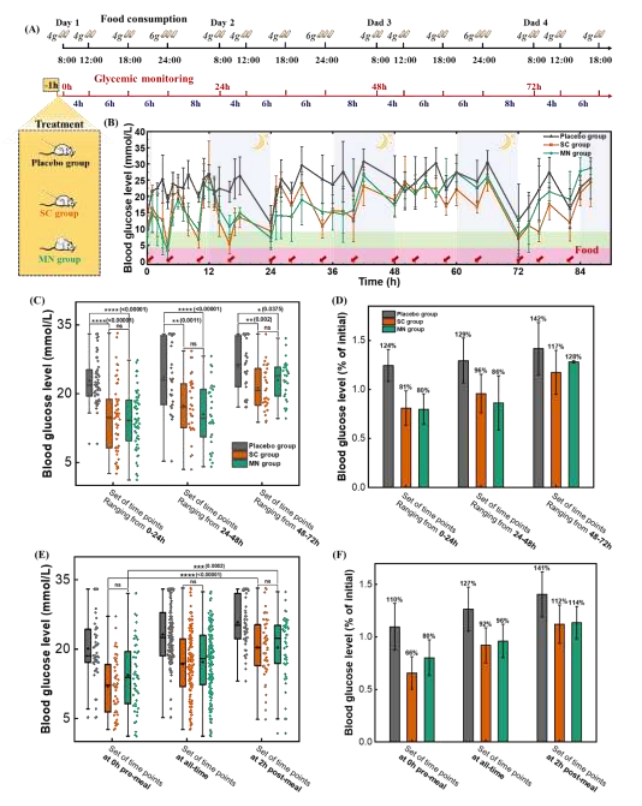
图8 负载IDeg的微针用于糖尿病大鼠多餐方案
图9显示了操纵分子动力学过程中的拉拽距离与模拟时间之间的关系,这也有助于显示IDeg单体之间更强的相互作用。
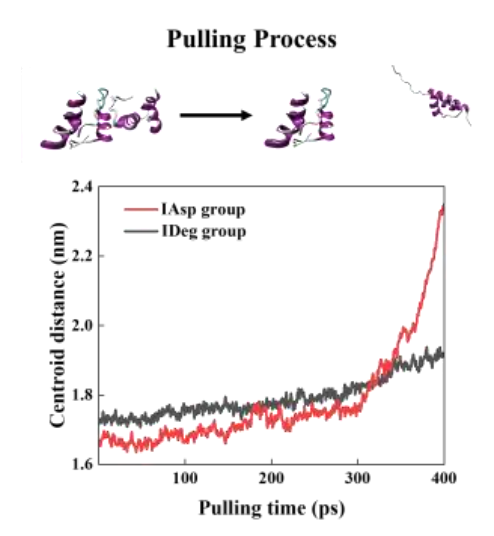
图9 胰岛素单体之间的拉距与时间的关系
综上所述,在这项研究中,负载IAsp和IDeg的微针通过温和的微成型工艺制备,并分别用于调节餐后和基础血糖水平。CD试验显示,由于制备工艺简单、温和,微针包裹的胰岛素在二级结构中基本保持稳定,可以防止胰岛素活性成分失效,提供良好的降血糖效果。此外,分子动力学模拟结果表明,微针材料可以通过氢键与IAsp和IDeg相互作用,但不会影响胰岛素的二级结构稳定性。在不同喂养和给药时间的糖尿病大鼠体内试验表明,制备的微针对降糖给药的效果与皮下注射相似。负载IAsp的微针可以显著降低糖尿病大鼠血糖水平,给药后1 ~ 2小时内达到最大疗效,并能够维持血糖控制3 ~ 4小时,使其适合定时用药,以更好地同步IAsp作用和食物吸收。负载IDeg的微针不仅能减少餐后血糖波动,而且还延长治疗效果的持续时间,减少日间血糖波动,预防并发症。
这项工作集中在研究负载IAsp和IDeg的微针在空腹和不同饮食条件下的降糖作用,以及使用胰岛素-微针系统治疗的糖尿病患者餐后血糖偏移和食物摄入量之间的关系,为评估负载IAsp和IDeg的微针作为基础方案治疗日常糖尿病的可行性提供新的信息。未来的工作可能集中在开发IAsp/IDeg混合微针,以提供更长时间的基础胰岛素和简化的基础方案,以更好的治疗糖尿病。
审核编辑:刘清
- 相关推荐
- 热点推荐
- 光谱仪
-
一种可以提升动态血糖监测均匀性和精确度的导电油墨2024-11-08 1202
-
一种基于物联网(IoT)的可穿戴血糖监测(iGM)系统2024-03-26 2977
-
基于溶解性微针和粘合性透皮贴剂的给药系统,用于治疗类风湿性关节炎2024-01-17 2984
-
可溶解微针在生物医学中的应用研究进展2023-12-09 4117
-
Renesas SynergyTM,RL78/G1D 个人用药依从性(PMA) 套件快速入门指南2023-03-17 424
-
用于药物输送的溶解微针的性能增强方法研究进展2023-02-23 2202
-
青澜生物在可溶解微针领域展开了重要布局2021-02-20 2888
-
一种快速检测微针吸湿性的方法,用来判断材料的溶解性能2020-09-26 2651
全部0条评论

快来发表一下你的评论吧 !

