

一种基于介电润湿数字微流控平台的超快速PCR
描述
PCR因其出色的灵敏度、耐受核苷酸变异的能力以及执行多重检测的能力而被广泛认为是核酸检测(Nucleic acid testing,NAAT)的金标准。超快速PCR系统的开发需要使用精密的仪器。为了促进即时检测(POCT)应用的快速PCR,微流控技术因其在试剂分配、减少反应体积、自动化的方面的优势而得到了广泛的研究。其中,基于介电润湿(Electrowetting-on-dielectric,EWOD)的数字微流控(Digitalmicrofluidics,DMF)可实现单个液滴精准操控,其高度可配置化有望实现在芯片实验室应用中开发高效的工作流程。然而,基于EWOD的数字微流控系统在实现PCR热循环中在高温下容易形成气泡。
此外,液滴在热区之间的快速和频繁移动会导致介电质击穿(dielectric breakdown),在超快速的热循环反应中温度传感器对液滴温度传感的不准确,这些都可能损害EWOD PCR的耐用性。这些技术挑战阻碍了EWOD应用于现场诊断的即时快速PCR。
近期,澳门大学贾艳伟教授课题组报道了一种基于介电润湿数字微流控平台的超快速PCR,采用双层加热、多孔超疏水膜、隔温槽、可溶性化学温度传感器等技术,综合解决了介电润湿数字微流控系统进行PCR热循环的稳定性问题,使得PCR在3.7 ~ 5分钟内完成40个热循环,并与传统PCR灵敏度相当。相关成果以“Sub-5-Minute Ultrafast PCR using Digital Microfluidics”为题发表在国际学术杂志Biosensors and Bioelectronics上。
具体而言,在该研究中,研究团队开发了一个集成的EWOD数字微流控PCR系统,该系统解决了基于EWOD平台上快速PCR的稳定性问题。系统原理及结构图如图1(a)所示。该EWOD PCR系统采用介电润湿介导的液滴在不同温区之间以移动的方式来完成PCR热循环。
由于液滴在不断快速移动中完成PCR热循环,常规温度传感器不适用于检测移动液滴中的温度,另外,传感器与液滴实际温度之间的温度偏差容易导致芯片上PCR效率降低。因此,研究团队采用一种可溶性温度传感器(磺酰罗丹明B)来进行精确的液滴内温度校准和调控,以实现高效的芯片上EWOD PCR。高温变性温区采用顶部和底部双层加热方式,减少了液滴的垂直温度差,以确保液滴PCR的稳定性和准确性。
为了有效地消除高温引起的介电击穿和气泡的产生,研究团队采用聚二甲基硅氧烷(PDMS)作为介电层来保护电极在高温下不被击穿。多孔膨体PTFE(expanded PTFE,ePTFE)覆盖在半固化的PDMS上作为疏水层,由于其多孔的可膨化特性,不容易因高温下的热膨胀而破裂,从而消除了因表面疏水层损伤而产生的气泡。
为了加快液滴PCR的反应速度,在顶部高温薄膜加热器的周围设置了隔热槽(Thermal isolation groove,TIG)(见图1(b)),使得变性和退火/延伸两个温度区的水平温度差增大,显著减少了两区之间的PCR液滴穿梭移动距离。最后,一种新型的移动电极联锁排列(Interlockingconfiguration)降低了移动电极对液滴大小的限制,使得大于0.2 µL大小的液滴可以在大于30°C的温度差下连续移动,不受热毛细管效应的影响阻碍液滴向高温区移动。
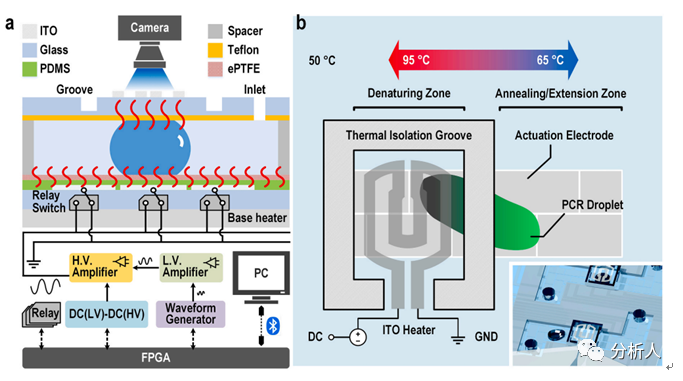
图1 基于介电润湿数字微流控的超快速PCR系统原理图
以上技术确保了PCR液滴在准确控温的不同温区稳定移动以进行热循环,使得所开发的集成EWOD数字微流控系统在3.7 min内实现了40个循环的超快PCR。此外,对一种可逆的热启动试剂的应用(ThermaStopTM)消除了芯片上PCR的非特异扩增。连续梯度稀释实验(Serial dilutions)验证了EWOD超快速PCR灵敏度与传统PCR一致,其效率达到95.31%。 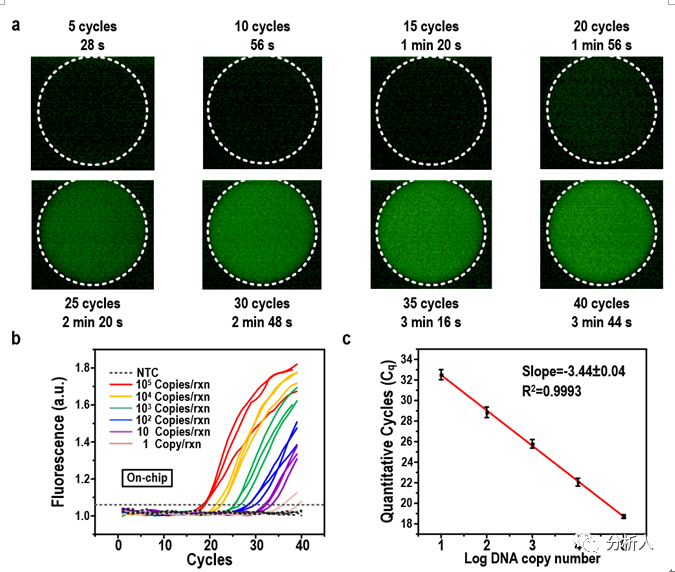
图2 基于数字微流控的芯片上PCR
综上所述,该研究介绍了一种基于EWOD数字微流控的稳健的超快速PCR系统。该研究采用的新材料及技术的组合有效增强了EWOD芯片的耐用性,可在超过30°C的温度梯度上至少实现240个液滴穿梭。体积为0.6 μL 的超快EWOD PCR在3.7 ~ 5.0分钟可实现40个热循环。比传统的PCR方法加速10 ~ 17倍。此EWOD系统还为NAAT用于检测传染性病原体、耐药性分子检测、法医学和其他基于PCR的实际应用提供了可能性。
审核编辑:刘清
-
好芝生物推出HelixPOC全自动微流控PCR一体机2020-12-23 4221
-
主动式数字微流控芯片的研究步入了崭新的阶段2021-01-11 5259
-
天马有源数字微流控芯片实现多类相关传感功能集成2022-06-20 2924
-
一种多功能化的核酸快速检测平台2022-07-23 2263
-
用于实时PCR扩增或LAMP终点检测的微流控芯片2023-01-29 2032
-
一种基于微流控的血管芯片模型设计2023-03-09 2223
-
三合一微流控液滴数字PCR平台,用于DNA绝对定量分析2023-07-31 1810
-
用于高通量单液滴的操纵和生成的有源矩阵数字微流控芯片2023-08-14 3660
-
介绍一种高灵敏度多靶标核酸检测微流控芯片2023-08-16 2534
-
一种光固化通道数字微流控芯片(pCDMF)2024-01-03 1363
-
一种具有显著优点的光固化通道数字微流控芯片(pCDMF)开发2024-01-04 2031
-
介绍一种用于绝对定量的微腔式数字PCR微流控芯片2024-03-04 2060
-
一种基于液晶的新型可调介电超构表面,为传统液晶器件带来经济价值2024-04-08 1553
-
基于轨道电润湿的液滴操控技术,有望用于新一代数字微流控平台2024-04-19 4193
全部0条评论

快来发表一下你的评论吧 !

