

优化配位环境提高水系铜-氯电池电压的方法
描述
研究背景
近年来,水系铜基电池因其出色的特性备受关注,但其应用受制于铜负极的高电位(0.34 Vvs. 标准氢电极),导致现有的电化学体系常常无法提供足够高的电压(通常小于1 V),以满足特定应用的需求。
研究内容
近日,深圳大学刘卓鑫助理教授、南方科技大学李洪飞助理教授和香港城市大学支春义教授合作,提出了一种配位策略来降低水铜基电池的本征负极氧化还原电位,从而提高其工作电压。这是通过Cl−离子调整电解质来建立适当的配位环境来实现的。当与氯配位时,水系电解质中的中间体Cu+离子被成功稳定,并且电化学过程被解耦为涉及Cu2+/Cu+和Cu+/Cu0的两个独立的氧化还原反应;其中Cu+/Cu0的氧化还原电位比Cu2+/Cu0的低了大约0.3V。同时,与水配位相比,氯配位提高了铜利用率、氧化还原动力学和循环稳定性。
此外,利用电解液中过量的Cl−离子,构建了一种利用正极Cl−/Cl2氧化还原反应的水系铜-氯电池体系,表现出1.3 V的高放电电压平台,并且在10000次循环后仍保留了77.4%的初始容量。这项工作可能为提高水系铜电池的电压开辟一条途径。其成果以题为“Manipulating coordination environment for a high-voltage aqueous copper-chlorine battery”在国际知名期刊Nature Communications上发表,本文第一作者为深圳大学博士后张祥勇。
研究要点
氯离子的配位作用稳定了水系电解液中Cu+离子,使Cu2+离子的电化学过程被解耦为两个独立的氧化还原反应。
对氯配位下铜的反应机理进行深入分析,得出两个氧化还原反应分别对应于Cu2+/Cu+和Cu+/Cu0,其中Cu+/Cu0的氧化还原电位比Cu2+/Cu0的低了大约0.3V。
采用Cl−/Cl2作为正极反应构建了Cu-Cl2电池,表现出1.3 V的高放电平台,出色的倍率性能和良好的循环稳定性,在10000次循环后仍保留了77.4%的初始容量。
图文导读
图1. 卤素离子对铜离子电化学行为的影响
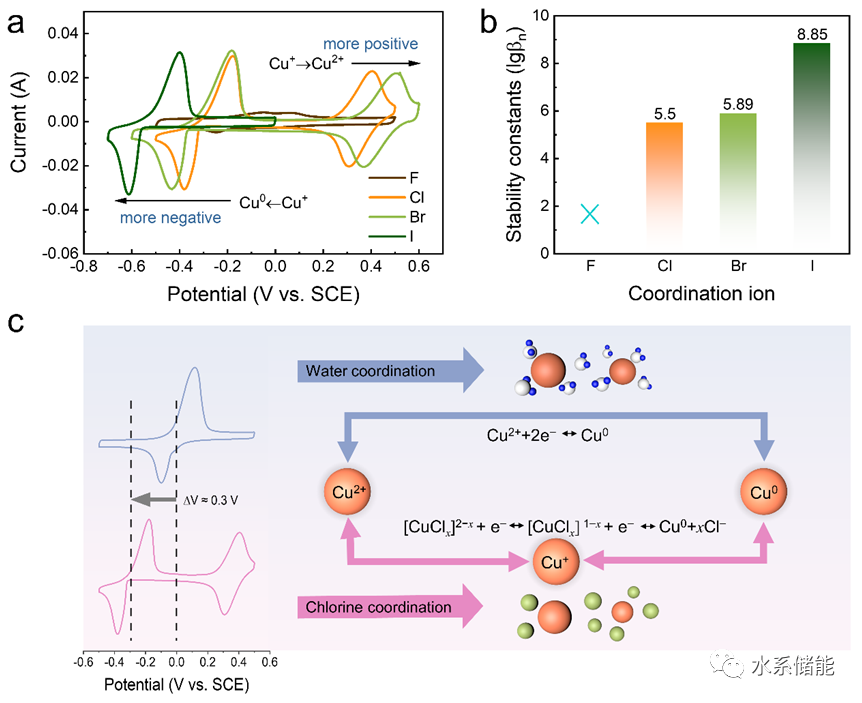
(a)在各种卤素电解质中以10 mV s−1扫描的CV曲线。(b) 不同卤素配合物的稳定常数。(c) 氯和水配位下氧化还原行为差异的图示。
▲使用不同含卤素的电解液改变铜离子的配位环境并进行循环伏安法(CV)测试。结果表明,在卤离子(Cl−和Br−)的配位下,CV曲线中包含两对氧化还原峰,对应Cu2+/Cu+和Cu+/Cu0的反应,表明卤素配位使Cu+离子更加稳定。更重要的是,稳定的Cu+显示出明显较低的还原电位,这意味着可以构建工作电压更高的水性铜电池。卤化物配位环境下的氧化或还原电位变化与所形成的配合物的稳定常数相关,稳定常数越高,氧化或还原反应越难发生,从而导致更高的氧化电位和更低的还原电位。
图2. 配位环境的分析
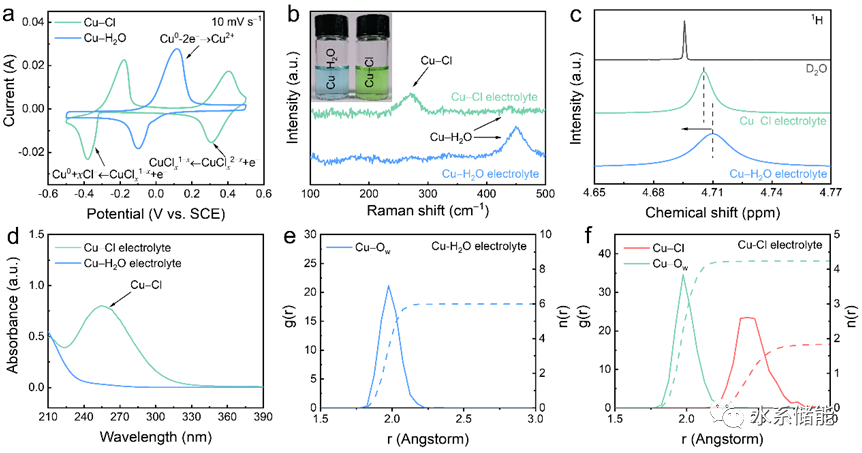
(a)以10mV s−1的扫描速率获得的CV曲线,(b)SERS光谱,(c)1H NMR光谱,(d)Cu-Cl和Cu-H2O电解质的UV-Vis光谱。(e) Cu-H2O电解质的RDF(径向分布函数)。(f) Cu-Cl电解质的RDF。
▲表面增强拉曼散射光谱(SERS)和核磁共振(NMR)光谱揭示了Cu−Cl电解液中铜离子与氯离子的配位作用,而紫外-可见(UV-Vis)光谱进一步证实了Cu−Cl配位复合物的形成。分子动力学模拟结果也显示,在Cu−Cl电解液中,铜离子与氯离子发生配位,形成了氯配位的铜离子(CuCl1.8(H2O)4.2)而不是纯水配位的铜离子(Cu(H2O)6)。这些发现为理解配位环境对铜离子电化学行为的影响提供了深入见解。
图3. 氯配位下,铜的氧化还原机制
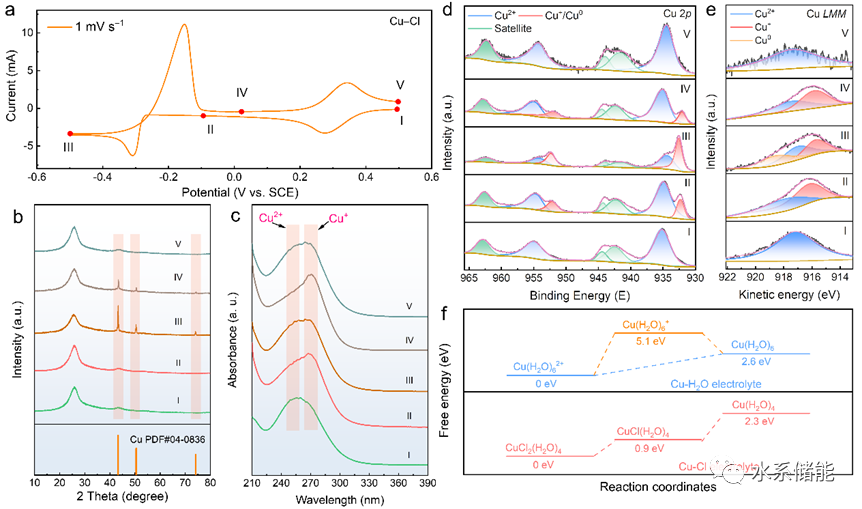
(a)以1 mVs−1的扫描速率获得的CV曲线。(b) 相应的非原位XRD图案。(c) 相应的非原位紫外-可见光谱。(d) 相应的非原位XPS光谱。(e) 相应的非原位XAES光谱。(f) 可能的反应途径。
▲通过非原位分析包括X射线衍射、UV-Vis光谱、X射线光电子能谱(XPS)和X射线激发俄歇电子谱(XAES)对铜离子的氧化还原机制进行深入解析。结果表明,在氯配位下铜离子发生可逆的氧化还原反应,具体包括Cu2+/Cu+和Cu+/Cu0之间的转化。此外,理论模拟结果与实验数据相符,进一步支持了所提出的反应机制。根据所获得的结果,氯配位环境下铜离子的电化学过程如下(其中x=1-4,代表配位数):
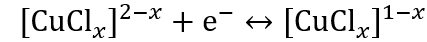 (1)
(1)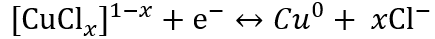 (2)
(2)
图4. 铜负极的电化学性能
Cu负极在(a)Cu-Cl和(b)Cu-H2O电解液中不同扫描速率下的CV曲线。(c) 对应于a和b中三个氧化峰的b值。(d) 不同扫描速率下的电容贡献。(e) 不同电流密度下Cu-Cl电解液中的GCD曲线。(f) Cu-H2O电解质在不同电流密度下的GCD曲线。(g) Cu-Cl和Cu-H2O电解质中的倍率性能。(h) 20 mA cm−2下Cu-Cl和Cu-H2O电解质中的长期稳定性。
▲全面对比水配位下铜的电化学性能,可知氯配位下铜负极具有如下优势:(i) 较低的负电极电位,降低了0.3 V左右,(ii) 更高的铜离子利用率(高面容量),(iii) 更快的电化学动力学(高倍率性能),和(iv) 更好的循环稳定性。
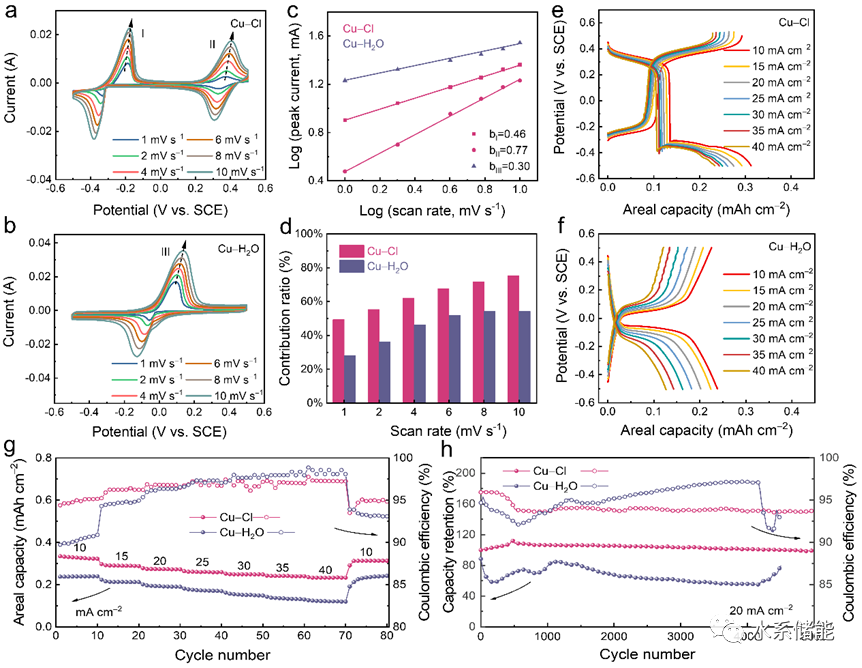
图5. 氯正极的电化学性能
(a)当使用Cu-Cl和Cu-H2O电解质时在10 mV s−1的扫描速率下获得的CV曲线。(b) Cl2正极在10 A g−1下的GCD曲线。(c) Cl2正极在Cu-Cl和Cu-H2O电解质中在10 A g−1下的长期稳定性。(d) 4 M NaCl和0.5 M HCl和 (e)4 MNaCl的溶液中在不同电位下获得的UV-Vis光谱。(f)CV曲线. (g) GCD曲线。(h) Cl2正极在包含4 M NaCl和0.5 M HCl的溶液中的倍率性能。
▲在Cu-Cl电解质中,正极CV曲线出现明显的还原峰,显示出Cl−/Cl2的正极反应可行性。通过将0.5 M HCl加入Cu-Cl电解液以提高电极的稳定性,实现了88%的容量保持率。进一步的UV-Vis光谱表明,HCl的加入抑制了氯气与水的反应,提高了循环稳定性。正极Cl−/Cl2反应的CV曲线显示了稳定的氧化还原行为,具有160mAh g−1的比容量和出色的倍率性能。此外,负极铜电极的氧化还原行为受HCl的影响很小。这些结果为构建Cu-Cl2电池系统提供了关键信息。
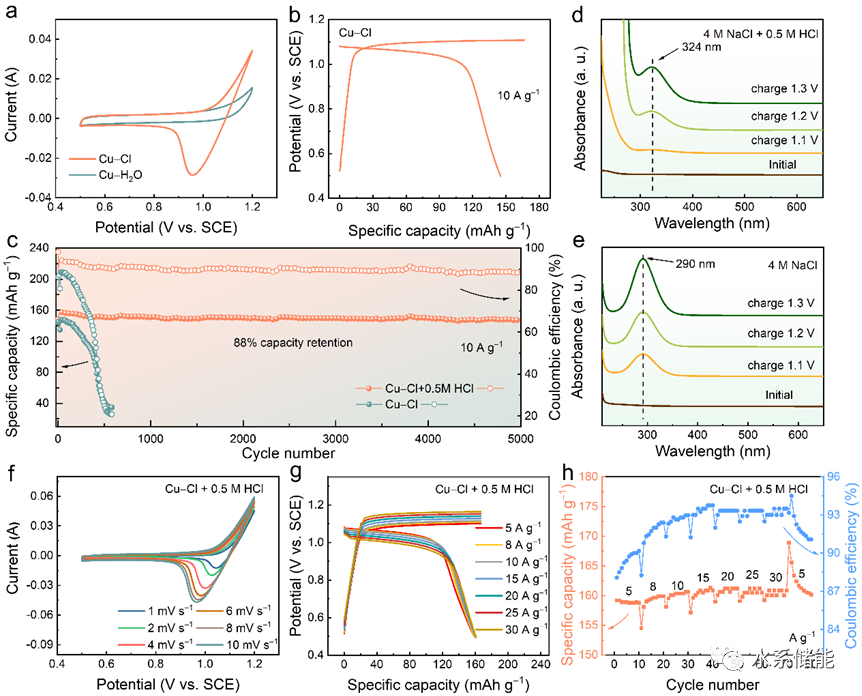
图6. Cu-Cl2全电池的构建及其电化学性能
(a) Cu-Cl2全电池的示意图。(b) 在不同扫描速率下获得的CV曲线。(c) Cu-Cl2全电池在不同比电流下获得的GCD曲线。(d) 倍率性能。(e) Cu-Cl2全电池在20 A g−1下的长期稳定性。
▲正极CV曲线显示正电极氧化还原电位约为1.1 V (vs. SCE),对应于Cl−/Cl2反应。负电极电位显示两个氧化还原对,分别位于约−0.28和0.36V (vs. SCE),分别与Cu+/Cu0和Cu2+/Cu+反应相关。根据这些电位差异,预计全电池将产生大约1.4和0.7 V的两个充放电平台。充放电曲线验证了全电池的性能,展示了约1.3V的高放电平台,良好的倍率性能和出色的循环稳定性。
研究总结
本文深入研究了氯配位对铜氧化还原电位的影响,以获得高压水系铜基电池。由于其与Cu+的络合,Cl−可以稳定水系电解质中的Cu+,使得Cu+/Cu0的氧化还原反应能够在比常规Cu2+/Cu0反应低约0.3V的电位下发生。与水配位相比,氯配位下的铜负极在10 mA cm−2下也表现出更高的面积容量、更快的氧化还原动力学和更高的循环稳定性,在20 mA cm-2下循环5000次后容量保持率达到99%。
最后,采用Cl−/Cl2作为正极反应原位构建了Cu-Cl2全电池。该电池提供了1.3 V的高放电平台,并且在5 A g−1下具有162mAh g−1的放电容量(基于科琴黑的质量)。它还表现出出色的倍率性能和良好的循环稳定性,在10000次循环后仍保留了77.4%的初始容量。本研究中使用的策略——调节配位环境——降低了负极电位,改善了电化学动力学,并增强了循环稳定性。这些发现可以为高性能水系电池的未来发展提供线索。
审核编辑:刘清
-
专家开讲:深入了解电池技术──Part 7 (锂亚硫酸氯电池)2014-08-18 8479
-
锂亚硫酰氯电池详细介绍2009-11-13 5761
-
东莞盈谷锂亚硫酰氯电池2009-11-14 851
-
基于64位机器的32位指针优化方法2011-05-26 615
-
提高锂亚硫酰氯电池可靠性的方法研究2011-11-01 858
-
锂亚硫酰氯电池,无线传感器网络电源新选择2013-07-30 2401
-
放电少、放置10年依然可用的锂亚硫酰氯电池2017-12-01 3053
-
双洎3.6v 一次锂电池(锂亚硫酰氯电池,锂硫酰氯电池)的用途?2022-05-31 2970
-
离子液体基电解液在非水系和水系金属电池中的研究进展2023-08-17 3220
-
全面论述水系电池中氢键关键作用!2023-11-17 5880
-
BQ76952在电池均衡时电压采样不准确的原因分析及优化方法2024-08-29 995
-
碱锰电池的铜针表面怎么处理2024-09-21 1137
-
水系电解液宽电压窗口设计助力超长寿命水系钠离子电池2024-12-20 2782
全部0条评论

快来发表一下你的评论吧 !

