

用一篇20+文献带你领略修饰组学的魅力
描述
说到组学研究,可能很多人都会想到基因组、转录组、蛋白质组这些耳熟能详的名字。但这些组学基本围绕中心法则,从遗传和基因表达的角度阐释表型形成的分子机制。然而,随着生物学研究的不断深入,我们发现生命法则并不是简单的线性调控,而是复杂的调控网络,其中就包括各种类型的化学修饰,修饰组学也逐渐被人所重视。越来越多的研究表明分子修饰可能导致信号通路和基因表达的变化,从而影响表型的形成。因此,为了让大家能掌握修饰组学的研究思路,小编带来了一篇上海交通大学薛红卫教授团队的文章,以磷酸化蛋白质组为例,解读修饰组学的研究策略。
01研究背景 蛋白质磷酸化是由蛋白激酶进行的主要翻译后修饰,构成真核生物中复杂信号网络的组成部分。CK1(酪蛋白激酶1)在真核生物中高度保守,参与到植物和哺乳动物细胞中的多种信号通路,发挥至关重要的作用。然而,对于CK1的内源性底物研究的特性和广度还未能全面探索。尽管一些公开数据库可用于预测底物和磷酸化残基(磷酸化位点),但体内验证预测的结果十分困难,局限性大。因此,本研究借助LC+MS/MS DIA精准定量磷酸化蛋白质组的力量,探究AEL介导的磷酸化事件,鉴定新的磷酸化底物motif,并发现AEL(拟南芥的特异性CK1是AEL家族基因,包括AEL1/2/3/4)通过介导转录组因子C3H17的磷酸化来调节胚胎发生,促进该转录因子的蛋白质稳定性和反式激活活性。此外,研究者预测了水稻、小鼠和人中新的候选 CK1 底物,促进研究 CK1 介导的磷酸化在不同物种中的作用。 02技术路线
为了方便各位老师快速掌握研究思路和结果,小编绘制了文章的研究框架图,供各位观赏。
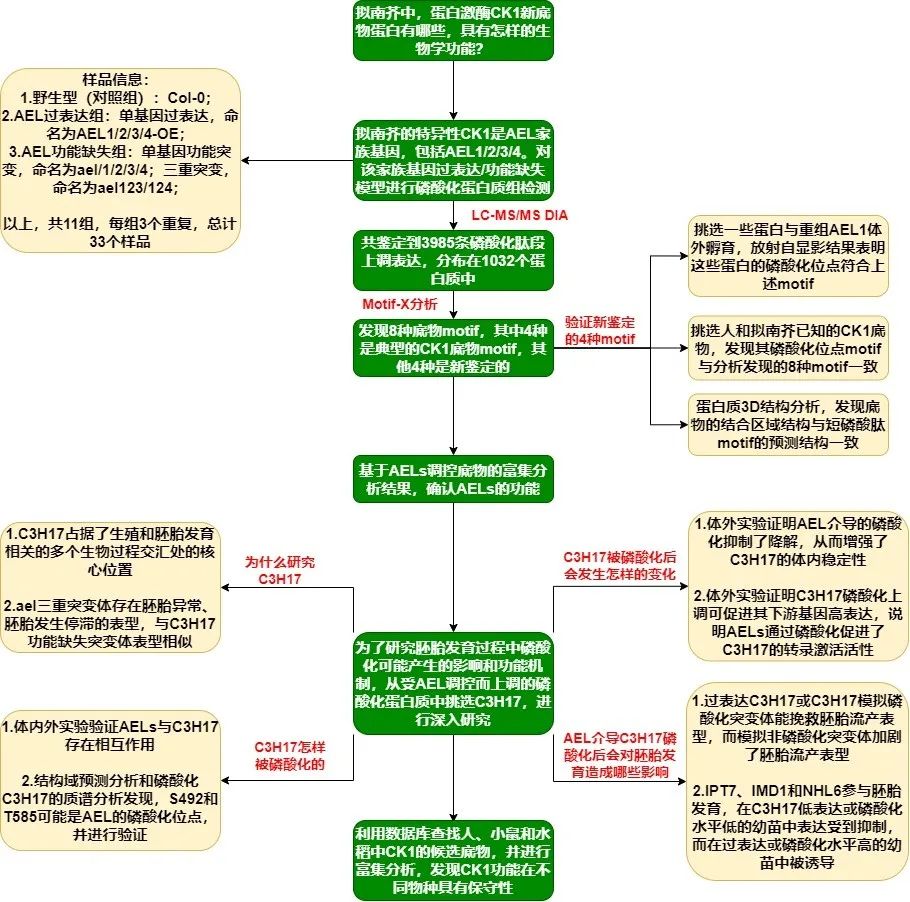
~点击图片即可放大哦~
03研究结果
1. 筛选AEL调控的磷酸化肽段,并鉴定其motif特征
利用LC+MS/MS DIA,对拟南芥野生型、AEL过表达和功能缺失ael突变体进行磷酸化蛋白质组定量检测及分析,获得因AEL上调而上调的磷酸化肽段3985条,分布在1032个蛋白质中。利用Motif-X分析这些上调磷酸化肽段,发现4个经典CK1底物motif,并鉴定到4个新的motif。这些结果通过实验和蛋白质3D结构分析进行验证。
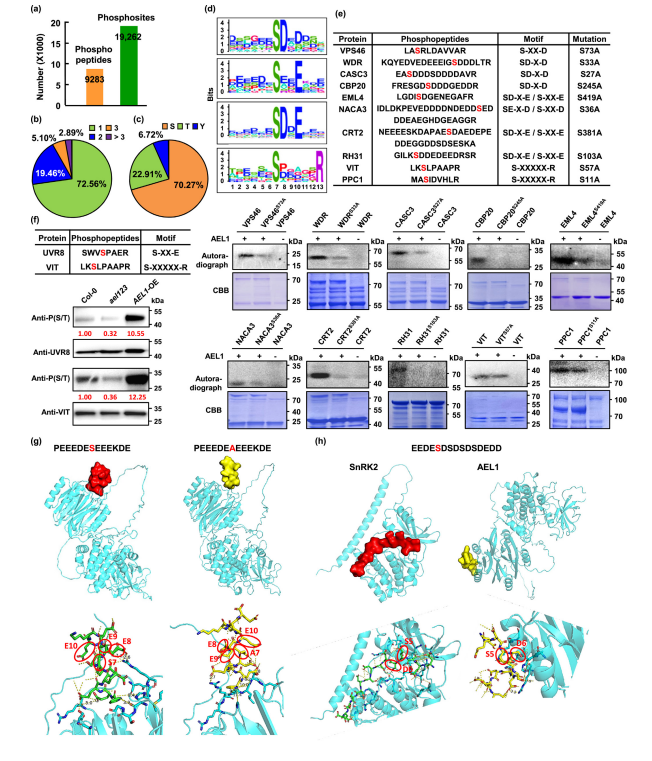
Fig.1 AEL 磷酸化motif的鉴定和验证
2. 富集分析发现AEL的功能
为了研究AEL调控的生物学功能,对上述1032个蛋白质和用8个motif在数据库查找到的3509个预测的AEL底物蛋白进行GO和KEGG富集分析,发现了AEL在转录调控、环境胁迫、代谢、细胞分裂、激素响应和营养相关的功能。此外,富集分析结果中发现了与开花时间调控相关的类别,表明AEL可能通过结合不同的翻译后修饰来调控特定的发育阶段。
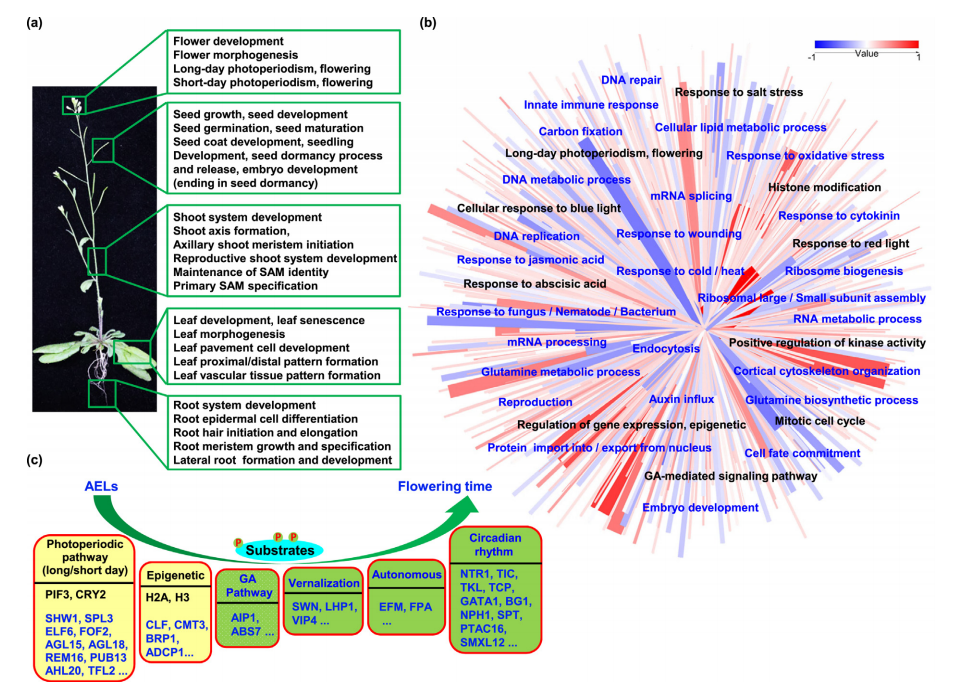
Fig.2 利用鉴定到的motif预测AEL的底物并进行功能分析
3. 从AEL的底物中挑选与胚胎发育相关的C3H17为了研究蛋白磷酸化对于拟南芥胚胎发育的影响,研究者从上调磷酸化蛋白质中挑选了C3H17(一种 CCCH 型锌指转录因子)继续研究。该蛋白占据了生殖和胚胎发育相关的多个生物过程交汇处的核心位置,并且其功能缺失突变体表型与ael三重突变体相同,即胚胎发育异常和停滞。4. AEL介导C3H17磷酸化在胚胎发育中至关重要
选定要研究的底物蛋白质后,研究者首先用体内、体外实验验证了组学结果,确认AEL可以与C3H17互作。然后,利用Scansite算法和LC-MS/MS技术鉴定出AEL使C3H17磷酸化的两个氨基酸位点:S492和T585,并在C3H17模拟非磷酸化突变体(C3H17AA)和ael突变体中进行验证。
接下来,研究者想知道C3H17磷酸化后会发生怎样的变化。因此,研究者在野生型、AEL突变体、C3H17模拟磷酸化(C3H17DE)和C3H17AA突变体中检测了C3H17蛋白的降解程度,并发现AEL1-OE和C3H17DE突变体中降解程度低,说明AEL介导的磷酸化抑制了降解,从而增强了C3H17的体内稳定性。此外,C3H17作为转录因子调控的三个下游基因CRU3、OLEO1和OLEO2在AEL-OE表达更高,c3h17突变体中表达较低;在C3H17AA突变体中基因转录受抑制,而在C3H17DE突变体中基因转录活性增加,证实了AEL通过磷酸化促进了C3H17的转录激活活性。
最后,研究者想要探究AEL介导C3H17磷酸化后会对拟南芥的发育产生哪些影响。当过表达C3H17,尤其是C3H17DE,能够拯救ael123中观察到的胚胎流产表型,而无论在野生型还是AEL突变体中,过表达C3H17AA加剧了胚胎流产,说明AEL通过磷酸化C3H17在胚胎发育中发挥关键作用。转录组测序的差异基因和富集分析结果进一步证实这一结果。此外,参与细胞分裂、胚胎发育等信号通路的三个基因IPT7、IMD1和NHL6在ael123、c3h17-1和模拟非磷酸化的ael123中的表达受抑制,但在表达C3H17DE的ael123中被诱导,表明这些基因可能在C3H17的下游发挥作用,其功能依赖于C3H17的磷酸化,可能在胚胎发育中发挥重要作用。
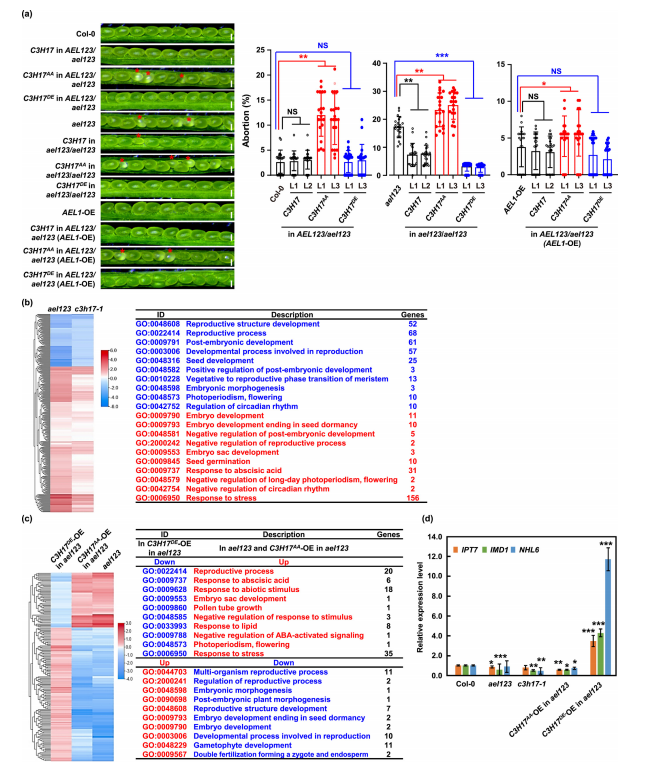
Fig.3 AEL介导C3H17磷酸化在胚胎发育中的关键作用
5. 预测CK1在植物和哺乳动物中的底物并确认其功能保守性
上述结果在拟南芥中确认了CK1及其底物蛋白在胚胎发育中的重要作用。接下来,研究者打算在不同物种中分析CK1的保守性。从人、小鼠、水稻的蛋白质数据库中利用鉴定出的8种motif序列进行筛选,获得了CK1大量的候选底物蛋白。通过GO和KEGG功能富集分析,发现CK1在单子叶和双子叶植物中具有保守的功能。染色体和染色质组织、细胞分裂过程中的关键事件的GO类别在小鼠、人和拟南芥中富集程度高,表明细胞分裂是真核生物中由 CK1 调节的最重要、最保守的生物学机制。这些结果将有助于研究CK1在植物和哺乳动物中的保守功能。
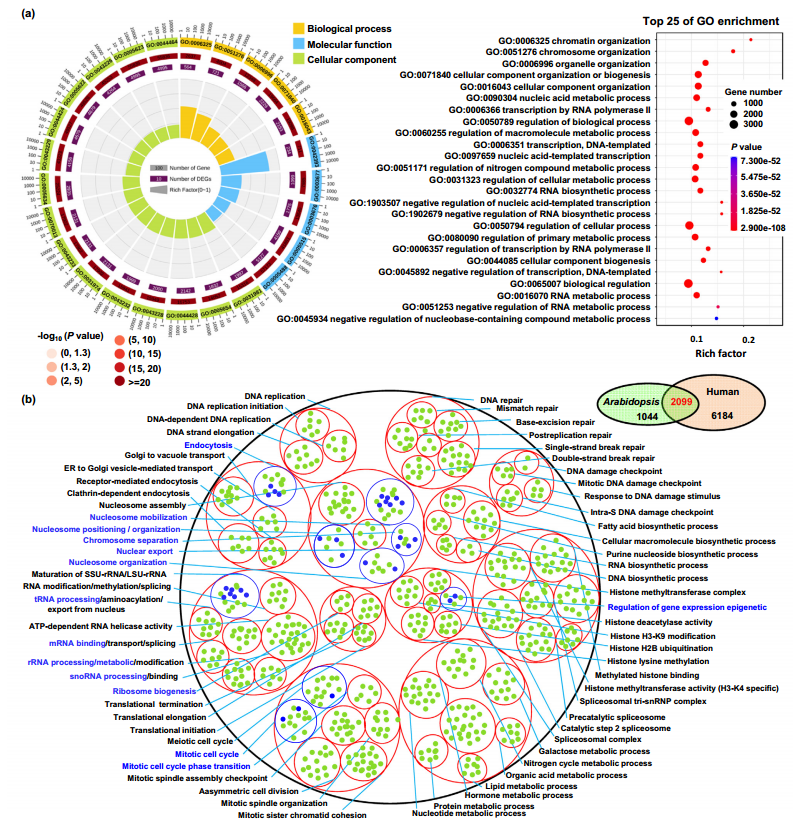
Fig.4 人CK1底物的分子功能
04主要结论
本研究利用LC+MS/MS DIA定量检测拟南芥中的磷酸化蛋白质组,识别CK1底物和显著变化的磷酸化肽段,并利用Motif-X鉴定出8个CK1的底物motif,可用于预测 CK1 的候选底物和功能。通过生化和遗传分析对新鉴定的底物C3H17进行了功能表征,揭示了 AEL 促进的 C3H17 蛋白稳定性和反式激活活性在调节胚胎发生中的作用。由于 CK1 在真核生物中高度保守,研究者使用新鉴定的 CK1 底物motif搜索了水稻、小鼠和人蛋白质数据库,获得了比目前已知更多的候选底物,拓展了我们对CK1在植物和哺乳动物中功能的理解,推动CK1介导的磷酸化在不同物种中的机制研究。
-
带你从零学单片机lcd,led2012-08-04 3131
-
一个“贪吃蛇”带你进入proteus的世界2013-11-10 8779
-
求大神给一篇关于单片机的外文文献2014-02-26 4583
-
青风带你学蓝牙第一节:蓝牙工程样本详细讲解2017-09-27 13907
-
至芯科技昭哥带你学FPGA之FPGA_100天之旅_AD设计2017-10-25 7183
-
一篇文章带你了解原型制作化技术2021-04-26 2392
-
课程预告丨12月15日官方直播带你领略ArkUI的声明式开发范式之美2021-12-10 2190
-
特性阻抗技术文献八篇2009-10-19 416
-
用LM317组成的扩流电路:能输出20A电流2009-05-13 27703
-
物联网是什么,一文带你了解物联网2022-03-23 5076
-
Endnote 20 for Windows使用指南2023-03-29 338
-
一起云逛展,带你感受英特尔开源前沿技术的魅力!2023-06-17 936
-
java内部类可以用public修饰吗2023-11-21 1797
-
领略ESP32芯片的科技魅力:C6与S32025-01-26 4102
全部0条评论

快来发表一下你的评论吧 !

