

一种用于富集循环肿瘤细胞的螺旋微流控芯片设计
描述
循环肿瘤细胞(CTCs)被认为是最有前景的液体活检生物标志物之一,可用于在治疗监测和癌症管理过程中获得肿瘤演变的实时信息。然而,虽然循环肿瘤细胞具有巨大的应用潜力,但是其目前在临床实践中的应用主要局限于预后分层和监测。从外周血细胞中高效地分离数量稀少的循环肿瘤细胞仍然是阻碍其在常规临床实践中广泛应用的主要挑战,因为这一挑战限制了对循环肿瘤细胞的灵敏识别和表征分析。
据麦姆斯咨询报道,为了解决上述挑战,来自土耳其微型生物系统公司(Mikro Biyosistemler A.S.)和中东技术大学(Middle East Technical University)等机构的研究人员提出了一种新颖的螺旋微流控通道设计。首先,该微流控通道的前端被设计为双阿基米德螺旋形状。其次,研究人员采用二维(2D)数值模拟设计了具有不对称水翼形状的连续流线型微柱的加宽出口。这种单入口、双出口的微流控通道能够实现高通量(1500 μL/min)操作,而且无需在入口处使用鞘流,从而简化了整体操作。相关研究成果近期以“Analytical Validation of a Spiral Microfluidic Chip with Hydrofoil-ShapedPillars for the Enrichment of Circulating Tumor Cells”为题发表在biosensors期刊上。
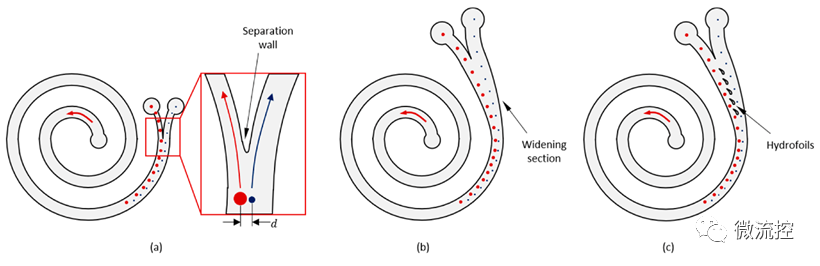
图1 (a)出口部位有分离壁的典型阿基米德螺旋微流控通道;(b)出口部位加宽的螺旋微流控通道;(c)出口部位加宽并带有水翼的螺旋微流控通道
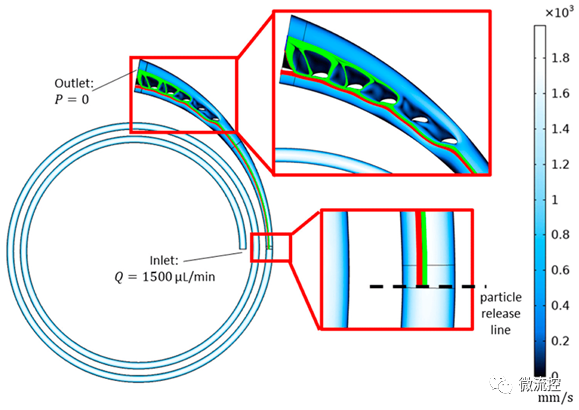
图2 带有水翼的加宽出口部位的二维数值模拟分析
为了验证这种螺旋微流控通道设计(5H-50)的有效性,研究人员利用5 mL加标了100个MCF-7细胞(人乳腺癌细胞)的健康血液样本对其与两种基准设计(第一种:出口部位无加宽通道和水翼结构的螺旋微流控通道设计(BARE);第二种:出口部位有加宽通道但无水翼结构的螺旋微流控通道设计(BARE-W))进行了对比测试。
测试结果证明,在流速为1500 µL/min的情况下,基于5H-50设计的微流控芯片在MCF-7细胞回收率方面明显更胜一筹(其回收率为67.9%;基于BARE设计的微流控芯片的MCF-7细胞回收率为23.6%;基于BARE-W设计的微流控芯片的MCF-7细胞回收率为56.7%),但其白细胞(WBC)耗尽率却略低(其耗尽率为94.2%;基于BARE设计的微流控芯片的白细胞耗尽率为98.6%;基于BARE-W设计的微流控芯片的白细胞耗尽率为94.2%)。
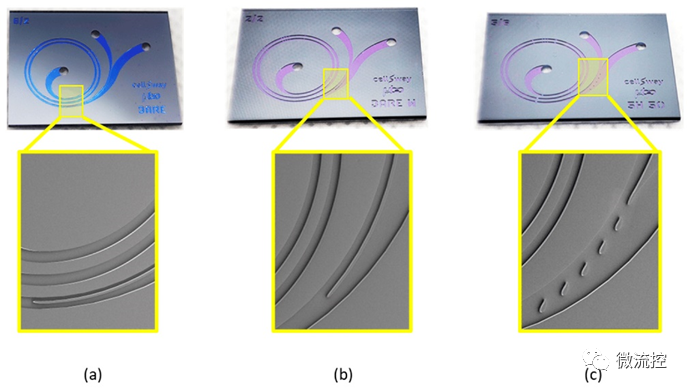
图3 利用微加工工艺制备的硅-玻璃基微流控芯片:(a)基于BARE设计的微流控芯片及其通道结构的扫描电子显微镜(SEM)图像;(b)基于BARE-W设计的微流控芯片及其通道结构的SEM图像;(c)基于5H-50设计的微流控芯片及其通道结构的SEM图像
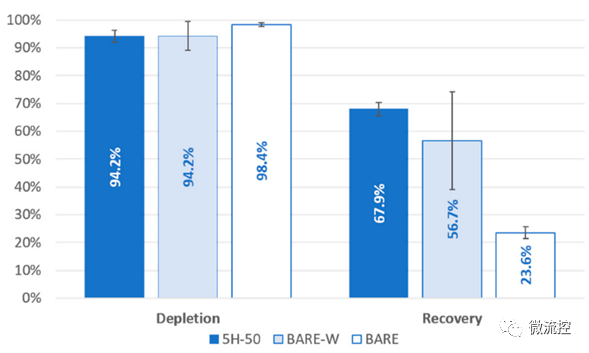
图4 加标实验中,基于5H-50、BARE-W和BARE设计的微流控芯片的白细胞损耗率和MCF-7细胞回收率
随后,为了进一步验证这种螺旋微流控通道设计(5H-50)的广泛适用性,研究人员分别利用A549(肺癌细胞)、SKOV-3(卵巢癌细胞)和BT-474(乳腺癌细胞)细胞对该设计进行了进一步测试。测试结果显示,基于5H-50设计的微流控芯片对3种细胞的回收率分别为62.3% ± 8.4%、71.0% ± 6.5%和82.9% ± 9.9%。该结果与各细胞的大小和变形性差异有关,即细胞的尺寸增大和变形性减小会对回收率产生正向影响。
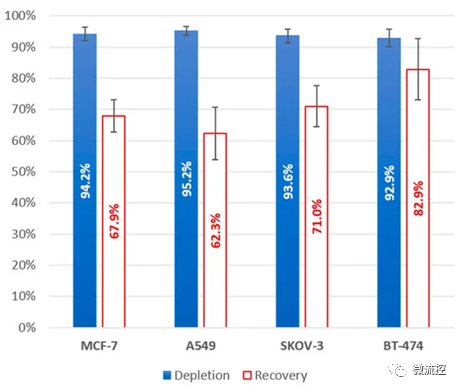
图5 基于5H-50设计的微流控芯片对健康血液样本(5 mL)中加标的MCF-7(n = 8)、A549(n = 5)、SKOV-3(n = 7)和BT-474(n = 5)细胞的回收率
最后,研究人员对经过该螺旋微流控芯片处理前后的细胞进行了分析,分析结果表明,细胞活性未受影响。此外,通过利用这种螺旋微流控芯片以及第二代测序技术(NGS)、免疫荧光和荧光原位杂交/RNA-原位杂交(FISH/RNA-ISH)技术,可以在单细胞水平上对循环肿瘤细胞的DNA、蛋白质和基因表达水平进行快速、精确的表型表征。
展望未来,研究人员的下一步工作主要为利用乳腺癌和非小细胞肺癌患者的血液样本对所设计的螺旋微流控芯片进行下一步的验证研究。此外,研究人员还将致力于循环肿瘤细胞富集工作流程的自动化,以减少手动操作时间,并使其更好地适用于临床实验室中已开发的工作流程。随着其以标准化方式识别循环肿瘤细胞上相关生物标记物的能力得到验证,该工作流程有望通过生成临床可操作数据,用于患者随访、治疗指导和精准医疗,从而在揭示循环肿瘤细胞的临床效用方面更进一步。
审核编辑:刘清
-
基于细胞微流控的阻抗测试解决方案2025-07-02 1099
-
Aigtek高电压放大器微流控细胞筛选测试2025-01-20 726
-
基于磁性探针的级联相转移微流控芯片用于循环肿瘤细胞检测2024-01-16 2621
-
一种用于测量单细胞瞬态响应的封闭式微流控芯片2023-08-03 758
-
微流控芯片在液体活检中的应用2023-07-25 1147
-
利用微流控芯片高通量收集血液中的循环肿瘤细胞检测癌症2023-07-21 5314
-
宽带功率放大器基于微流控技术的细胞分选的应用2023-04-27 1132
-
一种高效的微流控细胞芯片,通过快速筛选允许细胞实现病毒的分离和培养2022-06-07 4443
-
一种基于微流控的微型肿瘤芯片2022-05-19 2269
-
虹科案例|使用SPECTRA光引擎检测循环肿瘤细胞2021-09-13 1378
-
基于NI嵌入式控制器实现检测和分离循环肿瘤细胞研究2021-04-19 2816
-
微流控芯片单细胞克隆形成抑制实验用于乳腺癌干细胞特异性药物筛选2019-06-20 6403
-
一种用于外泌体分离富集和检测的微流控芯片2018-12-31 5345
全部0条评论

快来发表一下你的评论吧 !

