

三种典型的金属晶体结构
描述
三种典型的金属晶体结构
最常见的金属晶体结构有面心立方结构、体心立方结构和密排立方结构
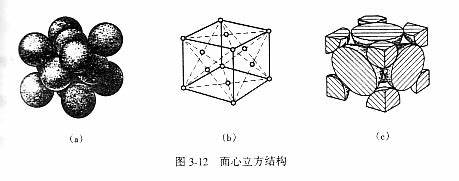
1.面心立方结构:晶胞是一个立方体,原子分布在立方体的各结点和各面的中心上。铝、铜、镍、γ铁等都是面心立方结构。
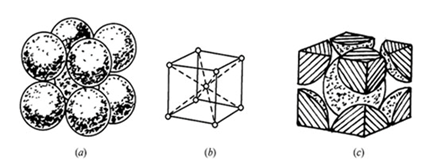
2.体心立方结构:其晶胞是一个立方体,原子分布在立方体的各结点和中心上。铬、钼、钨、钒、铌、α铁等都是体心立方结构。
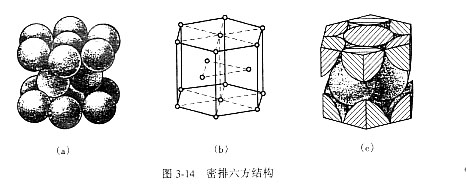
3.密排六方结构:晶胞是一个六方体,原子除分布在六方柱的各结点及上下两面的中心处之外,在六方柱体中间还有三个原子。锌、镁、铍、镉等都属密排六方结构。
体心立方结构
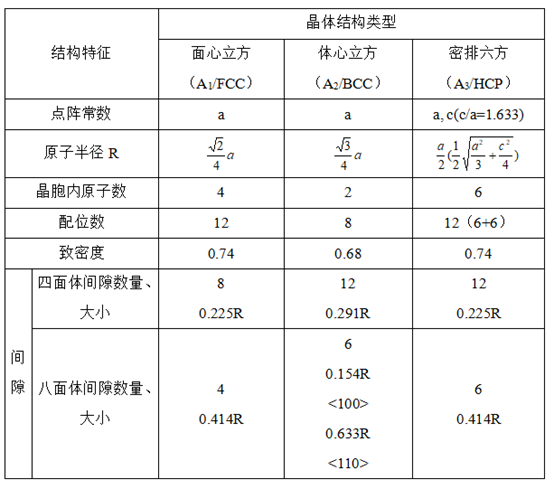
三种典型金属结构的晶体学特点
晶胞中的原子数:
晶胞顶角处为几个晶胞所共有,而位于晶面上的原子也同时属于两个相邻的晶胞,只有在晶胞体积内的原子才单独为一个晶胞所有。故三种典型金属晶体结构中每个晶胞所占有的原子数为:
面心立方结构 n =8*(1/8)+6*(1/2)=4
体心立方结构 n=8*(1/8)+1=2
密排立方结构 n=12*(1/6)+2*(1/2)+3=6
点阵常数和原子半径:
晶胞的大小一般是由晶胞的棱边长度(a,b,c)即点阵常数(或称晶格常数)衡量的,它是表示晶体结构的一个重要的基本参数。
面心立方结构:点阵常数为a,√2a=4R
体心立方结构:点阵常数为a,且√3a=4R
密排立方结构:点阵常数由a和c表示。在理想情况下,即把原子看作等径的刚球,可算得c/a=1.633
配位数和致密度:
晶体中原子排列紧密程度与晶体结构类型有关,通常以配位数和致密度两个参数来描述晶体中原子排列的紧密程度。
所谓配位数(CN)是指晶体结构中任一原子周围最近邻且等距离的原子数,而致密度是指晶体结构中原子体积占总体积的百分数。如以一个晶胞来计算,则致密度就是晶胞中原子体积与晶胞体积之比值,即
K=nv/V
式中,K为致密度,n为晶胞中原子数,v是一个原子体积。这里将金属原子视为刚性等径球,故v=4πR3/3,v为晶胞体积
晶体的原子堆垛方式和间隙
晶体的原子堆垛方式和间隙是晶体学中重要的概念。
晶体是由原子、离子或分子组成的有序结构,其原子堆垛方式决定了晶体的物理性质和化学性质。在同一元素或化合物形成的不同晶体中,原子的排列方式也是不同的,这种不同的排列方式称为晶体的晶体结构类型。
晶体结构有三种基本的原子堆垛方式:立方堆垛、六方堆垛和四方堆垛。
立方堆垛是指原子沿着等间距的方格状排列;六方堆垛是指原子沿着六边形状排列;四方堆垛是指原子沿着正方形状排列。这三种堆垛方式都有各自的优点和缺点,因此在不同的晶体结构中都有所应用。
晶体的间隙是指原子排列时的空隙或孔洞。这些间隙可以用来存储其他原子、离子或分子,从而影响晶体的物理性质和化学性质。
一些晶体结构具有很大的空隙,如金刚石晶体中的孔洞就可以容纳其他原子进入,这使得金刚石成为众所周知的硬度极高的材料。
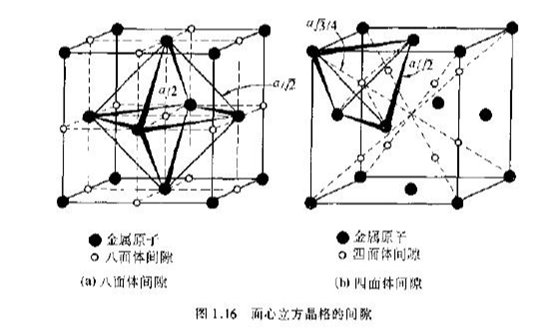
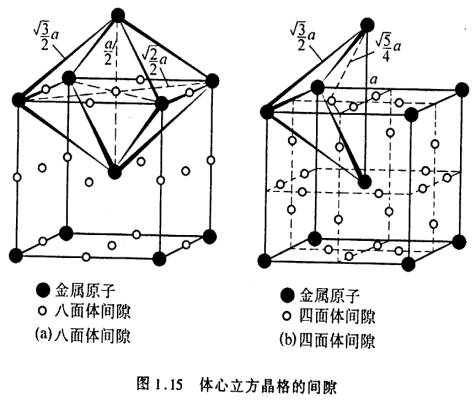
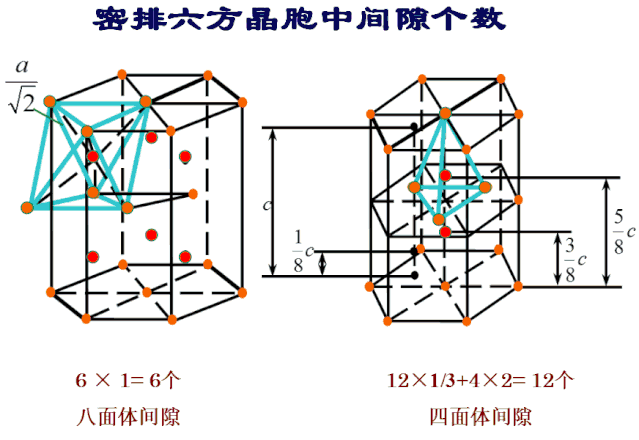
其中位于6个原子所组成的八面体中间的间隙称为八面体间隙,而位于4个原子所组成的四面体中间的间隙称为四面体间隙。图中实心圆圈代表金属原子,另其半径为rA,空心圆圈代表间隙,另其半径为rB,rB实质上表示能放入间隙内小球的最大半径。
审核编辑:汤梓红
-
晶体结构中晶面和晶向的关系2025-06-05 3207
-
一文解析X射线粉末衍射晶体结构2024-11-26 3826
-
深度了解SiC的晶体结构2024-11-14 8656
-
晶体管的三种工作状态2024-05-28 3650
-
晶体管的三种基本接法是什么2023-08-25 8861
-
氮化镓(GaN)的晶体结构与性质2023-04-29 33287
-
三极管的基本结构,晶体三极管的三种工作状态2020-12-25 11155
-
富士通公司研发可增加电流和电压的晶体结构,输出功率增加三倍。2018-08-24 4377
-
晶体结构的基本概念2017-08-25 2789
-
vb程序的三种基本结构22016-09-01 801
-
金属的晶体结构2009-08-06 7849
全部0条评论

快来发表一下你的评论吧 !

