

百篇文献汇总精华!单细胞高级分析(四)
描述
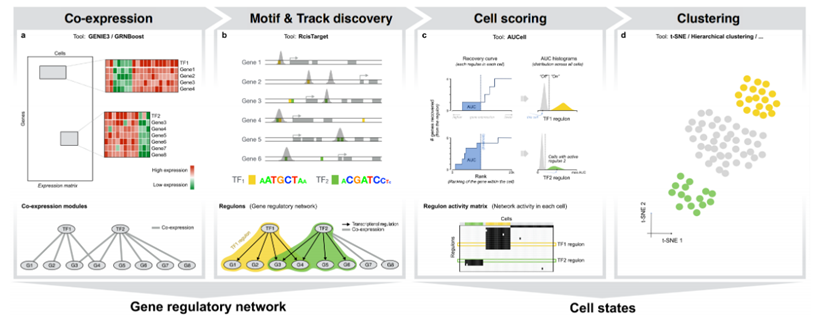
细胞的转录状态来自于一个潜在的基因调控网络(GRN),在这个网络中,有限数量的转录因子和辅助因子相互调控,并调控它们的下游靶基因。组织内细胞异质性的基础是细胞转录状态的差异,转录状态的特异性又是由转录因子主导的基因调控网络所决定并维持稳定的。因此分析单细胞的GRNS有助于深入挖掘细胞异质性背后的生物学意义。
2017年发表在Nature Methods杂志上的SCENIC算法,利用scRNA-seq数据,同时进行基因调控网络重建和细胞状态鉴定,应用于肿瘤和小鼠大脑单细胞图谱数据,提出并证明了顺式调控网络分析能够用于指导转录因子和细胞状态的鉴定。SCENIC(single-cell regulatory network inference and clustering)官网:https://scenic.aertslab.org/ ,是一款分析转录因子活性的软件,其可基于单细胞转录组数据来推断转录因子、基因调控网络和细胞类型。SCENIC分析的核心是利用motif enrichment将候选TF调控因子与候选靶基因连接起来。此软件目前配置了人、小鼠、果蝇数据库,其他物种需要自己构建数据库。
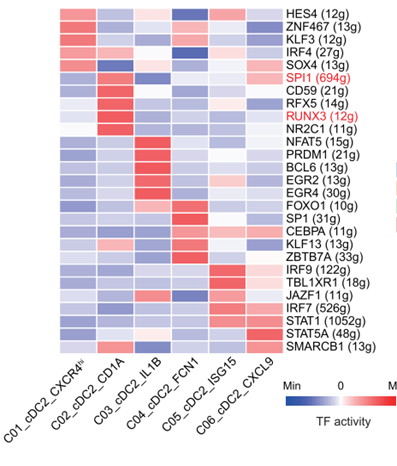
我们统计发现百篇文献中近20%的文献中存在此次分析结果,共出现33次,文献中的出现的结果如下:
这是我们复现结果,如下:使用AUCell算法来对每个细胞中的每个regulon的活性进行评分。
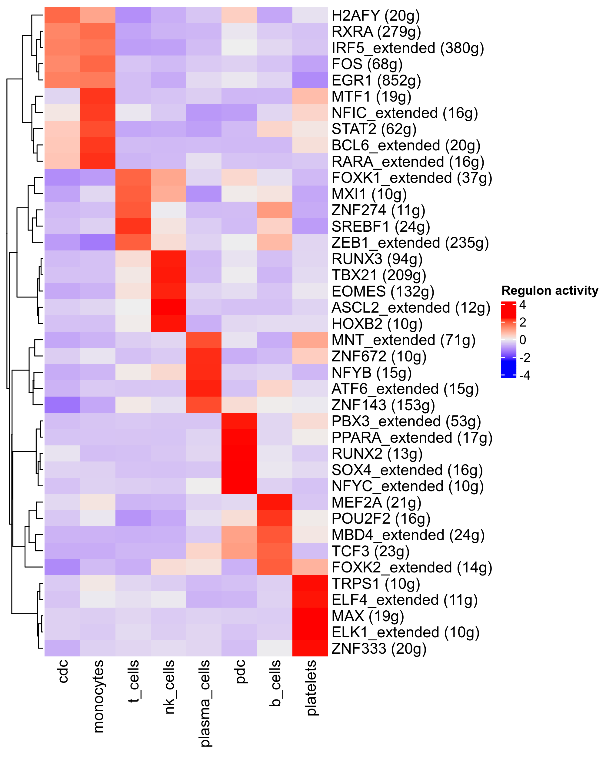
上图为各组细胞中regulons的RAS(regulon activity score)活性热图。行表示不同的regulon,列表示不同的细胞,颜色越红代表RAS活性得分越高,进而表示regulon在该组中的活性越强。
除了展示转录因子在不同亚群的活性,我们还可以挑选各个单细胞亚群特异性的转录因子构建特异性热图,各组中regulons的RSS(regulon specificity score)特异性热图展示如下:
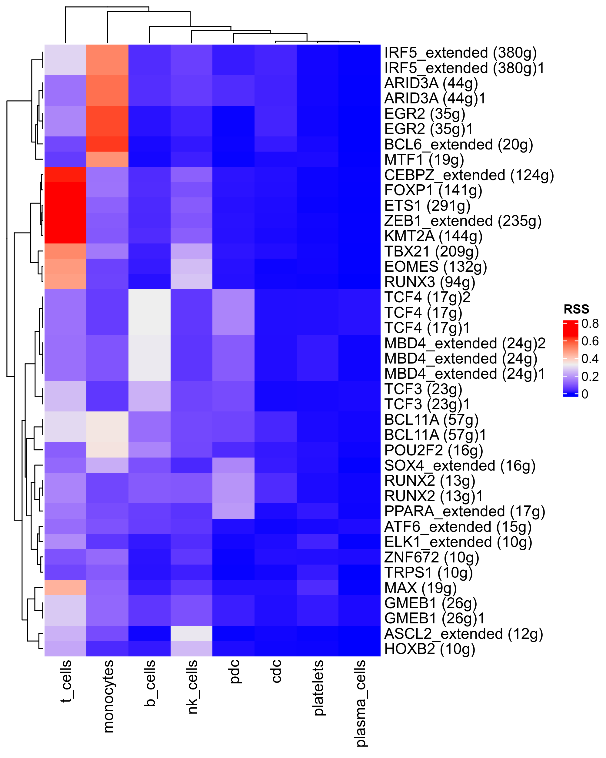
行表示不同的regulon,列表示不同的组别,颜色越红代表RSS特异性得分越高,进而表示regulon在该组中的特异性越强。 我们还可以用散点图来展示每个亚群中转录因子的特异性排序,各组regulons特异性排序图结果如下:
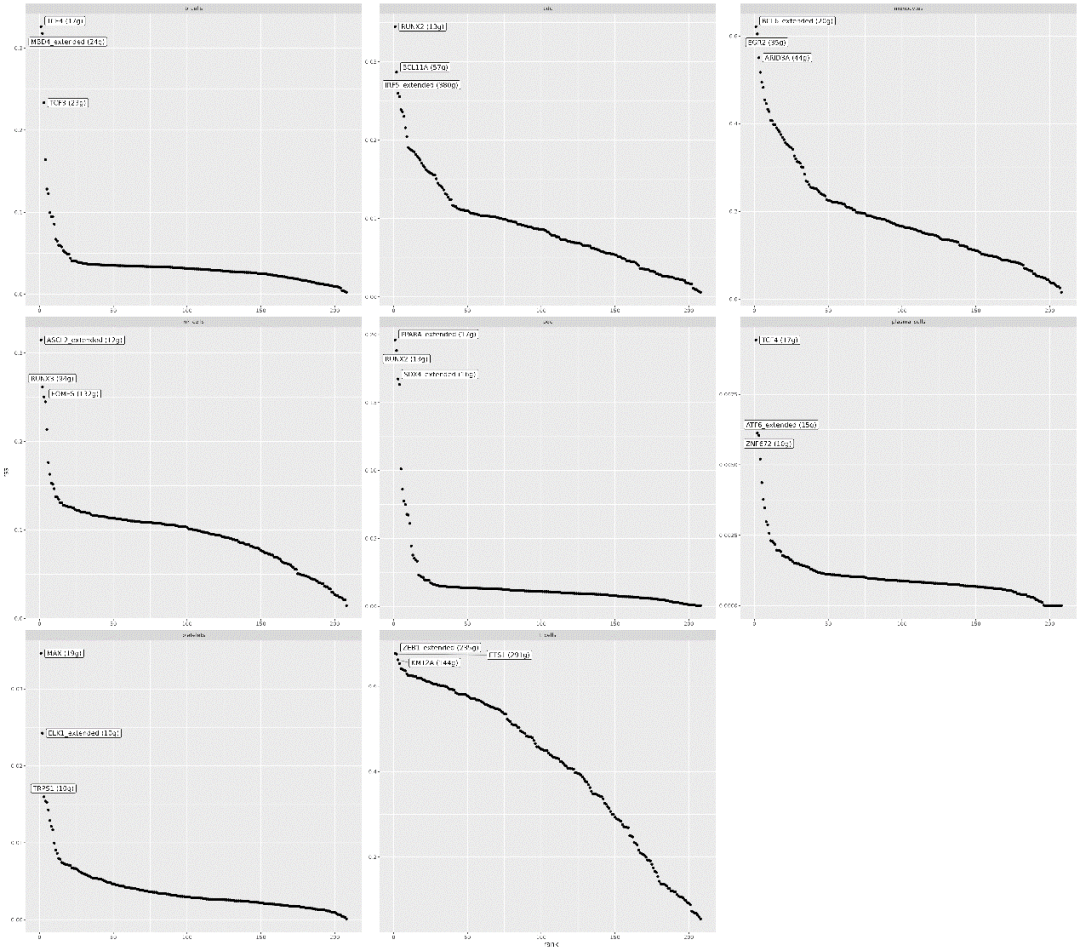
横坐标表示排名,纵坐标表示RSS得分,RSS越高的调控子可能与该细胞群特异性相关,带标签的点代表RSS得分top3的regulon。 为了更好地展示研究成果,可以将我们所关注的在特定亚群中特异性表达的转录因子单独画FeaturePlot展示图,结果如下,这样得到的可视化结果更容易与我们之前的分析联系起来。
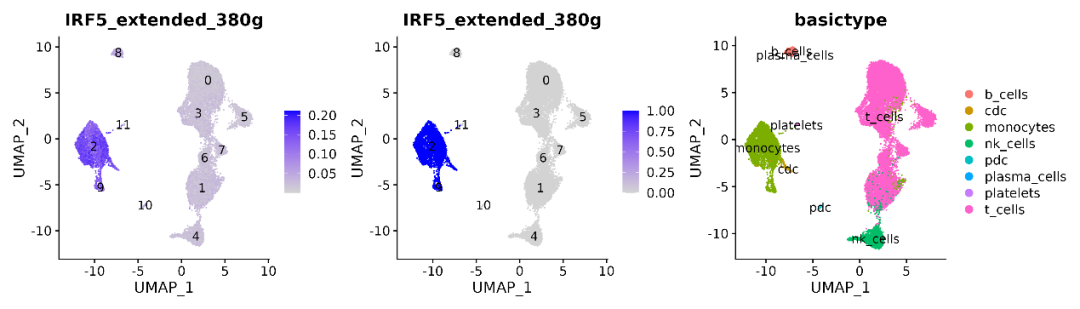
左一为转录因子原始AUC表达分布,左二为转录因子标准化AUC表达分布,右一为单细胞数据按照细胞类型的分群结果。可以看到转录因子在monocytes亚群和cdc亚群中高度表达。 然后,我们通过RAS来计算不同regulon之间的相关性系数(PCC, Pearson Correlation Coefficient),基于PCC,计算了CSI(Connection Specificity Index)来衡量regulon pairs之间的相关性,构建Regulon模块的CSI(connection specificity index)关联性聚类热图,展示结果如下:
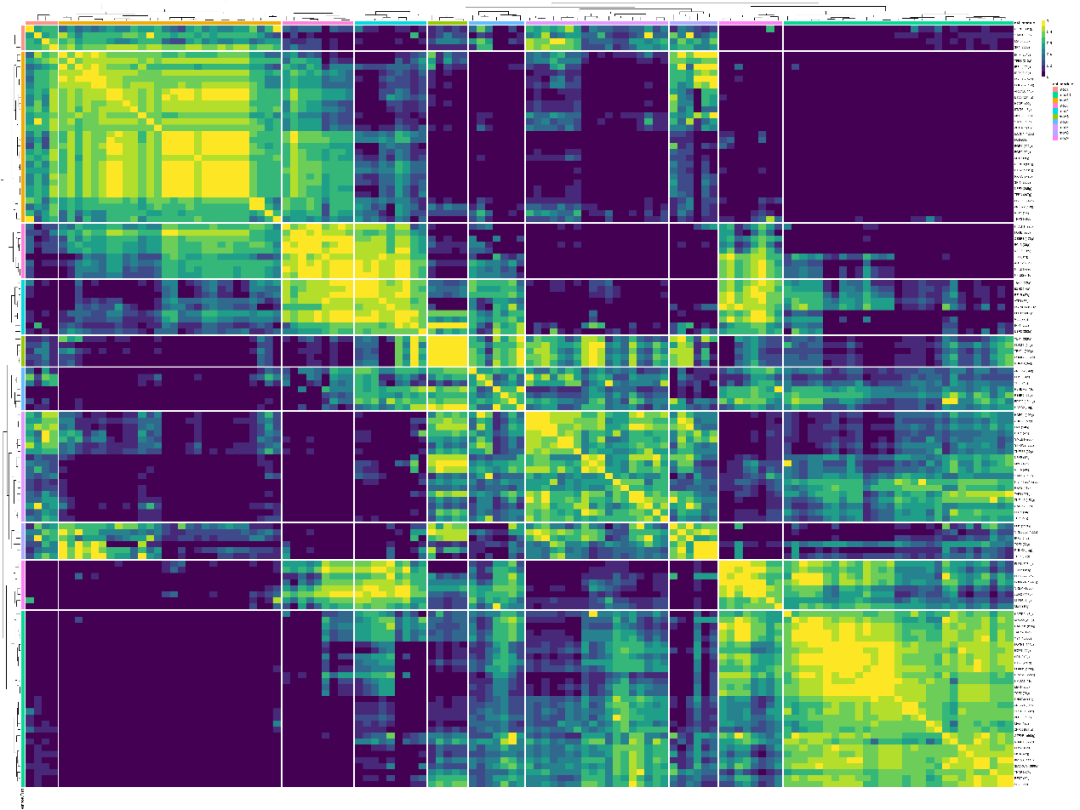
行、列均表示regulon,颜色越黄表示CSI关联性越高,CSI都高的regulon可能具有相似的细胞功能,共同调控下游基因。
我们也可以提取所关注的转录因子单独构图,可以得到以下结果:
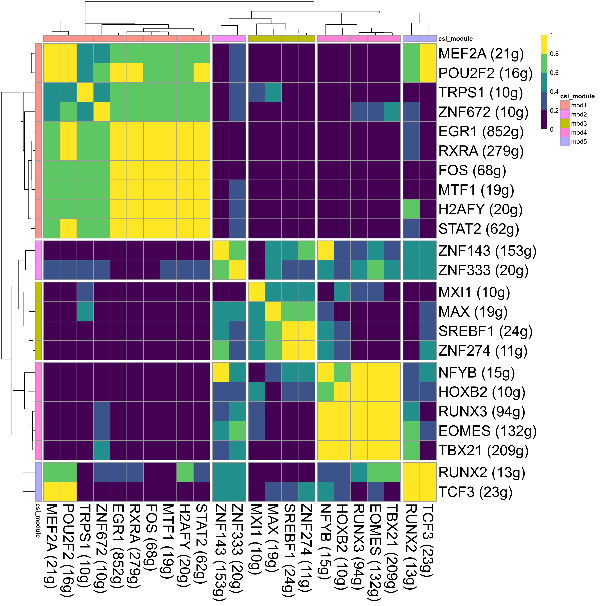
以上为本次单细胞测序高级分析SCENIC分析的结果,其他高级分析且听下回分解。
-
单细胞分析仪中步进电机的定位控制_金路2017-01-17 813
-
微流控芯片在单细胞捕获中的应用2019-04-08 9258
-
什么是高通量单细胞RNA测序技术?2019-04-25 10863
-
微流控芯片单细胞克隆形成抑制实验用于乳腺癌干细胞特异性药物筛选2019-06-20 6379
-
高通量多通道的单细胞测序设备,将投入医疗科研应用2020-04-01 2179
-
厦门大学研发出全新高通量单细胞转录组测序方法2020-06-02 4257
-
单细胞转录组学技术的十年2020-09-23 4506
-
“解码”单细胞测序的故事2021-03-17 2764
-
高级创意,单片机电子DIY制作精华资料汇总2021-11-04 979
-
基于微流控平台的单细胞通讯研究进展2022-11-29 1647
-
CellTrek单细胞空间转录组联合分析2023-04-01 3345
-
可用于单细胞分析的选择性液滴提取微流控装置2023-04-10 1697
-
北京基因组所开发出新型高通量单细胞多组学技术2023-04-20 1912
-
使用 RAPIDS 进行更快的单细胞分析2023-07-05 1354
-
一种用于微液滴中单细胞无标记分析的液滴筛选(LSDS)方法2024-03-26 1181
全部0条评论

快来发表一下你的评论吧 !

