

用于可穿戴和可植入生物电子学的可拉伸石墨烯-水凝胶界面
描述
可穿戴和可植入生物电子技术能够监测物理、化学以及电生理信号,在人机交互、医疗健康监测、脑机接口、慢性病管理以及药物释放系统等领域具有广泛应用前景。
高性能生物电子器件的构建主要基于柔、软、薄、可拉伸以及生物相容性的导电纳米复合物,并且需与大面积集成制造方法兼容。
多模式激光制造技术集成激光增、等、减材加工形式,凭借高精度、非接触、机理丰富、灵活可控、高效环保、多材料兼容等特点突破传统制造在多任务、多线程、多功能复合加工中的局限,实现跨尺度“控形”与“控性”,为各类生物电子器件的结构-材料-功能一体化制造开辟了新路径。
其中,激光诱导碳化(LIG)技术主要使用激光束对碳含量较高的材料进行定向加热,主要通过光热效应转变为导电碳材料。该技术具有可图案化、设计性强、图案可转印以及可调控的物化特性等优势,已被应用于构建多类生物电子器件。
但是,在实现可拉伸、超薄生物电子集成系统方面,激光诱导碳化技术主要存在两大挑战:
(1) 在转印LIG时,界面机械剥离力限制了弹性体厚度(通常>45 μm)。
(2) LIG与柔弹性聚合物间的杨氏模量差异较大,限制可拉伸本征导电性。
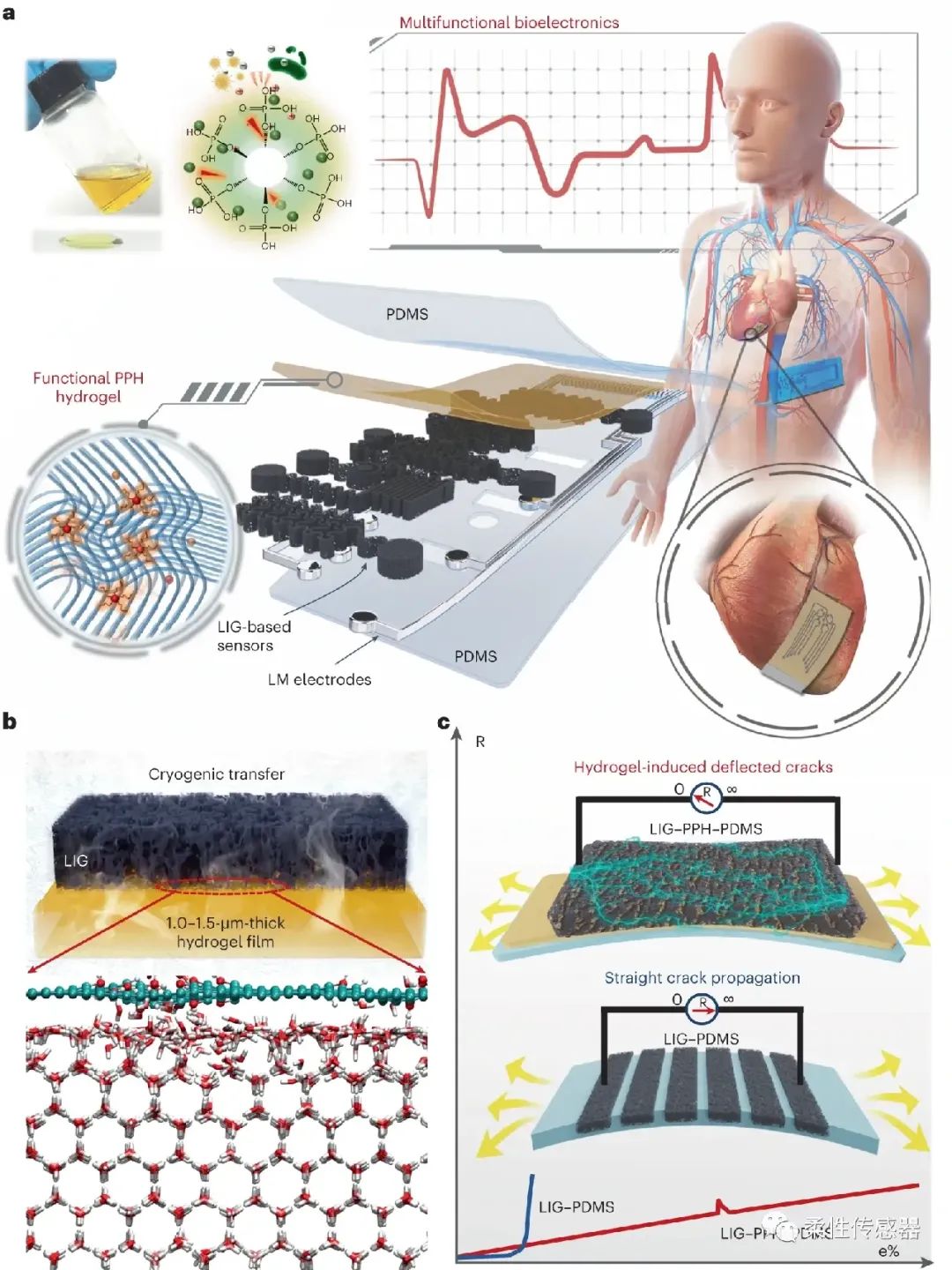
图1:激光诱导可拉伸生物电子界面的设计概念图 近期,浙江大学杨华勇院士团队与药学院顾臻教授团队联合在《Nature Electronics》期刊上发表题为“Stretchable Graphene-Hydrogel Interfaces for Wearable and Implantable Bioelectronics”的研究论文,徐凯臣研究员与顾臻教授为论文通讯作者,浙江大学机械工程学院,流体动力基础件与机电系统全国重点实验室为第一单位。本工作创新点主要包括:
(1)首创激光碳化冷冻转印新工艺,实现在最小 1.5 μm 厚的水凝胶表面的转移,建立LIG在多类水凝胶界面转印的普适性方法。
(2)采用水凝胶作为能量耗散界面与面外电子传输层,诱导贯穿裂纹趋于偏转裂纹,提升LIG本征导电拉伸率约5倍。结合结构设计,导电可拉伸率可达220%(且电阻呈线性变化)。
通过突破上述关键技术,构筑了多功能表皮电子与心脏贴片,实现了体表多模态信号监测以及大鼠心脏电信号的原位监测,观测到大鼠在冠状动脉结扎后的心率失常现象。 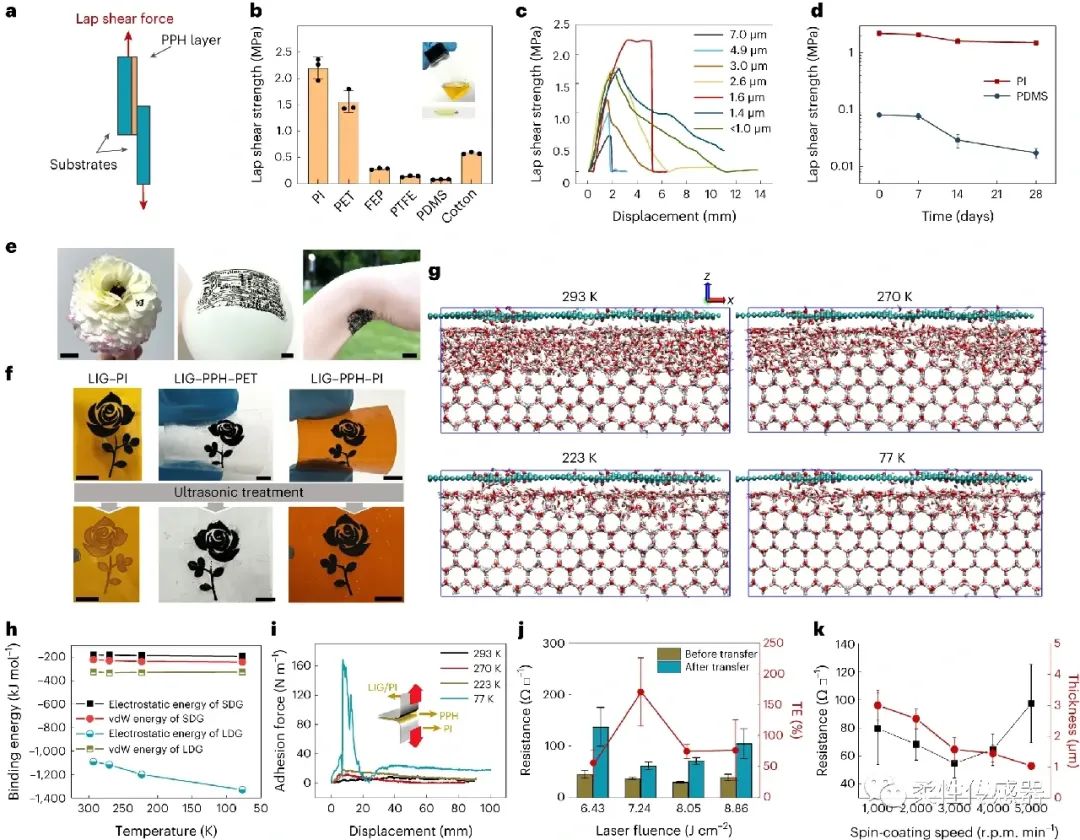
图2:激光碳化冷冻转印,包括转印方法、机理以及影响因素。本工作设计了厚度为1.0~1.5 μm的PPH水凝胶膜作为激光诱导多孔碳转印的骨架材料(~10 μm厚的柔弹性介质为支撑层)。以聚乙烯醇(PVA)、植酸(PA)和天然蜂蜜为原料,制备了具有高粘附性、抗菌性、高生物兼容性的PPH水凝胶。通过分子动力学理论计算结合实验,揭示极端低温诱导转印过程中,界面结合能演变机制。系统探索了激光功率密度、PPH层厚度、以及支撑层的杨氏模量对转移效率的影响。
本工作发明了一种在零下196 ℃环境下,将激光诱导多孔碳从聚酰亚胺(PI)基底上剥离转印到以PPH水凝胶为弹性体界面的方法。在极速冷冻界面,低温膨胀的凝胶与多孔碳部分互嵌,同时富含缺陷位点的激光诱导多孔碳与含结晶水的凝胶表面的界面结合作用被明显增强,保证了剥离过程中界面较强的剪切强度。分子动力学理论计算结合实验验证也证实了界面结合能的演变机制。这两种效应均能促进导电图案完整转印,同时保持良好的界面机械稳定性。
浙江大学博士研究生陆雨姚(机械工程学院),杨赓研究员(机械工程学院),王慎强博士(药学院),张宇琪研究员(药学院)为并列第一作者。顾臻教授团队在抗菌、生物兼容性以及动物实验等方面提供了重要支持。柔性电子学家黄维院士对本工作提供了重要指导。本研究由国家自然科学基金、科技创新2030重大项目、国家重点研发计划、浙江省领军型创新创业团队、浙江省尖兵计划等多个项目资助。
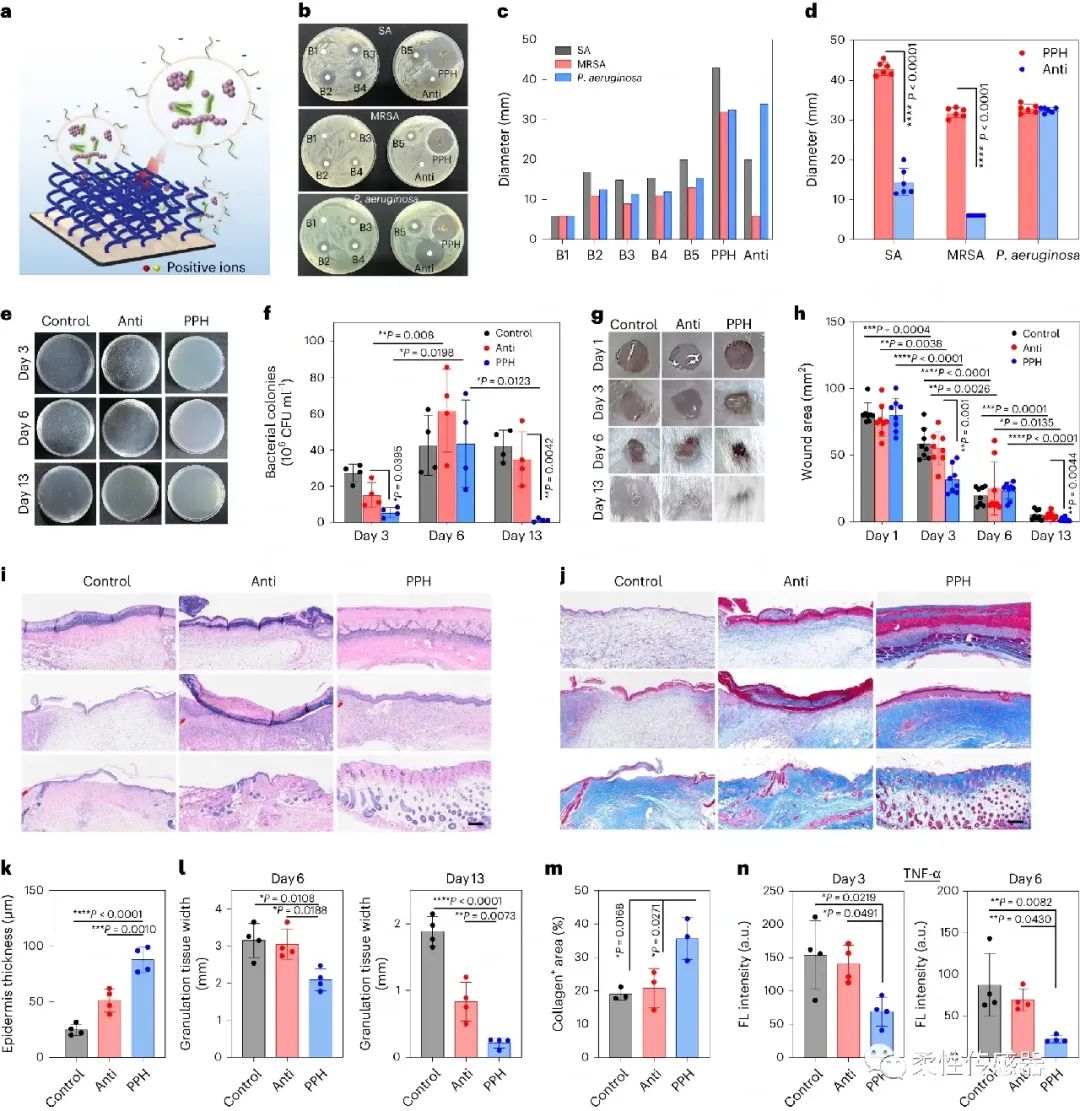
图3:抗菌与生物相容性测试,所提出的PPH水凝胶展示了优异的抗菌性能以及对小鼠伤口的愈合性能,且转移激光诱导碳化基质后,复合物性能几乎不受影响。 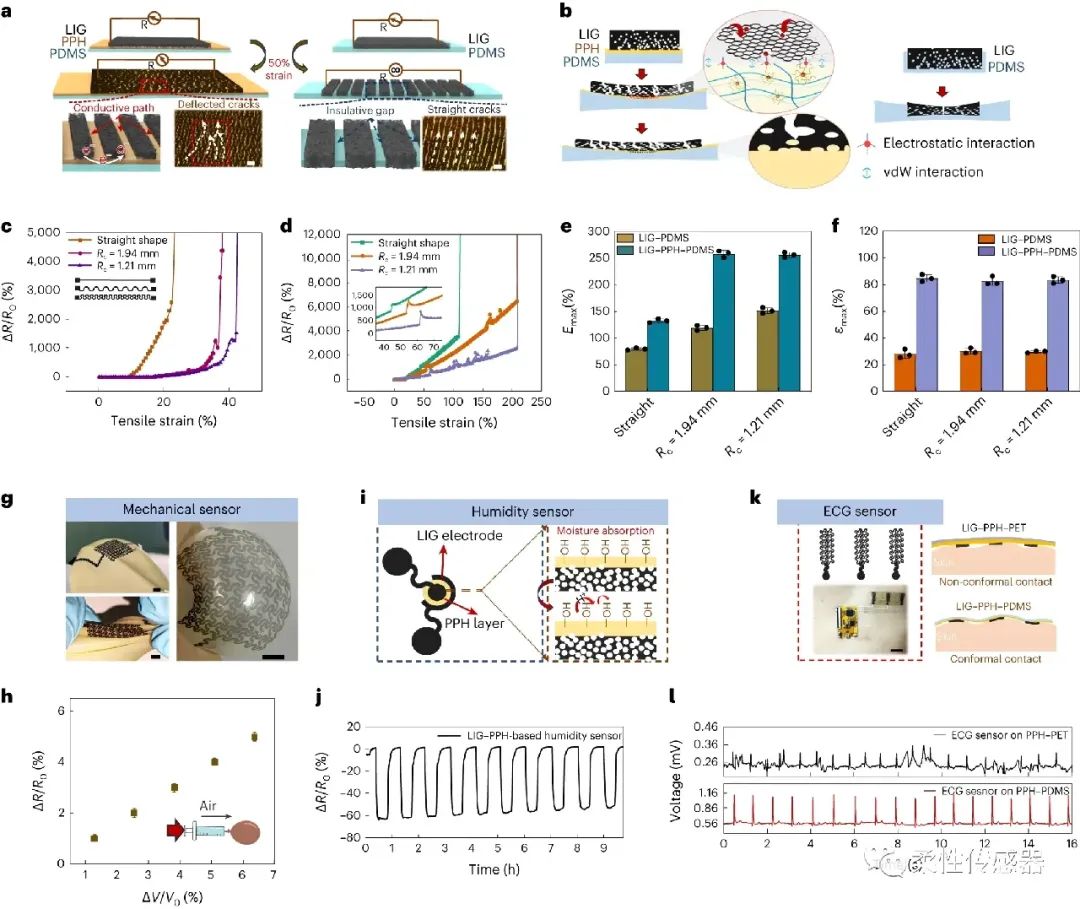
图4:基于激光诱导碳化与超薄PPH水凝胶复合物,系统研究了有无PPH凝胶薄膜的微裂纹与力电响应变化,构建了力敏、湿敏、温度、心电传感器。
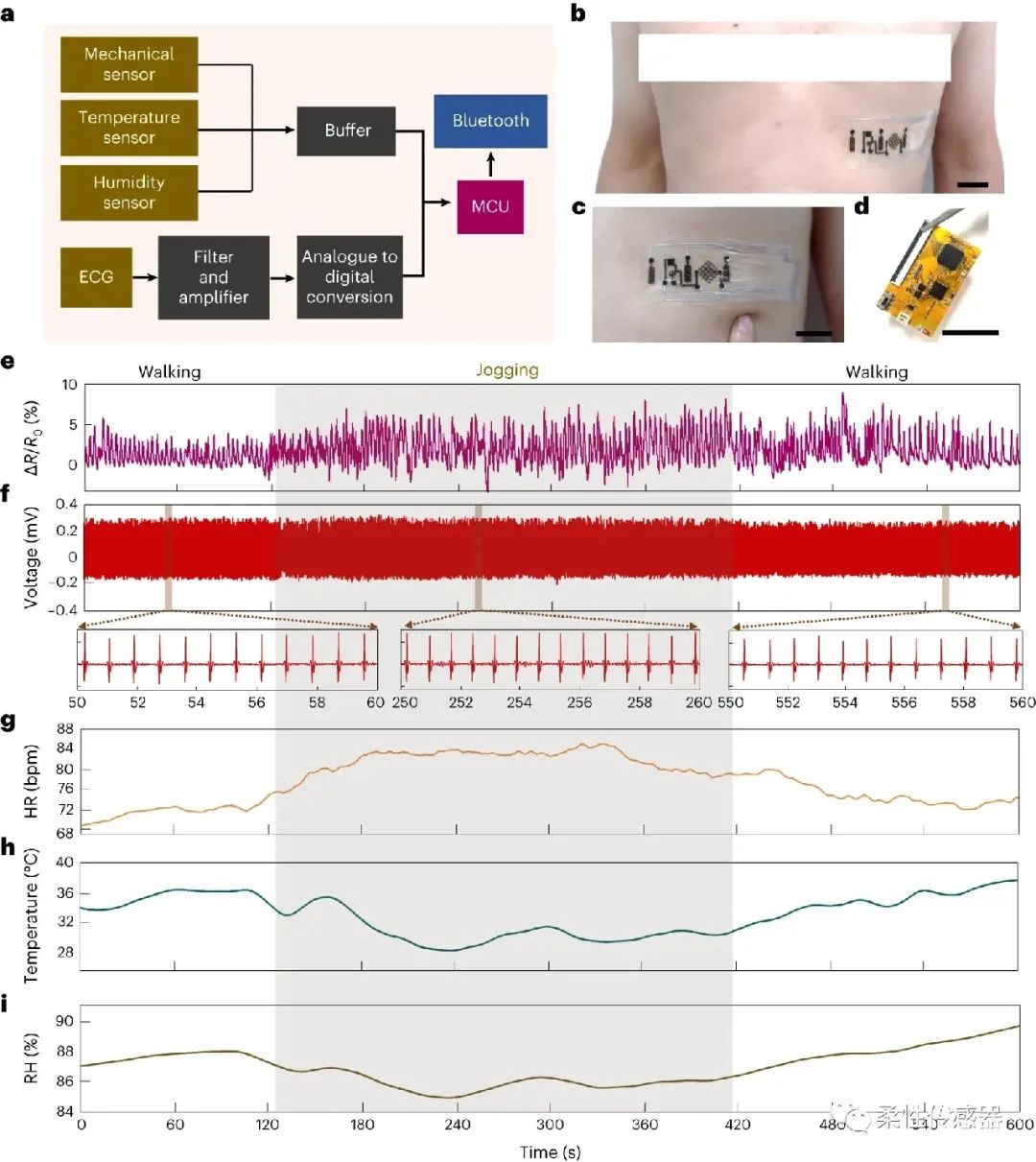
图5:基于激光诱导碳化与PPH水凝胶界面的多功能表皮电子,可实时监测呼吸速率、心电、心率、表皮温度与湿度信号。 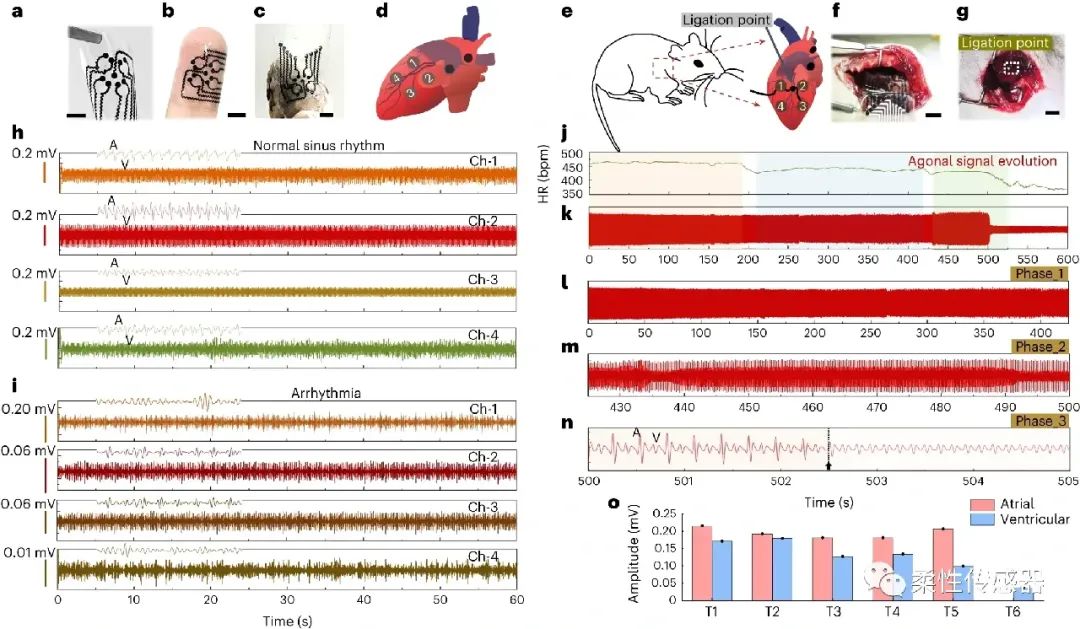
图6:植入式贴片应用于监测大鼠心脏电信号,根据大鼠的心脏大小,定制电极阵列,观测到大鼠在冠状动脉结扎后的心率失常现象。
审核编辑:刘清
-
由3D石墨烯泡沫集成水凝胶实现的固有可拉伸运动传感器2025-02-20 1726
-
3D石墨烯泡沫与水凝胶集成,打造本质可拉伸运动传感器2025-02-11 6207
-
用于多功能表皮电子与心脏贴片的激光诱导可拉伸生物电子界面2024-01-08 2586
-
用于生物组织-电子接口的水响应性自适应可拉伸电极2023-12-28 1758
-
理大研发液态金属微电极 具柔软、透气、可拉伸优点 可用于植入式生物电子装置2023-12-12 1053
-
综述:自愈合水凝胶生物电子器件研究进展2023-11-25 2776
-
可拉伸导电水凝胶用于应变传感研究获进展2023-10-18 1303
-
基于MXene水凝胶实现可穿戴人机交互,用于智能水下通信和传感救援2023-08-21 2205
-
用于柔性瞬态电子的高度可拉伸的弹性体2023-05-05 2106
-
可用于离电型传感器可修复和多种环境适用的水凝胶2023-03-28 2510
-
导电3D打印水凝胶墨水可用于工程定制监控系统2022-08-23 1053
-
韩国研发可拉伸锂离子电池用于可穿戴或可植入人体电子设备中2020-05-07 3715
-
人造皮肤是石墨烯下一个应用方向?2016-01-28 3385
-
可拉伸电子材料终极梦想 革医疗电子的命2012-12-20 3293
全部0条评论

快来发表一下你的评论吧 !

