

复旦大学郝洁/邹欣团队Cell子刊发表单细胞分析新技术用于肿瘤精准免疫治疗
描述
2023年11月,复旦大学邹欣/郝洁团队在Cell Reports Methods 以长文形式发表了题为:“scCURE identifies cell types responding to immunotherapy and enables outcome prediction”的论文,从免疫治疗相关细胞动态异质性的角度提出了一个肿瘤免疫治疗研究新思路。同期,团队在Journal of Translational Medicine 以长文形式发表“Integrative multi-omics analysis unveils stemness-associated molecular subtypes in prostate cancer and pan-cancer: prognostic and therapeutic significance”,使用单细胞和bulk数据整合方式构建基于干性特征的肿瘤分子分型模型,用于预测免疫治疗疗效。
一.
scCURE
单细胞RNA测序(scRNA-seq)显著推进了我们对不同类型细胞如何响应免疫治疗的理解。然而,尽管取得了这些进展,免疫治疗的机制基础和预测模型仍存在不一致性。例如,一些研究报告了不同的细胞亚型与这两个方面分别相关,但没有明确的解释。这些不一致性可能源自未经表征的细胞间异质性。
为了解决这个问题,我们提出了scCURE,利用模式识别建模来区分免疫治疗过程中发生变化和未发生变化的细胞。我们假设这些可能的细胞异质性可以分为两种主要类型:1) 变化的细胞。这些细胞的动态特征反映了患者对免疫治疗的响应方式。2) 未变化的细胞。来自治疗前后样本的这类细胞具有类似的细胞和分子功能,差异主要由无关因素引起,例如批次效应和随机噪声。未变化细胞的基线特征可能提供治疗结果的预测信息。为了捕捉这种异质性,关键在于区分免疫治疗诱导的细胞状态转变和其它无关变化。为了实现这一点,scCURE包括以下主要步骤:1) 分类模型构建。使用期望最大化(EM)方法对治疗前后条件下的细胞分别进行训练,使用预定义的K个高斯模型进行训练。根据最大似然准则,将每个细胞分配给特定的高斯模型。假设数据集由K个亚型/功能类别的细胞组成,在每个亚型/功能类别内,细胞是同质的。因此,每个亚型/功能类别可以建模为一个高斯分布。具有不同参数的多个高斯分布的组合可以用来近似真实世界的单细胞数据。假设高斯模型的数量足够多,可以充分描述细胞异质性,一个高斯模型代表变化或未变化的细胞。2) 变化和未变化细胞的区分。为了区分代表变化和未变化细胞的高斯模型,我们穷尽了治疗前后两个条件之间所有可能的高斯模型对,并计算它们之间的KL散度。如果来自两个条件的一对高斯模型在KL散度方面彼此最接近,那么分配给这两个高斯模型的细胞不应该包含系统性变化,这些细胞被注释为未变化;否则,它们被注释为变化。根据未变化细胞的特征,我们构建了一种免疫治疗预测得分。此外,从变化细胞中解释出的免疫治疗反应/抵抗机制可以与预测模型很好地结合。scCURE的示意图如图1所示。
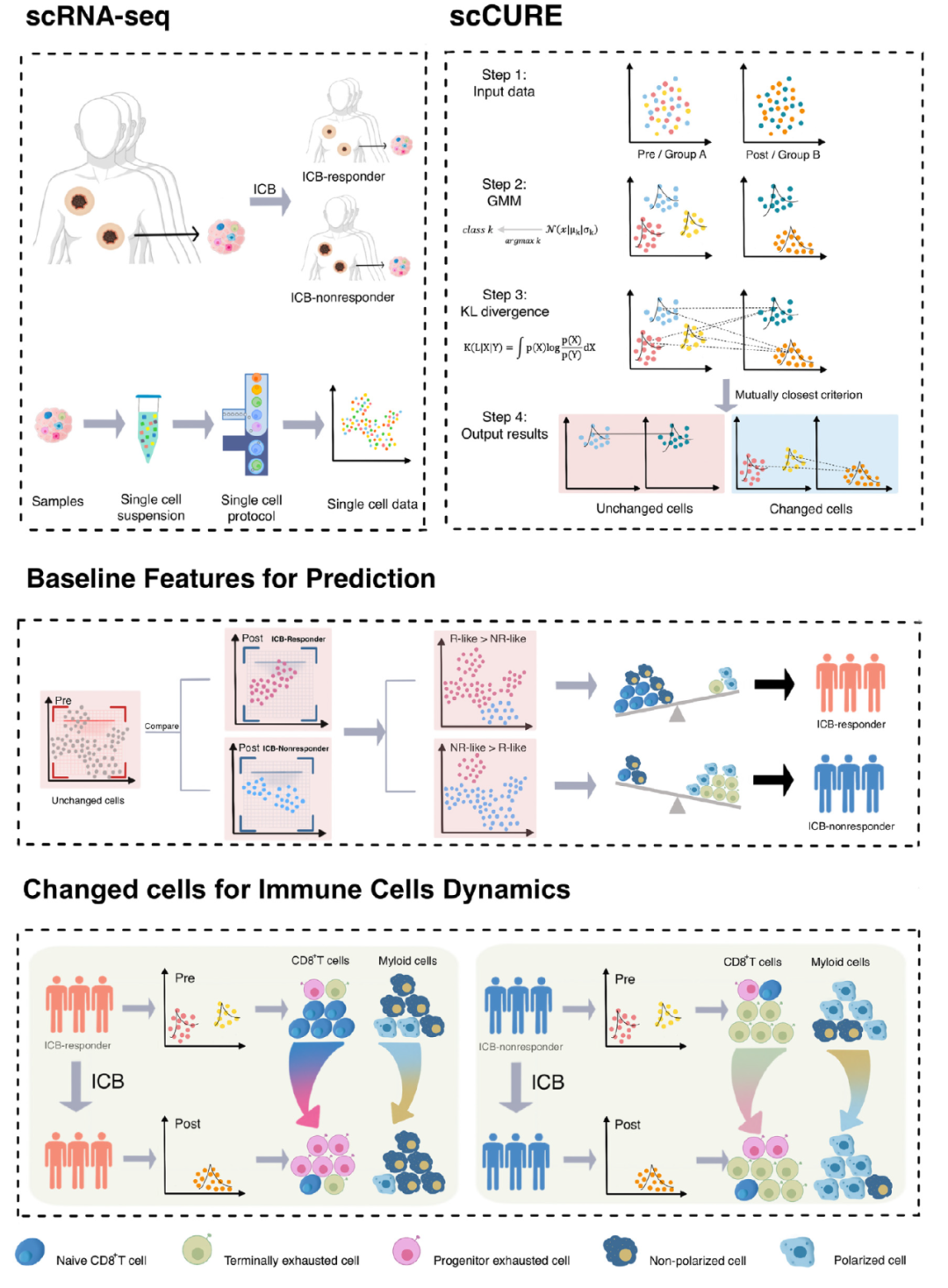
图1. scCURE流程图。
1、模拟数据显示了scCURE的高可靠性
我们比较了已有方法MNN 和CCA,并通过多种度量如PPV、F1 score和AUC等评估不同方法的可靠性。
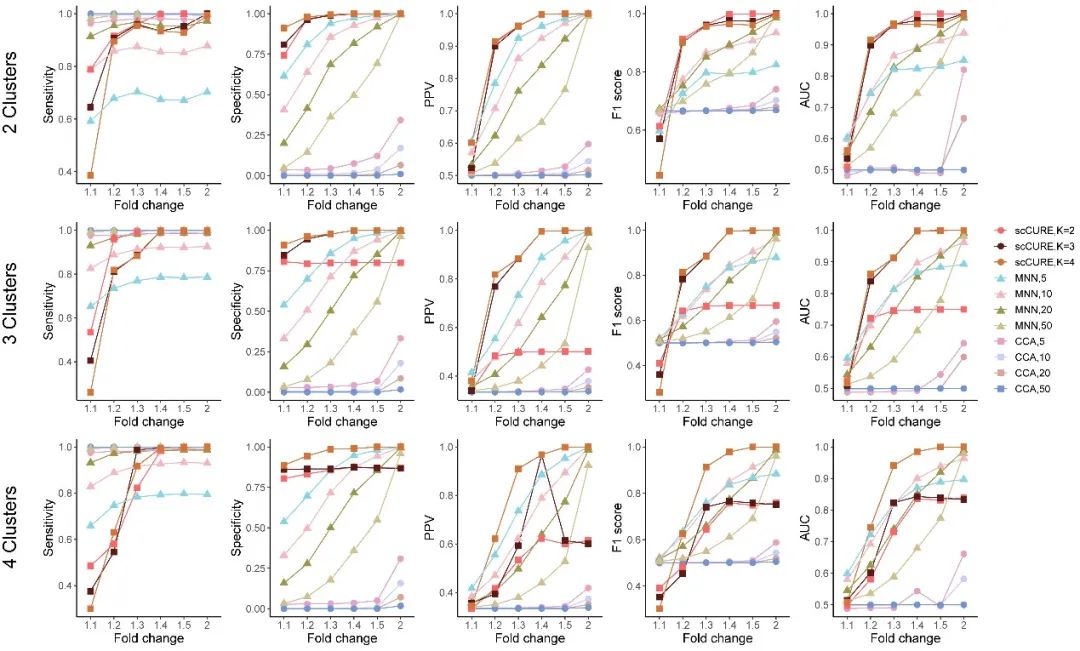
图2. 模拟数据结果显示scCURE在可靠性上明显优于已有CCA和MNN方法。这是构建精准免疫治疗研究模型的保证。
2、基于未变化CD8+ T细胞构建黑色素瘤免疫治疗预测模型
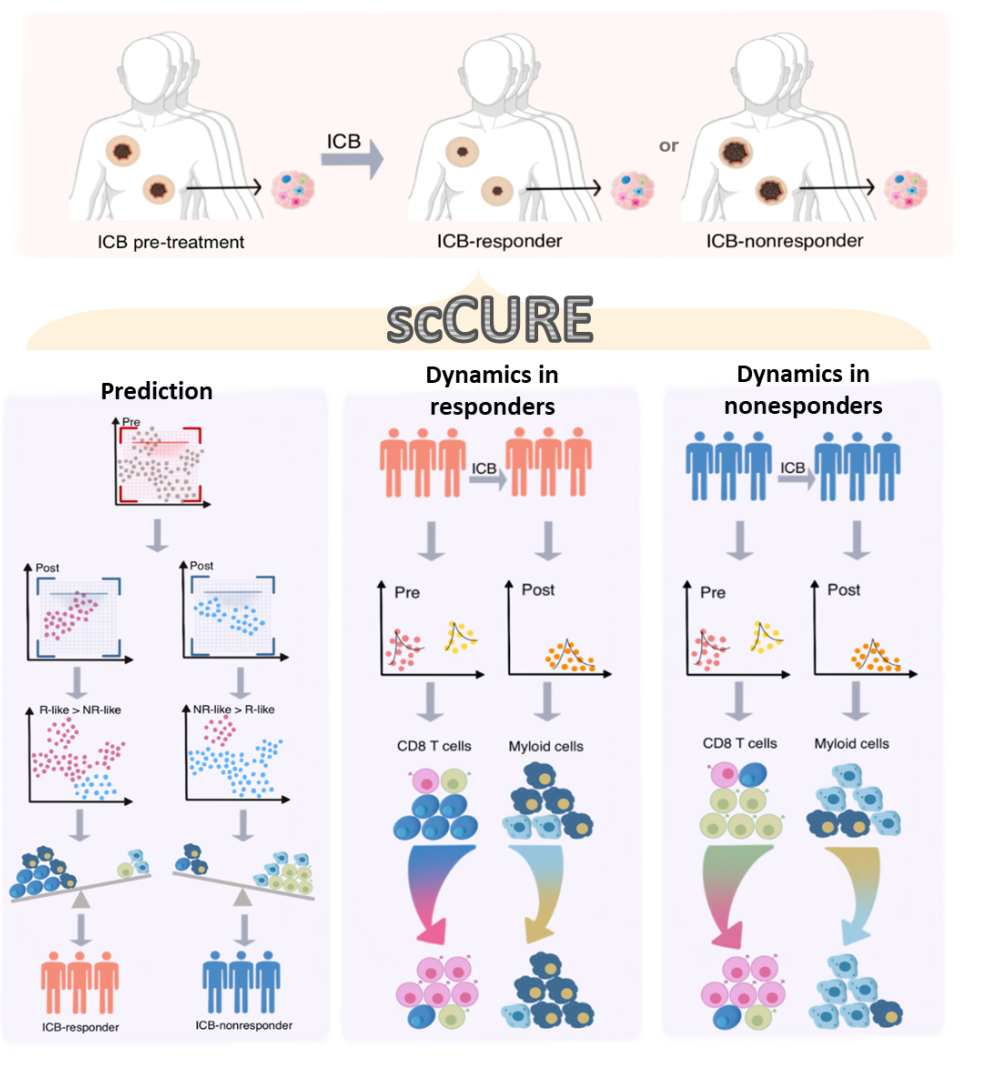
通过分别比较治疗前-治疗后(响应)的样本和治疗前-治疗后(不响应)的样本,scCURE在治疗前的样本中判定出了R-like和NR-like细胞,分别代表响应特征和不响应特征。细胞亚型判定显示R-like主要是naïve型特征,NR-like主要是终末耗竭型特征,这与已有知识相吻合。基于R-like和NR-like细胞比例,在小样本中我们显示了该细胞比例特征具有很好的免疫治疗疗效预测能力(图3E)。
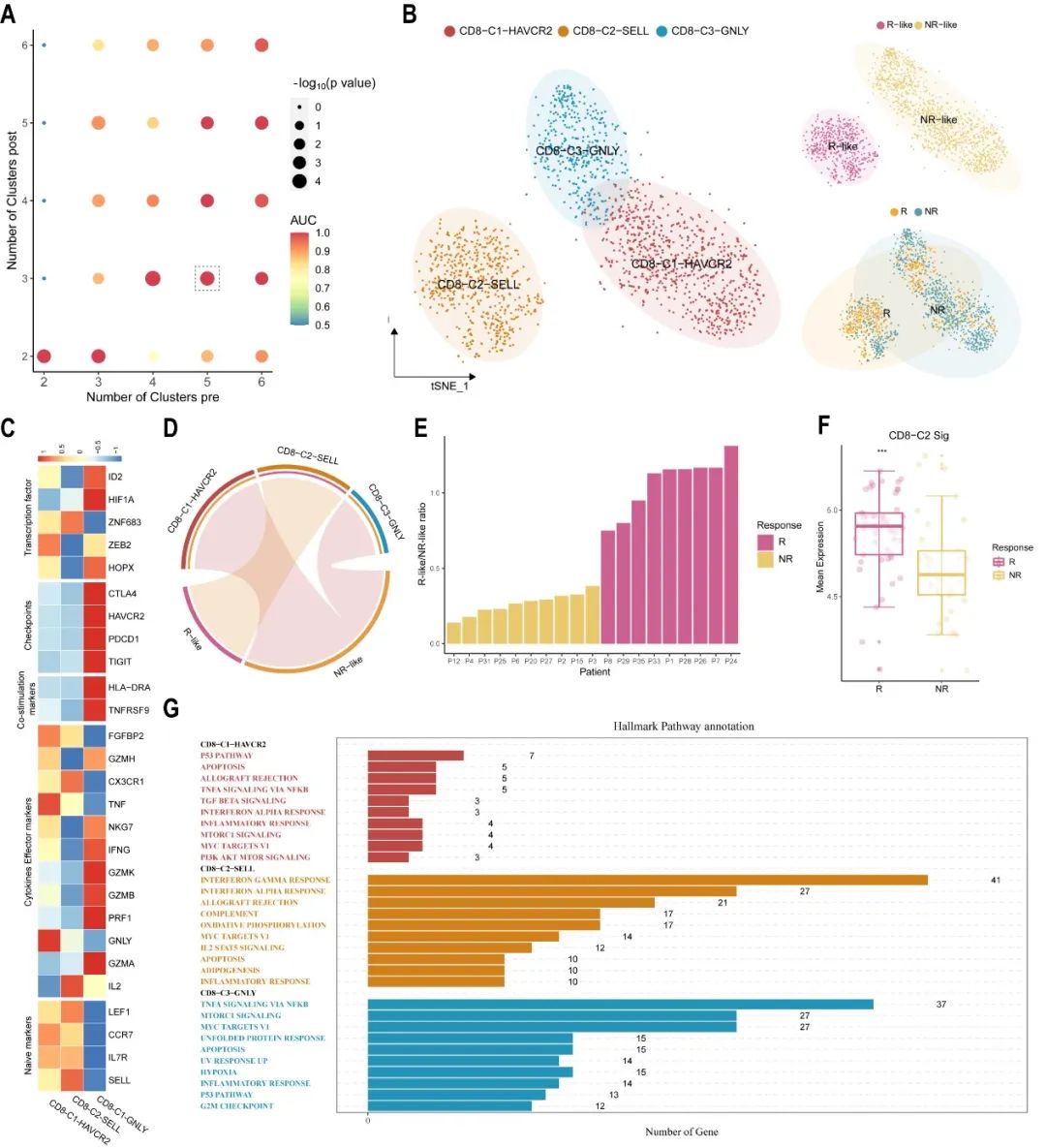
图3. scCURE判定的不变的CD8+ T细胞在基线状态的特征预测免疫治疗疗效。
3、基于变化的CD8+ T细胞进行研究免疫治疗研究
基于在响应病人中变化的CD8+ T细胞在治疗前后变化的特征,我们可以总结出免疫治疗促使naïve型的和终末耗竭型的T细胞向初始耗竭型亚型转变(图4)。我们在非响应患者样本中也观察到了类似的特征。
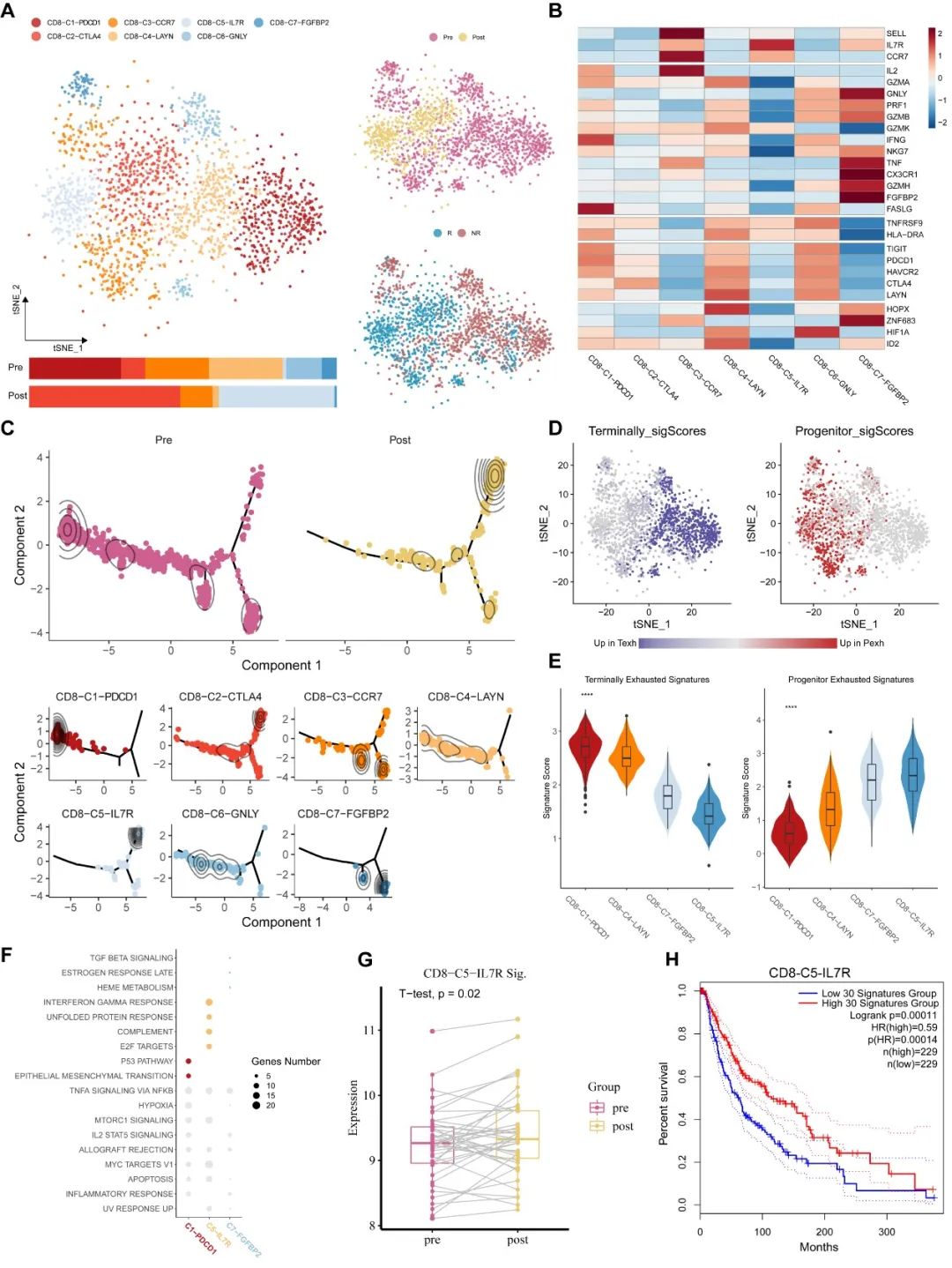
图4. 免疫治疗促使CD8+ T细胞的激活。
4、基于scCURE的免疫治疗中巨噬细胞研究
与CD8+ T细胞不同的是,我们观察到在响应患者中巨噬细胞会被免疫治疗激活。相反,在非响应患者中,巨噬细胞的抗肿瘤特征会在治疗后失活。这显示了疗效预测模型在肿瘤精准治疗中的重要性。同时,细胞间通讯显示在响应患者中,CD8+ T细胞和巨噬细胞具有明显的协同作用(图5G),而该现象没有在非响应患者中发现。
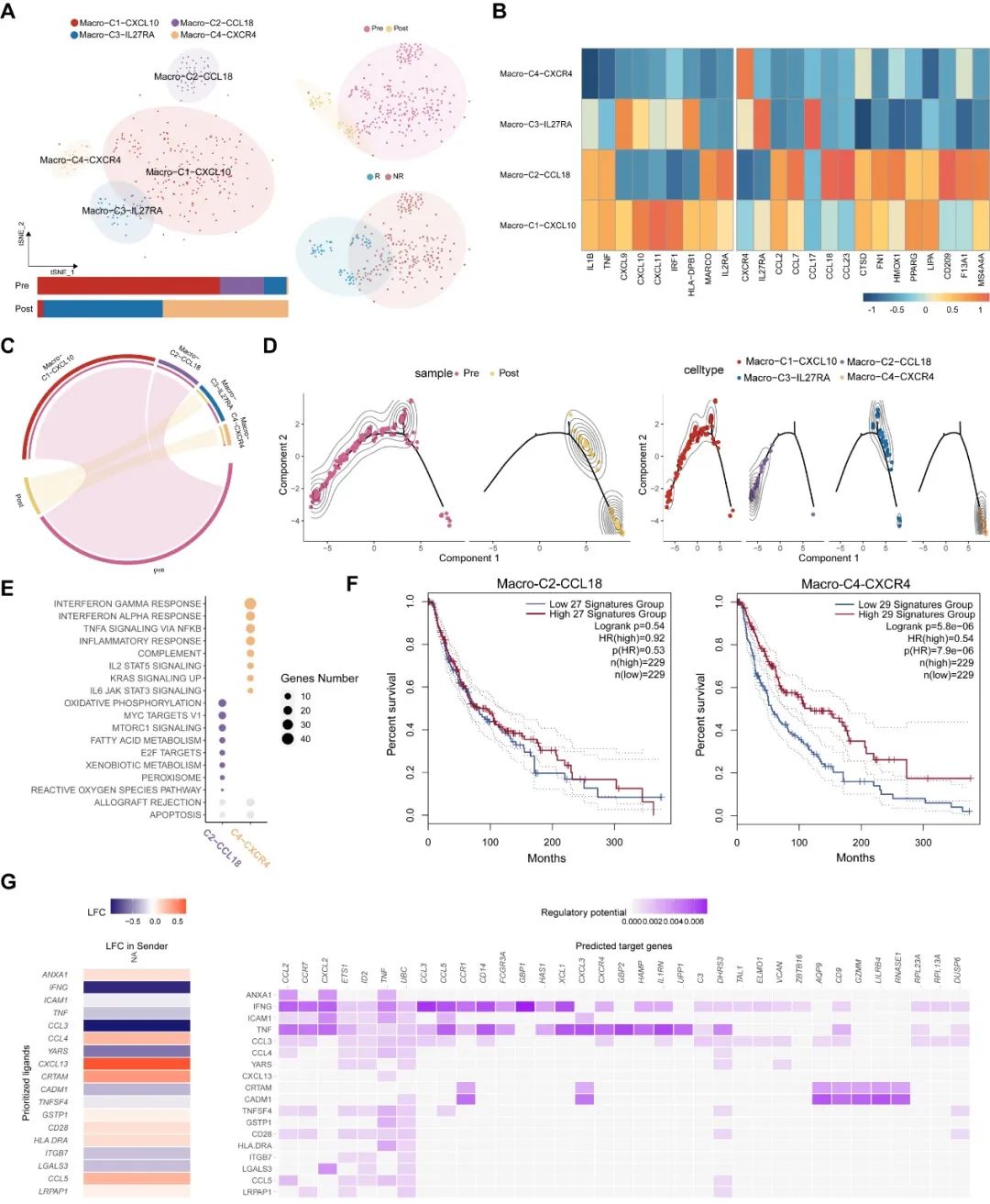
图5.免疫治疗响应患者中的巨噬细胞动态特征。
二.
基于单细胞和bulk数据的前列腺癌干性分型研究
前列腺癌(PCA)是全球第五大导致癌症相关死亡的原因,晚期的治疗选择有限。PCA的免疫抑制性肿瘤微环境(TME)导致其对免疫治疗的敏感性降低。尽管分子亚型分类有望为PCA的精准治疗提供重要线索,但目前仍然缺乏临床实践中可靠和有效的分子分类方法。因此,我们旨在提出一种基于干性特性的新型分类方法,以指导包括免疫治疗在内的PCA个体化临床治疗。
我们首先进行了PCA的综合多组学分析,以评估干细胞水平的异质性。采用无监督的层次聚类方法,基于干性特征基因对PCA进行分类。为了使患者分类更具临床应用性,我们使用四个PCA数据集和76种机器学习算法共同开发了一个干性亚型预测模型。
图6显示了干性特征与临床特征的广泛关联性。基于单细胞数据和bulk数据,我们构建了一个干性分型模型,将PCA患者分成3个亚型(图7b)。
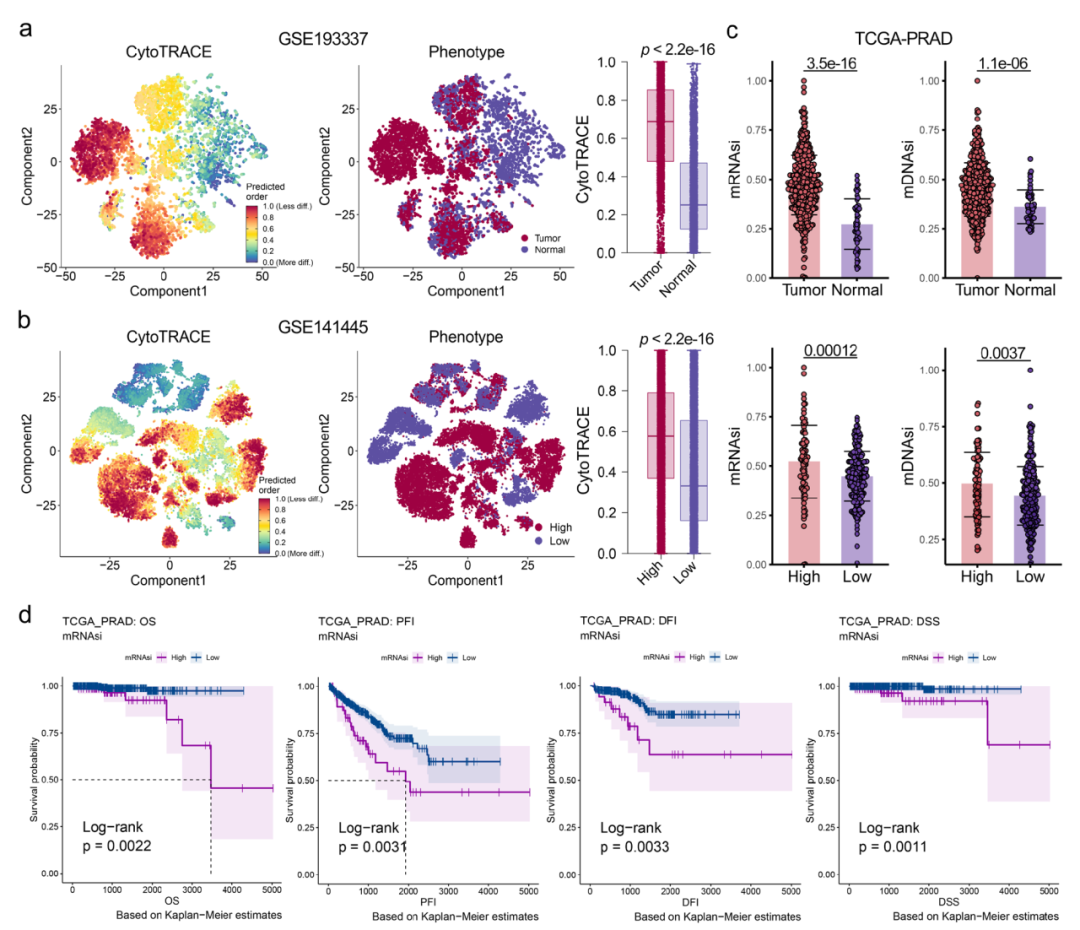
图6.干性特征与前列腺癌临床特征的广泛关联性。
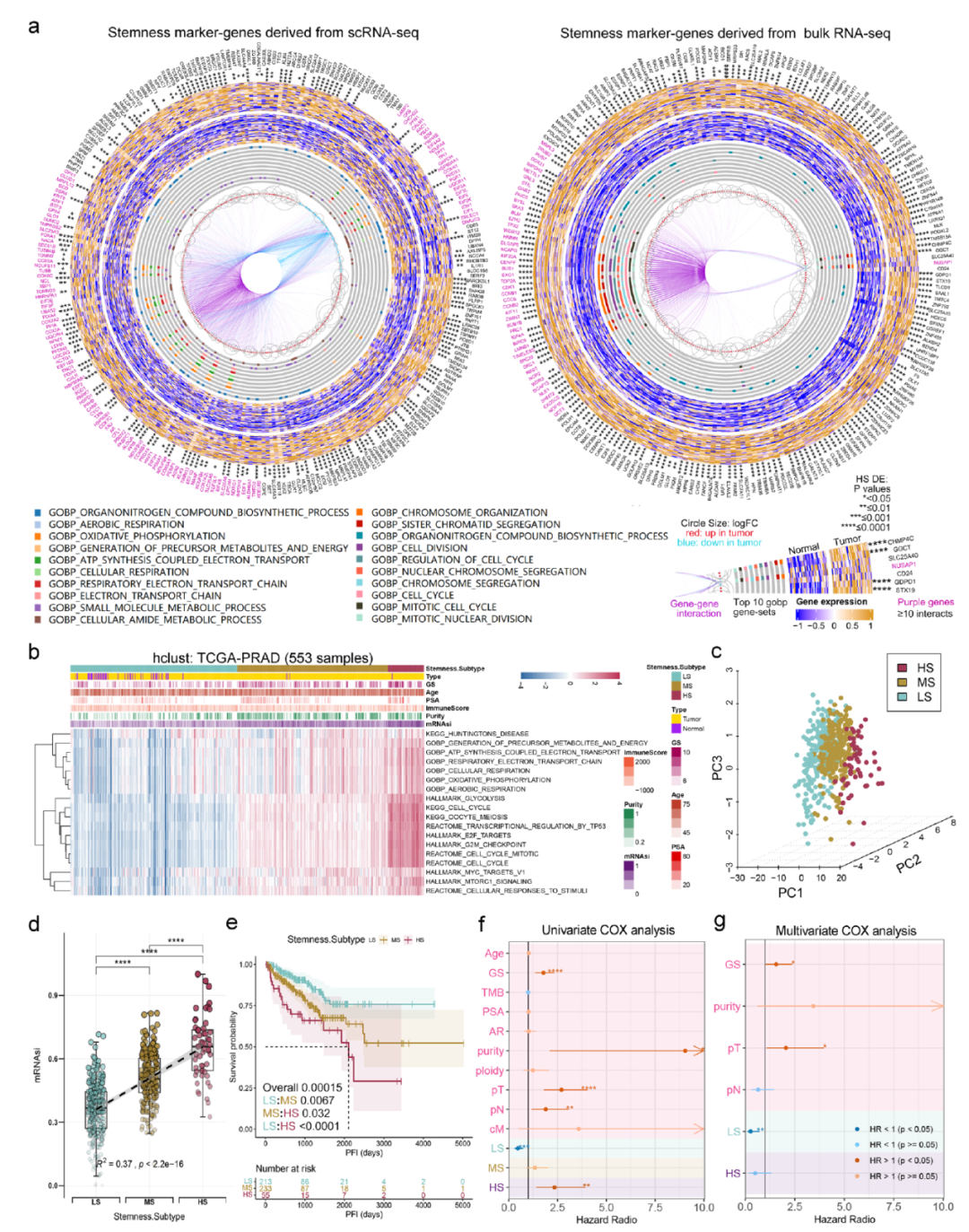
图7.干性特征分型模型构建。
图8显示了不同的干性分型患者具有不同的临床特征,基因突变特征和表观遗传特征。
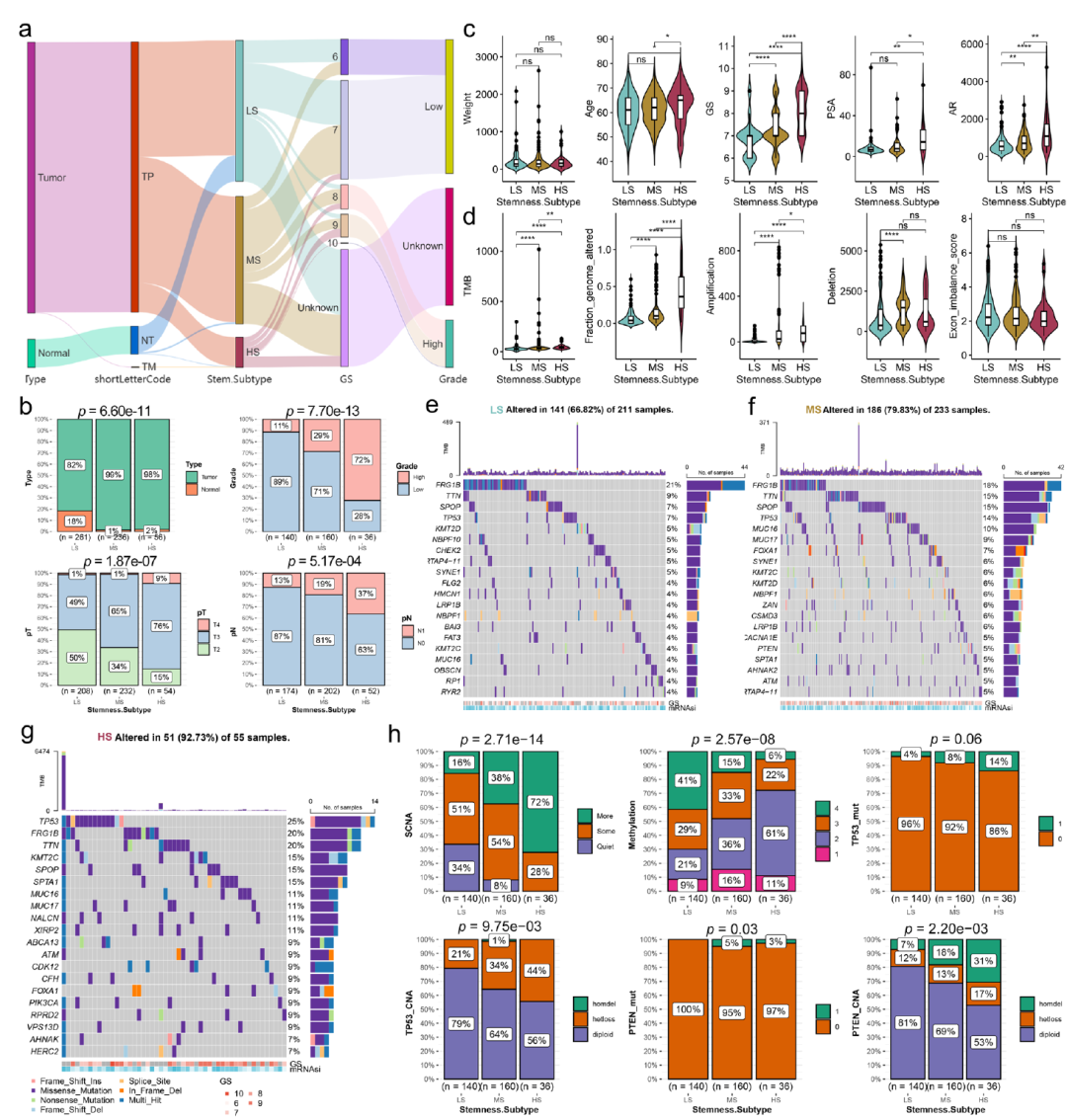
图8.不同干性分型患者的多组学特征。
图9显示了我们提出的干性分型模型可以用于预测患者对ICB免疫治疗的响应。
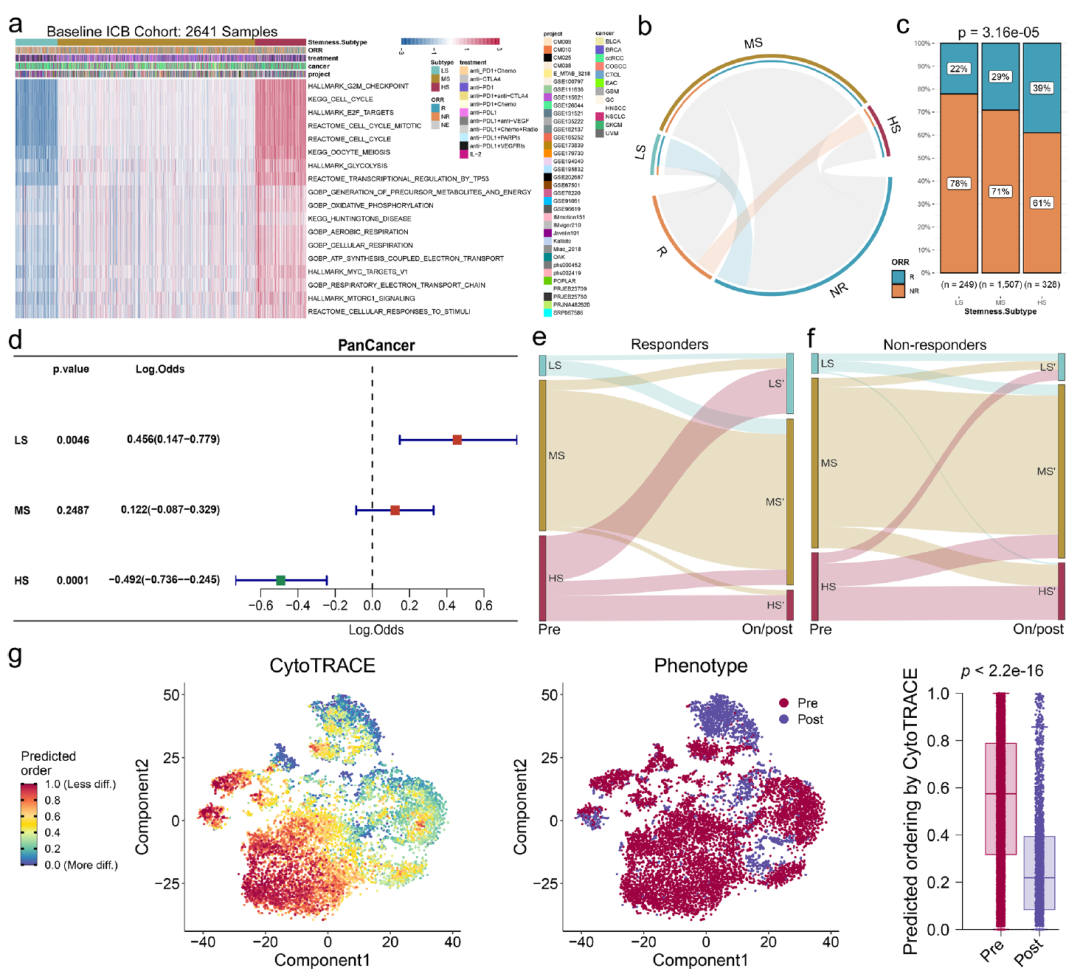
图9.不同干性分型患者对ICB免疫治疗具有不同的响应特性。
论文的通讯作者为复旦大学附属中山医院郝洁研究员,复旦大学附属金山医院邹欣副研究员。论文的主要参与人员包括上海交通大学附属第六人民医院郑坤,复旦大学附属肿瘤医院刘宇峻等。该研究得到了国家自然科学基金(82170045,31800253),上海交通大学医学院高水平地方高校创新团队 (SSMU-ZLCX20180502)的支持。
SBC中心实验室
SBC中心实验室聚焦单细胞、空间多组学前沿技术,围绕基因组、表观组、转录组、蛋白组、代谢组和微生物组等多维组学研究,以国际一流水平的技术平台,二十余年专业经验的技术团队,打造创新产品服务体系,高效助力科学发现产品研发。中心始终以严谨的科学态度,坚持创新,服务国家重大战略任务,推动技术成果转化应用和带动产业集群发展。长期举办学术论坛、专题研讨会、前沿技术培训,为数十家跨国制药企业和上千家国内科研机构、院校、医院提供系统全面一站式的科研与转化解决方案,日益发挥面向生物医药全行业功能效益和策源动力。
-
复旦微电子学生发表的论文集锦2011-12-07 64687
-
研究生毕业继续送资料——超经典复旦大学微电子工艺教案2011-12-15 40559
-
复旦大学labview2012-05-10 9634
-
裕策生物获IDG领投的亿元B轮融资 推动肿瘤免疫诊疗发展2018-12-23 5576
-
用于治疗脑肿瘤和癫痫的新型柔性传感器2022-02-26 920
-
复旦大学的Nios教材教程2009-03-28 697
-
单细胞分析技术与新技术能识别遗漏癌细胞的介绍2017-09-22 714
-
T 细胞打入肿瘤细胞要先对好“暗号”2019-06-19 4291
-
微流控芯片单细胞克隆形成抑制实验用于乳腺癌干细胞特异性药物筛选2019-06-20 6380
-
复旦大学成功研发出第三类新型存储技术2019-09-25 971
-
mTORC1高活性的干细胞样状态肿瘤细胞类型分析2022-10-10 2854
-
研究者如何研究SLS和IS的肿瘤免疫微环境2022-10-25 2201
-
模块化设计的磁控工程细菌实现肿瘤精准免疫治疗2023-04-07 2494
-
微针系统在肿瘤疫苗中的研究进展2023-09-07 2788
-
基于微流控的纳米细胞芯片,用于肺癌免疫治疗的精准预测2024-05-07 2647
全部0条评论

快来发表一下你的评论吧 !

