

基于微流控技术和DNA纳米材料制备的载细胞微凝胶研究
描述
急性肝功能衰竭(ALF)是一种严重危及生命的疾病,短期内会导致大量肝细胞坏死和肝功能快速丧失,具有较高的死亡率。肝细胞移植能迅速支持肝脏生物功能并促进肝脏再生,在ALF治疗中展现出巨大的潜力。但目前用于肝细胞移植的细胞来源受限;此外,通过静脉注射移植的肝细胞在体内易被快速清除,限制了其治疗效果。针对此,中山大学李明强和陶玉团队通过体外诱导干细胞分化获得功能性肝细胞样细胞,并优化其在体内的移植和递送效率。
该研究采用Y形DNA纳米结构递送microRNA-122,在体外诱导干细胞的定向分化和成熟。为进一步提高细胞移植效率和治疗效果,研究人员运用液滴微流控技术制备了用于递送肝细胞样细胞的保护性微凝胶。研究显示,当这些肝细胞样细胞与人脐静脉内皮细胞(HUVECs)在微凝胶中共培养时,其肝功能得到显著增强。将载细胞微凝胶移植到ALF小鼠体内,可促进肝功能的恢复和肝脏再生(图1)。
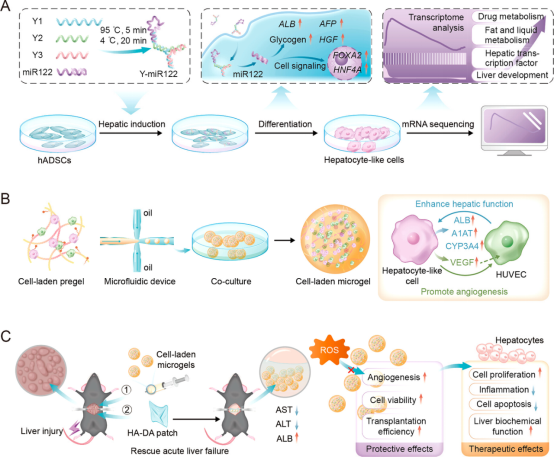
图1 Y-miR122诱导干细胞分化机制及载细胞微凝胶球体内移植用于治疗急性肝衰竭的示意图
DNA材料具有良好的生物相容性,其序列和结构具有高度可调控性,通过碱基互补配对作用可高效负载核酸药物,提高其稳定性和细胞摄取效率。本研究使用Y形DNA纳米载体增强miR122的细胞内递送效率。如图2所示,研究团队首先对Y-miR122的组装结构和胞内递送效率进行了表征和测试,并验证了其在体外诱导干细胞肝向分化的生物功能(图3)。
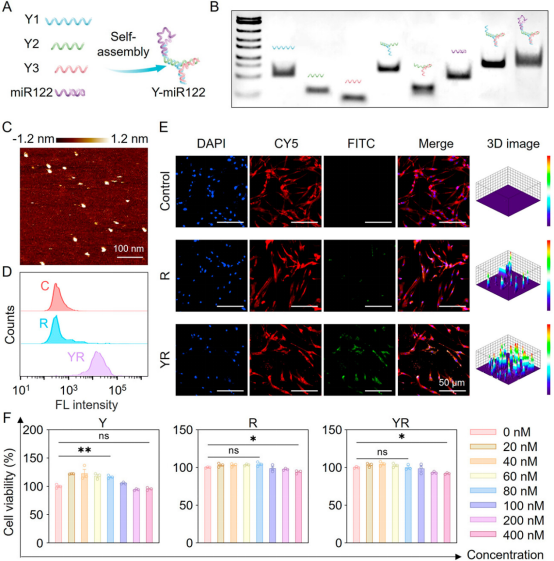
图2 Y-miR122的制备及表征
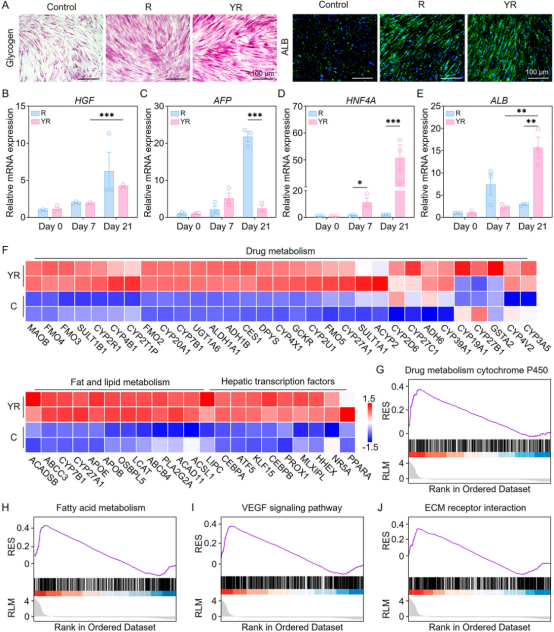
图3 Y-miR122在体外诱导干细胞的肝向分化
基于微流控技术开发的3D微凝胶细胞递送系统不仅促进了内部细胞-细胞和细胞-基质的相互作用,还能有效保护封装细胞免受外界刺激损伤。当Y-miR122诱导的肝细胞样细胞与HUVECs在微凝胶中共培养时,肝细胞样细胞的肝功能显著增强(图4)。
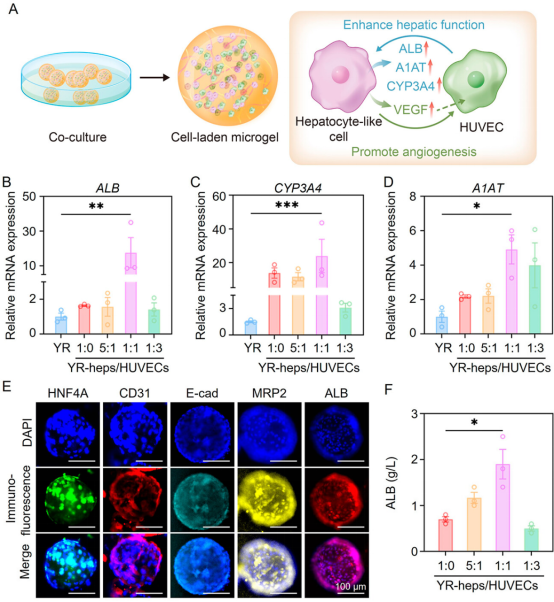
图4 诱导后的肝细胞样细胞与HUVECs在基于微流控技术开发的微凝胶球内共培养
体内实验结果显示,载细胞微凝胶显著降低ALF小鼠的天门冬氨酸氨基转移酶(AST)和丙氨酸氨基转移酶(ALT)水平,缓解小鼠的炎症,促进小鼠肝功能的恢复和肝脏再生(图5、6)。进一步对移植物进行表征,发现载细胞微凝胶治疗组具有最高的细胞移植效率和细胞活性(图7)。上述结果表明,基于微流控技术开发的微凝胶可有效保护移植细胞免受氧化应激微环境的损害,从而增强移植细胞在ALF治疗中的效果。
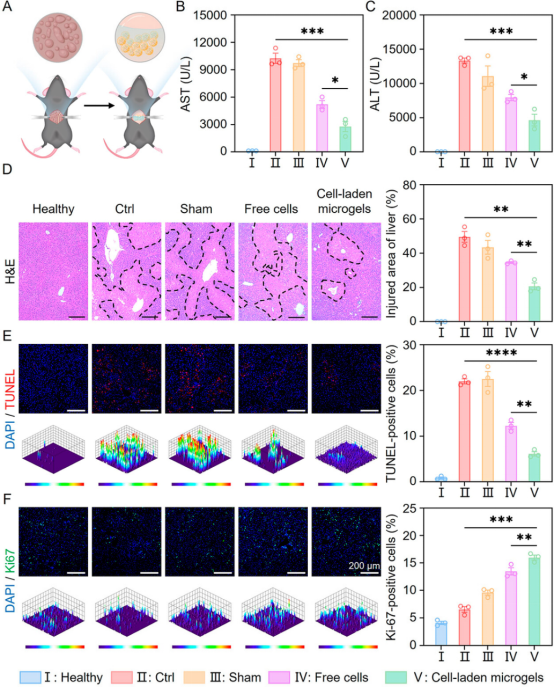
图5 基于微流控技术开发的载细胞微凝胶在ALF小鼠模型中的治疗效果
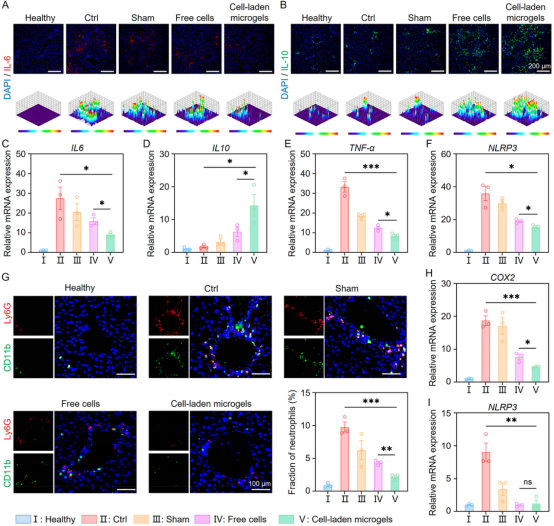
图6 载细胞微凝胶移植治疗可有效减轻ALF小鼠的炎症
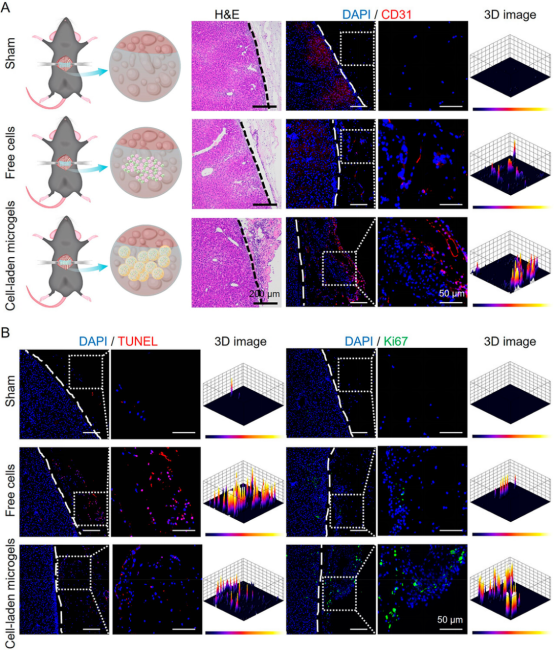
图7 微凝胶包封策略对体内移植的细胞起到保护作用
综上所述,该研究利用DNA纳米材料调控干细胞分化获得功能性肝细胞样细胞,并结合微流控技术对其进行包封和递送,用于肝衰竭治疗。该研究为干细胞的定向肝分化提供了新方法,为肝衰竭的细胞治疗提供了可靠的细胞来源。
审核编辑:刘清
- 相关推荐
- 微流控
-
自组装DNA纳米材料结构与功能的研究2018-02-11 887
-
基于DNA分子的微纳米材料的构建和应用2018-02-11 1047
-
微流控技术的原理、制备以及应用2018-02-23 38794
-
一种基于多瓣结构微凝胶的单细胞组装和细胞3D共培养技术2018-04-19 4926
-
如何将微流控SERS技术应用于活细胞检测?2018-08-20 3788
-
利用微流控技术制备具有生物相容性的双水相微载体2018-09-28 2576
-
利用微流控技术制备高度贯通多孔微载体2019-06-30 3980
-
基于液滴微流体的微流控芯片系统的研究2022-03-02 5712
-
一种高效的微流控细胞芯片,通过快速筛选允许细胞实现病毒的分离和培养2022-06-07 3371
-
微流控芯片的设计与制备2022-08-17 6148
-
微流控技术中使用的不同类型的水凝胶2022-09-28 2584
-
微流控成像细胞分析技术MIC进展与突破2022-12-02 1584
-
基于电沉积法制备的纳米微针实现药物在原代细胞内的有效递送2023-04-18 1596
全部0条评论

快来发表一下你的评论吧 !

