

碳化硅晶片为什么存在C面和Si面
描述
SiC是一种Si元素和C元素以1:1比例形成的二元化合物,即百分之五十的硅(Si)和百分之五十的碳(C),其基本结构单元为 Si-C 四面体。
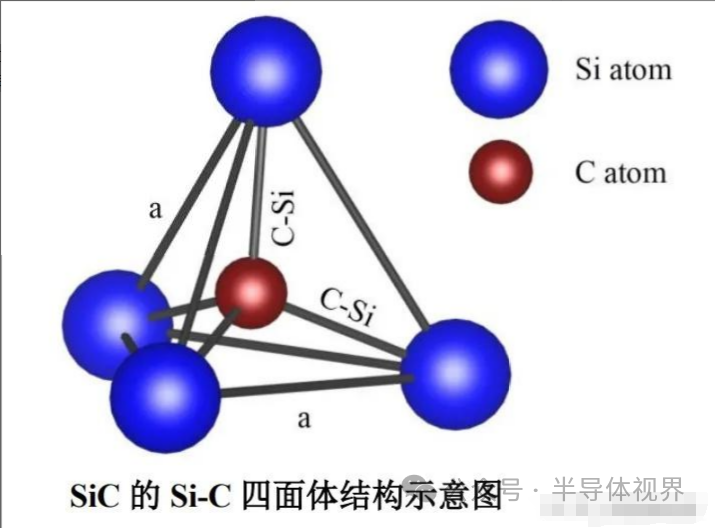
举个例子,Si原子直径大,相当于苹果,C原子直径小,相当于橘子,把数量相等的橘子和苹果堆在一起就成了SiC晶体。
SiC 是一种二元化合物,其中 Si-Si 键原子间距为3.89 Å,这个间距如何理解呢?目前市面上最牛逼的光刻机光刻精度3nm,就是30Å的距离,光刻精度是原子距离的8倍。
Si-Si键能大小为 310 kJ/mol,可以理解键能是把这两个原子拉开的力度,键能越大,需要拉开的力越大。
Si-C键原子间距为 1.89 Å, 键能大小为 447 kJ/mol。
从键能上可以看出相较于传统的硅基半导体材料,碳化硅基半导体材料化学性质更加稳定。
从图中看出任意一个C原子都与最邻近的四个Si原子相连,反之任意一个Si原子都与最邻近的四个C原子相键连。
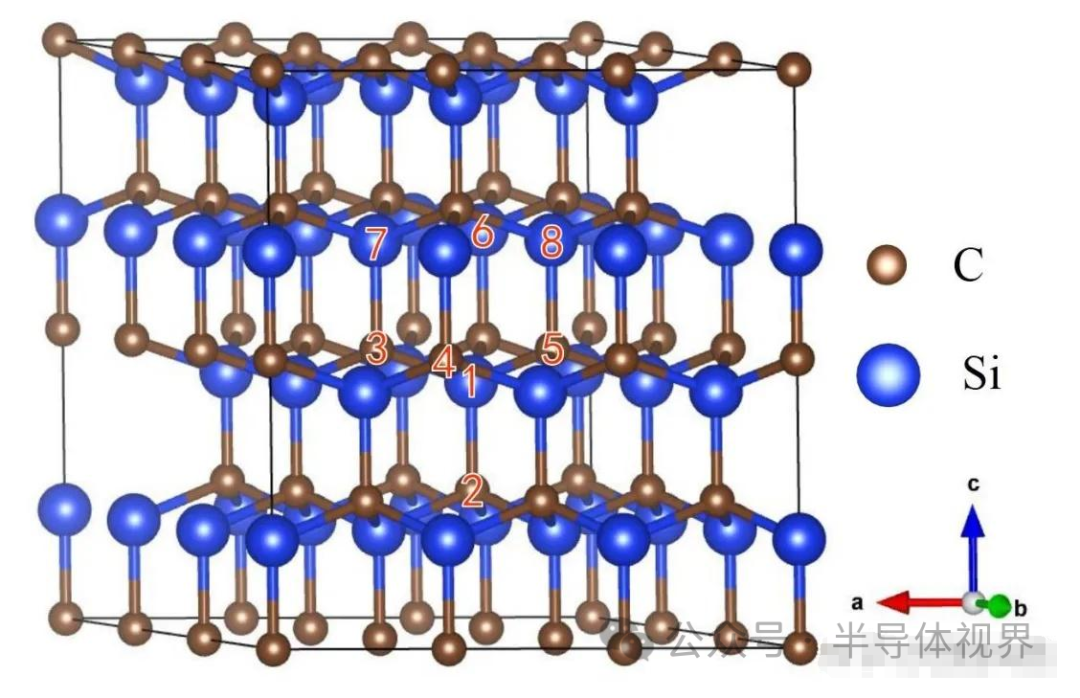
SiC 晶体结构还可以采用层状结构方法描述,如图所示,晶体中的若干C原子均占据在同一平面上的六方格位点中,形成一个C原子密排层,而Si原子也占据在同一平面上的六方格位点中并形成一个Si原子密排层。
C原子密排层中的每一个C都与最邻近的Si相连接,反之Si原子密排层也相同。每两个相邻的 C、Si原子密排层构成一个碳硅双原子层。
SiC晶体的排列组合形式十分丰富,目前已发现的SiC晶型达 200 多个。
这个类似俄罗斯方块,虽然最小单元方块都一样,但方块组合在一起后,就拼成出了不同形态。
SiC的空间结构比俄罗斯方块稍微复杂点,它的最小单元从小方格变成小四面体,由C原子和Si原子组成的四面体。
为了区分 SiC 的不同晶型,目前主要采用 Ramsdell 方法进行标记。该方法采用字母与数字相结合的方法来表示SiC 的不同晶型。
其中字母放在后面,用来表示晶体的晶胞类型。C 代表立方晶型(英文Cubic首字母),H 代表六方晶型(英文Hexagonal首字母),R 代表菱形晶型(英文Rhombus首字母)。数字放在前面,用来表示基本重复单元的Si-C双原子层的层数。
除2H-SiC与3C-SiC外,其它晶型均可视为闪锌矿与纤锌矿结构的混合体,也就是密排六方结构。
C面是指碳化硅晶片的(000-1)晶面,即晶体沿着c轴的负方向切割的表面,该表面的终止原子是碳原子。
硅面是指碳化硅晶片的(0001)晶面,即晶体沿着c轴的正方向切割的表面,该表面的终止原子是硅原子。
C面和硅面的不同会影响碳化硅晶片的物理性能和电学性能,如热导率、电导率、载流子迁移率、界面态密度等。
C面和硅面的选择也会影响碳化硅器件的制造工艺和性能,如外延生长、离子注入、氧化、金属沉积、接触电阻等。
来源:半导体信息
审核编辑:汤梓红
-
碳化硅压敏电阻 - 氧化锌 MOV2024-03-08 8260
-
碳化硅的历史与应用介绍2019-07-02 4894
-
碳化硅深层的特性2019-07-04 5886
-
碳化硅二极管选型表2019-10-24 1763
-
碳化硅半导体器件有哪些?2020-06-28 4147
-
碳化硅基板——三代半导体的领军者2021-01-12 4277
-
碳化硅器件的特点是什么2021-03-16 4242
-
什么是碳化硅(SiC)?它有哪些用途?2021-06-18 9240
-
碳化硅的应用2021-08-19 3842
-
传统的硅组件、碳化硅(Sic)和氮化镓(GaN)2021-09-23 5993
-
请教碳化硅刻蚀工艺2022-08-31 41864
-
归纳碳化硅功率器件封装的关键技术2023-02-22 2799
-
浅谈硅IGBT与碳化硅MOSFET驱动的区别2023-02-27 2756
-
碳化硅MOS的结构与优势2023-02-09 3437
-
碳化硅晶片的性质及其用途2023-02-25 4045
全部0条评论

快来发表一下你的评论吧 !

