

集成电路可靠性试验―盐雾技术研究
可靠性分析
描述
1 前言
盐雾试验是集成电路可靠性试验之一,它可以用来检验产品的抗腐蚀环境能力的强弱。而盐雾试验所需的条件又比较多,这些条件会对试验产生一定的影响。
2 试验
一般我们做盐雾试验的条件是盐液:NaCl(无水);pH值:6.5~7.2;温度:32-38℃;盐雾沉积率:20000~50000/m2 (24h);盐雾持续时间:24h,48h,96h,240h;盐浓度:0.5%-3%。
盐雾沉积率与盐浓度是相对应的,这是因为它们之间的对应关系如下式

Sd为盐雾沉积率;[Cl]-为氯离子浓度。
因为盐浓度就是氯离子浓度,所以盐浓度与盐雾沉积率之间是相对应的。
根据以上条件可以判断,在进行盐雾试验时,影响试验的主要条件有以下几点:温度;盐液浓度;氧的溶解度;流速。
为了验证以上的条件对试验的影响,本文选用若干表面干净的电路按下列方法进行试验验证。
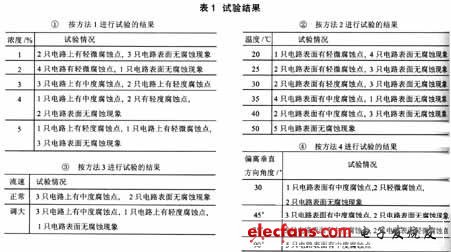
方法1:盐选用NaCl(无水);温度为35℃;时间为24h。流速一定;按盐浓度为1%,2%,3%,4%,5%分五组进行试验,每一组五个电路。
方法2:盐选用NaCl(无水);浓度为3%;盐雾沉积率为50000/m2*24h;时间为24h。流速一定;按温度20℃,25℃,30℃,35℃,40℃,50℃分六组进行试验,每一组五个电路。
方法3:盐选用NaCl(无水);浓度为3%;盐雾沉积率为50000/m2(24h);时间为24h。温度为35℃;按流速正常和流速变大分两组进行试验,每一组五个电路。
另外,为了研究样品的摆放对试验的影响,我们用方法4进行试验。
方法4:将15只样品平均分成三组,盖板向上,样品偏离垂直方向30°,45°,75°,90°进行试验,其他试验条件是:盐选用NaCl(无水);浓度为3%;盐雾沉积率为:50000/m2(24h);时间为24h。流速一定;温度为35℃。
试验后用纯净水清洗电路,放置1小时后,试验结果见表1。
3 试验分析
本文对以上试验结果进行了分析。在盐雾试验中,由于各种金属的电极电位不同以及它们在盐液中的过电位大小不一,所以在盐雾中会发生很多的 电化学反应。在阳极是金属失去电子,成为离子,在阴极发生的电化学反应类型有析氢反应和氧去极化反应等,其中氧去极化反应(吸氧反应)是最主要的反应类型。它是由于盐液中含有的溶解氧而 造成的,溶液中的氧可通过扩散作用不断地向阴极区移动。
氧向电极表面扩散决定整个吸氧腐蚀过程的速度,因为氧在盐溶液的溶解度是有限的,吸氧腐蚀速度往往被氧向金属表面的扩散速度所控制,也就是说,金属腐蚀速度是与氧在阴极还原的极限电流密度相一致的。
氧向阴极扩散速度由Fick第二定律得出

式中,D为溶解氧扩散系数;δ为扩散层厚度;Ce为电极表面氧的浓度;C为溶液中氧的浓度。
电极反应速度可由法拉第定律得出

id:极限电流密度;n:价数;F:法拉第常数。
当电极反应达到平衡,即扩散控制时:V1=V2由公式(2)、公式(3)得出

由于随着电极反应的进行,电极附近氧原子不断消耗,Ce降低,当Ce→0时,公式(4)可变为

从公式(5)中可以看出,极限电流密度id与扩散层厚度δ、溶解氧扩散系数D、溶解氧的浓度C、价数n等有关;极限电流密度的大小也就意味着腐蚀速度的大小;其中D与环境温度成正比。
3.1 溶液温度的影响
从公式(5)中可知,溶液温度升高,使溶液粘度降低,从而使溶解氧的扩散系数D增加,所以温度升高可以加速腐蚀过程。试验结果见图1 (由表1中①的结果转化而来)。
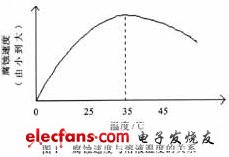
从图1中知道,随着温度的升高,腐蚀速度也 在逐渐增大,但是当温度超过35℃后,腐蚀速度反而随着温度的增大而变弱。这一现象的产生主要 是在溶液浓度一定的情况下,由于氧气在溶液中的溶解度是与温度成反比的。而腐蚀速度是受到两个主要的因素来控制的,即温度与溶解在溶液中的氧含量。在温度低于35℃时,虽然氧的含量随着温 度的升高而降低,由于在这种情况下电化学反应所需要的氧是足够的,因而腐蚀速度受温度控制。由于温度的升高可以使溶解氧的扩散系数D变大,所以在温度小于35℃时,腐蚀速度(即电化学反应速度)是与温度成正比的。当温度高于35℃,随着温度的升高,溶液中的氧的含量降低,不能满足电化学反应所需要的含量。这时,腐蚀速度是受溶解氧的含量控制的,虽然温度升高会使化学反应速度提高,但由于是氧在参与电化学反应,因氧浓度降低,所以腐蚀速度逐渐地随温度的升高而减慢。
3.2 溶液浓度的影响
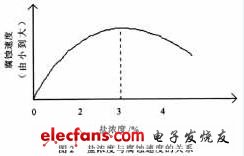
在盐雾试验中,Cl离子的半径小,破坏性很强。由于它的存在,使电路发生腐蚀现象。当NaCl溶液浓度增大,则Cl离子浓度也就变大,这时, 电化学反应速度就应当变快。试验结果见图2(表1中②的结果转化而来)。
由图2可知,随着盐浓度的增大,腐蚀速度开始是与浓度成正比的,但当浓度超过3%后,腐蚀速度与浓度的关系是反比的,即反应速度随盐浓度的增加而降低。氧的溶解度与浓度成反比关系。这是由于在一定温度条件下,腐蚀速度是由两个主要的因素,即盐浓度与溶解在溶液中的氧含量来控制的。当溶液中氧的含量能满足电化学反应时,腐蚀速度受盐浓度控制,即Cl离子浓度越大,发生的 反应越强。当浓度超过3%后,随浓度的增加,溶解的氧的含量降低,不能满足电化学反应的需要, 这时,腐蚀速度是受溶液中氧的含量来控制。虽然Cl离子浓度变大,但此时起主要作用的是氧, 所以腐蚀速度随浓度的增加而变小。
3.3 氧的溶解度
从公式(5)中可知,溶解氧的浓度C增加,极限电流密度id增大,这样溶液导电性增加,腐蚀 速度加快。表2是氧在海水中的溶解度关系。
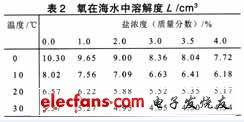
从表2中可以看出,溶解度是与外界环境条件 密切联系的,即随着浓度或温度的增加而降低,此时扩散速度减小,使腐蚀速度下降。我们通过降低外界环境温度或降低盐浓度,来使溶液中氧的浓度的提高。当 C增大,id变大,这时反应速度(腐蚀速度)分两种情况:①当溶解氧不能满足电化学反应的要求时,氧的溶解度对腐蚀速度起主要作用,即腐蚀速度随溶液中氧的浓度的增大而变大。②当溶解氧能满足电化学反应的要求时,腐蚀速度受氧浓度C的影响变小,而主要受温度或浓度的影响,即由于溶解度的增加,温度降低或浓度降低, 使腐蚀速度降低。
3.4 流速
在氧浓度、温度、盐浓度一定时,流速的增加,使扩散层厚度δ减小,由公式(5)可知,极限电流密度id变大,所以腐蚀速度增加。再看试验结果表1中的③,流速变大后,电路表面的腐蚀现象增加了,也就是说腐蚀速度是与流速成正比关系的。
3.5 样品摆放的影响
从表1④看,腐蚀现象随角度变大而变得严重,我们研究该现象严重的原因。
图3中左图为样品摆放的位置,右图为盐雾颗粒在盖板上的受力情况。
下面来看一下盐雾颗粒在样品表面停留的时间。假定颗粒从样品表面盖板的上端向下端流动,设盖板的长度为L,根据图3中右图的颗粒受力情况及动力学原理,得出:

从公式(8)中可知,样品偏离垂直方向的角度α与时间t成正比,即当α=0°时,t最小;当α=90°时,t最大,盐雾颗粒在样品表面时间越长,盐沉积在表面盖板上的就越多,对样品的破坏性就越大。当角度为0°时,样品放置会不稳定;角度为90°时,因盐沉积量太大而影响试验的作用。因此,角度在10°-80°比较合适,一般取45°,即可使流速快又可使盐沉积在盖板上不多。该角度便于调制而且样品放置方便。
4 结论
通过以上的试验与结果分析,我们可以认为在温度小于35℃前,腐蚀速度与温度成正比关系;当超过35℃后,腐蚀速度与温度成反比关系;在35℃腐蚀速度达到最大。盐浓度小于3%前,腐蚀速度与浓度成正比关系;当盐浓度超过3%后,腐蚀速度与盐浓度成反比关系;在3%时腐蚀速度达到最大。氧溶解度对腐蚀速度的影响是与温度与盐浓度相关的。采用温度35℃、盐浓度3%进行盐雾试验可以在最短时间并且最有效地反映集成电路封装的抗腐蚀能力。样品的摆放偏离垂直方向的角度越大,试验越严酷,越小越宽松,试验时的角度为45°,可以两者兼顾。
-
集成电路前段工艺的可靠性研究2025-03-18 1608
-
PVC板盐雾试验箱与玻璃钢板盐雾试验箱比较2012-07-21 2761
-
盐雾试验箱在军用设备中的应用2013-04-29 2600
-
可靠性试验分类方法及试验标准2017-01-20 5014
-
LED壁灯路灯草坪灯中性盐雾试验/交变盐雾IEC60068怎么做?多少钱2021-10-29 748
-
LED显示屏中性盐雾试验/交变盐雾IEC60068怎么做?盐雾怎么测试?2021-11-02 1354
-
盐雾试验_盐雾测试2018-10-10 1115
-
集成电路的可靠性判断2023-06-14 2890
-
集成电路封装可靠性设计2023-06-15 1767
-
集成电路封装可靠性试验的分类与作用2023-06-16 2190
-
用盐雾试验箱对产品进行盐雾试验的目的2022-07-29 1804
-
电子元器件盐雾试验介绍2025-11-06 1225
全部0条评论

快来发表一下你的评论吧 !

