

基于有机电化学晶体管的全集成微针式持续血糖监测系统研究
描述
糖尿病是威胁人类健康的最恶性的慢性疾病之一。对于糖尿病患者的不当干预可能会导致其出现突发性低血糖,并增加其出现并发症的风险。因此,准确检测患者的血糖水平对改善患者的血糖管理至关重要。过去二十年来,持续葡萄糖监测(CGM)设备已取得了长足的进展。CGM设备可以向糖尿病患者提醒持续高血糖并预警低血糖,是实现闭环血糖控制的不可或缺的设备。此外,近年来,健康人群也开始采用CGM设备来改善饮食习惯,以实现健康和减重目标,展示了技术驱动的新生活方式。
然而,现有的可穿戴CGM设备仍然面临着一系列亟待解决的问题。例如,传感器植入过程中的疼痛会降低患者的依从性,从而限制CGM设备的广泛使用。一种新兴的解决方案是开发完全集成和微创技术来减轻疼痛。一种有前景的技术是使用长度约为1 mm的微针检测间质液(ISF)中的葡萄糖水平,以间接反应患者的血糖水平。目前,有两种常见的方法可以用于将葡萄糖传感器与微针集成,但都存在挑战。一种方法是直接将传感器制造到微小的针上,但这对微加工技术提出了挑战。第二种方法是通过扩散缓冲层将传感器与空心微针连接起来,其中受控扩散和良好界面稳定性至关重要,尤其是在运动中。
除了上述问题,人们还在追求具有新特性的传感器,以用于未来的精准糖尿病保健。在这种情况下,有机电化学晶体管(OECT)因能够协同利用电化学和晶体管放大器以获得更好的传感质量而脱颖而出。至今,对基于OECT的葡萄糖生物传感器的研究主要集中在增强传感器的放大能力、机械可伸展性和操作稳定性上。尽管科研人员已经对OECT葡萄糖生物传感器进行了广泛的研究,但因为缺乏系统级开发策略,基于OECT葡萄糖生物传感器的可穿戴CGM设备的可行性尚未得到验证。此外,为了确保作为下一代CGM设备的竞争力,OECT葡萄糖传感器必须与微型化的读出系统集成,以提高可穿戴性,并采用微创取样技术来减轻皮肤穿透过程中的不适。
为解决上述问题,来自香港大学和浙江大学的研究人员提出了一种基于OECT技术(OECT-CGM)的可穿戴持续葡萄糖监测系统。这种紧凑的、硬币大小的、完全集成的、无线OECT-CGM系统包括以下关键组件:(i)一个用于信号放大的OECT葡萄糖生物传感器;(ii)一个用于ISF采样的微针阵列;以及(iii)一种用于改善皮肤-设备界面并增强传感可靠性的含酶水凝胶。与基于电化学传感技术的传统CGM系统相比,OECT-CGM系统可以提供改进的抗噪能力和按需可调的灵敏度和分辨率,这对于可穿戴应用至关重要。此外,该研究提出了一种自校准方法,以帮助评估OECT传感器的实时状态。最后,该研究展示了OECT-CGM系统在体内外监测葡萄糖水平的可行性。相关研究成果近期以“Coin-sized, fully integrated, and minimally invasive continuous glucose monitoring system based on organic electrochemical transistors”为题发表在Science Advances期刊上。
OECT-CGM系统的设计原理
OECT-CGM系统包括以下组件:(1)空心微针贴片;(2)具有粘附性的含酶柔软水凝胶膜;(3)基于OECT的葡萄糖传感器;(4)微型读出系统(PERfECT);以及(5)三维(3D)打印的树脂封装层。其中,微针作为ISF和OECT传感器之间的微创桥梁。具有粘附性的含酶水凝胶膜夹在微针贴片和OECT葡萄糖传感器之间,在运动过程中增强界面稳定性。ISF中的葡萄糖分子利用浓度梯度通过微针和水凝胶扩散到OECT生物传感器。水凝胶膜通过构建聚丙烯酰胺(PAAm)和Na⁺褐藻酸盐的相互穿透网络(IPN)结构而合成。这种双网络(DN)水凝胶进一步负载了用于葡萄糖检测的GOx。PERfECT系统记录了OECT的电流,可以与手机通信。此外,研究人员使用可折叠的柔性印刷电路板(fPCB)连接器作为电源线,方便OECT传感器与PERfECT系统之间的连接。上述叠加策略最小化了OECT-CGM系统的物理尺寸(宽度和长度),优化了其可穿戴性。
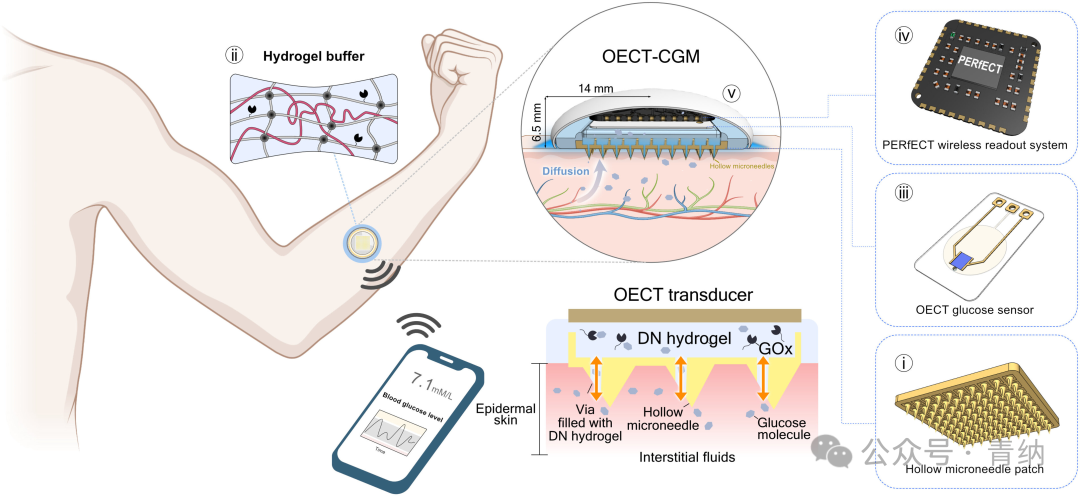
图1 OECT-CGM系统的概念和设计原理
OECT葡萄糖传感器的制备和表征
如图2所示,研究人员在柔性聚酰亚胺(PI)基底上制备OECT葡萄糖传感器,并采用“背对背”的设计,将栅极电极置于背面,通道置于基底的前面,从而避免了区域竞争,并减少了在栅上生物受体修饰过程中通道交叉污染的风险。研究人员通过循环传输曲线验证了制备的器件的操作稳定性。器件在循环测量后观察到了可忽略的偏移,展现了传感器在生物传感方面的良好的稳定性。
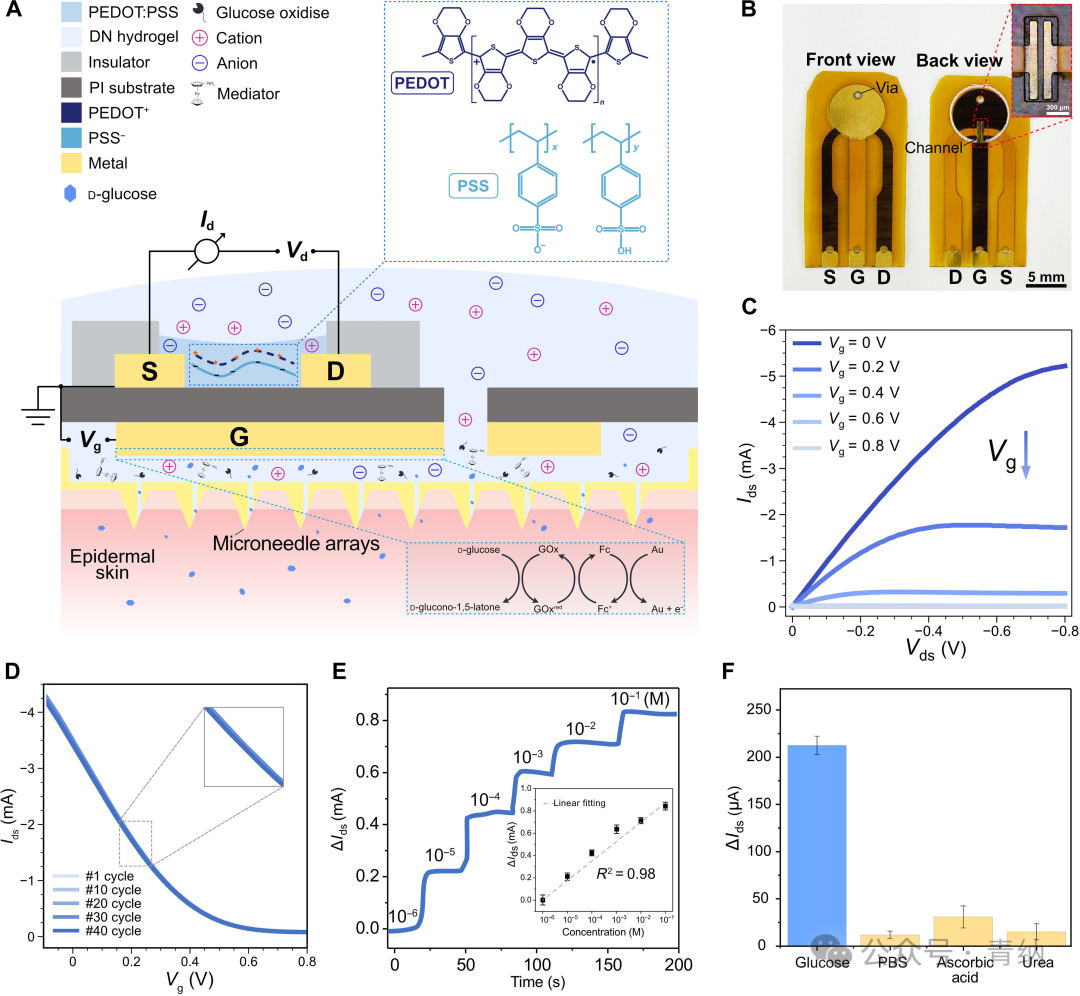
图2 基于OECT的葡萄糖传感器的制备和表征
可穿戴OECT读出系统的设计
紧凑轻便的读出系统是构建可穿戴传感器的重要组成部分。因此,该研究开发了一个硬币大小的读出系统(PERfECT,尺寸为1.5 cm × 1.5 cm × 0.2 cm,重量为0.4 g),与智能穿戴设备无缝集成。PERfECT系统的逻辑图如图3B所示。潜在控制模块接受来自微控制器单元(MCU)的命令,以控制Vg和Vds,步长可达2 mV,以精确表征OECT传感器的动态行为。电流监视模块可读取Ids,检测限为1 nA,使PERfECT在施加Vg和Vds并读取Ids时具有可比较的分辨率,与实验室使用的源测量单元相当。
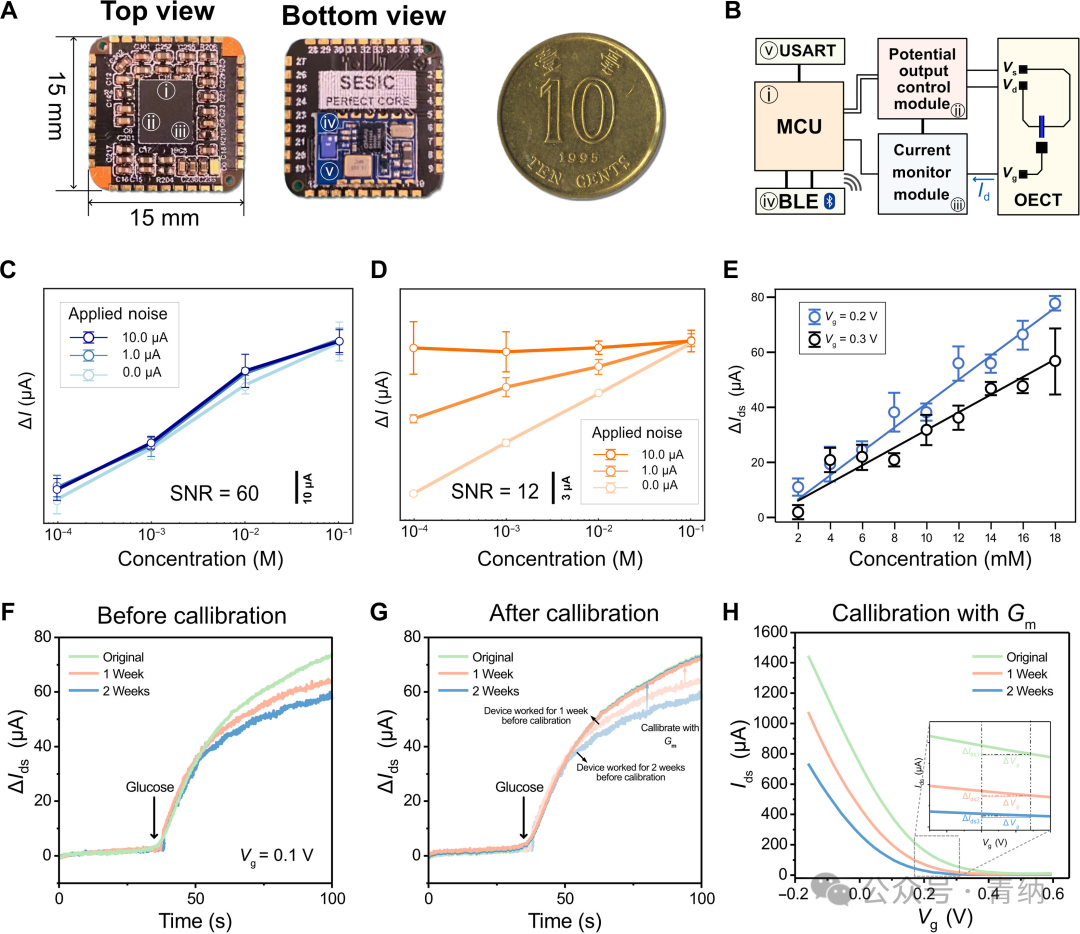
图3 具有高抗噪能力、可调灵敏度(分辨率)和自校准能力的全集成OECT葡萄糖传感平台
OECT-CGM的体外验证
为了验证OECT-CGM系统,研究人员将其与市售CGM系统(Dexcom G6)进行了比较。市售CGM系统包括一个长度约为2.0厘米的基于针头的传感器、一个粘贴片、一个支撑框架和一个无线数据传输器。OECT-CGM系统包括一个微针阵列,微针长度为1.0毫米,一个粘合层,一个OECT葡萄糖传感器和PERfECT读出系统。如图4H所示,OECT-CGM系统显示出与市售CGM系统可比的结果,但OECT-CGM系统体积更小(1.5 cm × 1.5cm),并且重量更轻。此外,OECT-CGM系统存在约8分钟的响应延迟,这归因于水凝胶中葡萄糖分子的扩散延迟。OECT-CGM系统的平均绝对相对差(MARD)值约为15%,表明其具有未来实际应用的潜力。
OECT-CGM的体内验证
最后,研究人员使用大鼠进行了OECT-CGM的体内验证。为了诱导高血糖状态,给大鼠注射葡萄糖溶液,以操控其血糖水平。在达到峰值后,血糖水平自动恢复到正常范围。大鼠在注射葡萄糖溶液后约1小时内显示出约16毫摩尔的峰值血糖水平。在250分钟内监测了血糖水平,并将结果与市售CGM系统进行了比较。尽管有轻微波动,但两个传感器的趋势在2至16毫摩尔的检测范围内显示出良好的一致性,表明OECT-CGM对于体内应用具有有效性和可靠性。
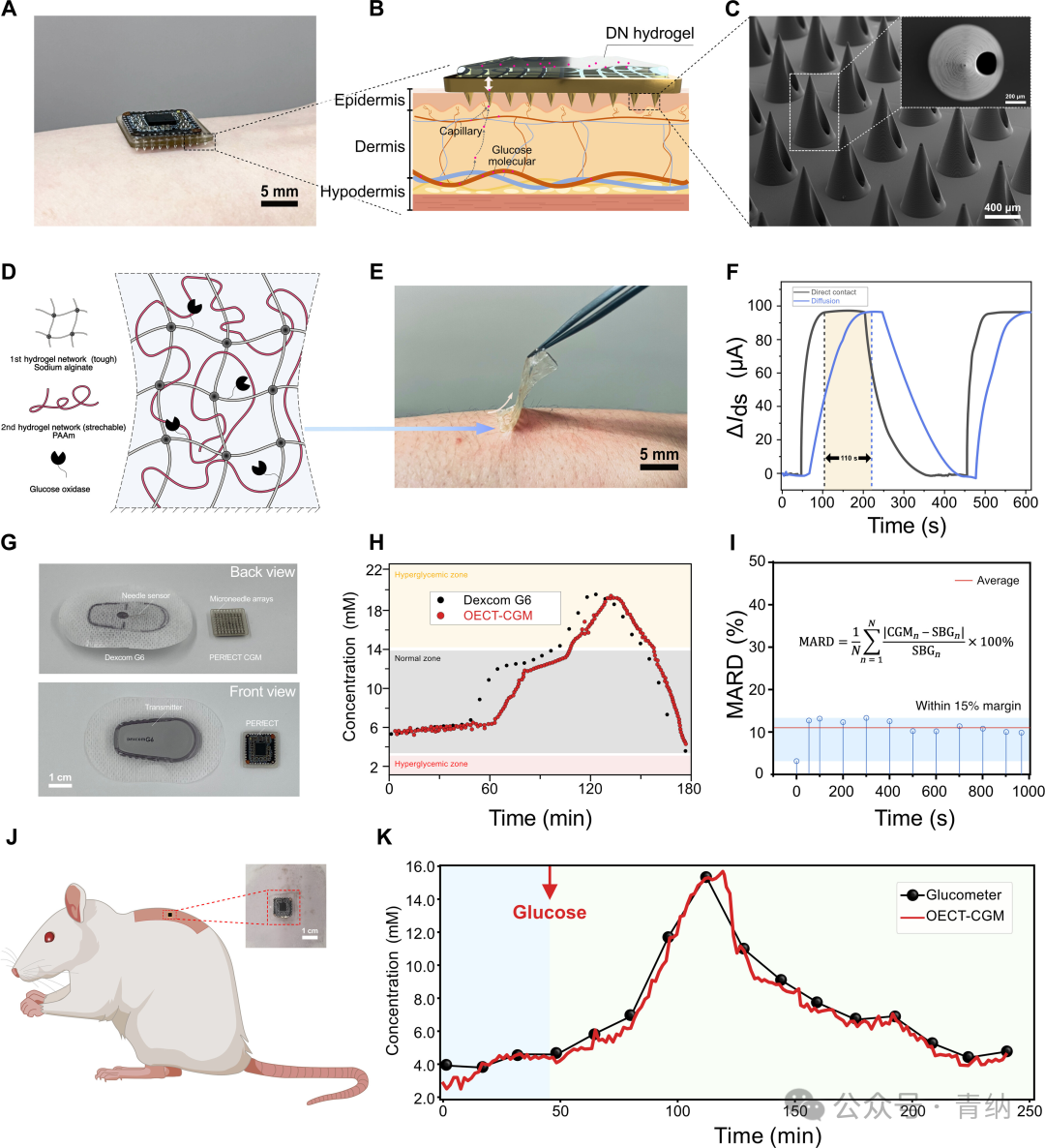
图4 完全集成的OECT-CGM原型和体内评估
综上所述,该研究提出了一个硬币大小的全集成可穿戴OECT-CGM系统。该系统将OECT生物传感器、微针和扩散性水凝胶有机地结合在一起,并分别进行了优化,以实现无缝集成和可定制的生物传感。此外,研究人员进行了体外和体内实验,评估了OECT-CGM系统未来在个性化和精准糖尿病保健中的可行性。与传统的血糖监测系统相比,OECT-CGM系统具有抗噪能力强、灵敏度和分辨率可调、佩戴舒适等特点,可为未来的精准糖尿病医疗提供个性化的血糖监测。
论文链接: https://doi.org/10.1126/sciadv.adl1856
-
电化学传感器ppt2008-07-02 11657
-
新型铜互连方法—电化学机械抛光技术研究进展2009-10-06 7185
-
电化学原理介绍和分析方法2017-10-16 11698
-
应用电化学传感器的设计2018-11-15 2983
-
基于电化学传感器的Arduino兼容电化学气体检测电路CN03572020-03-12 4207
-
电化学传感器的发展怎么样?2020-03-25 3142
-
电化学工作站有什么功能?2020-03-30 3794
-
LabVIEW开发新型电化学性能测试设备2023-12-10 4178
-
熔盐电化学反应炉温度控制系统研究2009-02-27 852
-
一种被称为有机电化学晶体管(OECT)的新型晶体管技术2021-03-17 15015
-
有机晶体管基本元件的构建、工作原理及柔性高密度阵列的制备策略2022-11-28 2383
-
综述:基于有机电化学晶体管的集成传感阵列2022-12-07 2963
-
我国在有机电化学晶体管及互补电路方面取得突破2023-01-29 1937
-
利用有机电化学晶体管放大微弱的生物化学信号2023-04-15 2605
-
基于有机电化学晶体管的适配体生物传感器用于伤口愈合程度监测2023-06-04 1369
全部0条评论

快来发表一下你的评论吧 !

