

微流控器官芯片中生物分子的无试剂共价固定研究
描述
微流控系统已经成为实验室芯片和器官芯片应用中的重要组成部分,其通常使用聚二甲基硅氧烷(PDMS)芯片和玻璃基片制造。但这些材料缺乏生物医学场景应用所需的生物活性。为克服这个问题,研究人员通常使用氧(O₂)等离子体对材料进行处理或使用化学试剂(如氨基硅烷)来固定生物分子。然而,O₂等离子体处理不稳定,无法共价固定生物分子,而湿化学方法则具有毒性、耗时和昂贵的缺点。
近期,来自澳大利亚悉尼大学(The University of Sydney)的Anna Waterhouse和Marcela Bilek团队开发了一种新型微流控平台,该平台结合了两种等离子体表面处理方法:等离子体活化涂层(PAC)和大气压等离子体射流(APPJ),从而实现了无试剂的共价固定生物分子。这种混合微流控平台的键合强度与标准的O₂等离子体装置相当,但在动脉芯片模型中大大提高了内皮细胞的生长。该平台还适用于冠状动脉剪切等高剪切应用。通过在微流控系统中提供无试剂的共价固定生物分子,这项技术有潜力从根本上改善器官芯片、实验室芯片系统以及即时诊断传感器的开发。相关工作以“Reagent-Free Covalent Immobilization of Biomolecules in a Microfluidic Organ-On-A-Chip”为题发表在国际顶级期刊Advanced Functional Materials上。
PAC和APPJ在PDMS和玻璃表面诱导官能团并产生自由基
本研究探究了利用三种不同的等离子体处理方法来处理微流控基底,它们分别是O₂等离子体、PAC和APPJ(图1A)。研究人员使用XPS和EPR进行表面表征,以评估不同处理后的表面化学性质。XPS分析显示,在所有处理中,都存在一个强烈的氧峰,这是因为在处理后暴露在空气中时,自由基和反应性基团容易与大气中的氧发生氧化反应,这个过程被称为自氧化。与未处理样品(UT)相比,PAC处理引入了氮和碳,这从XPS分析中N1s和C1s峰的增强可以明显看出,而且不受基底的影响(图1B、C)。为更详细地了解基底上的碳物种和所研究的处理方法,对C1s峰进行了解卷积,得到了4个不同的结合能(284.2、286、287.5和289 eV),分别与C-C、C-O(或C-N)、C=O(或C=N)和O-C=O键相关联(图1D)。从定性角度上看,PDMS和玻璃上的C1s峰相似。与这些基底上的O₂等离子体不同,PAC处理PDMS和APPJ处理玻璃在各自的基底上引入了多样的功能基团,包括酮基(C=O)和羧基(O-C=O)(图1D)。
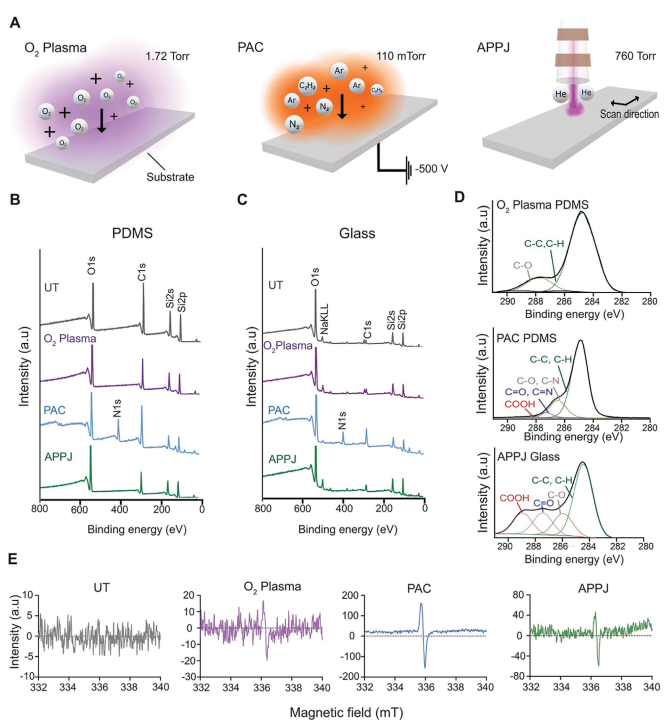
图1 PAC和APPJ可诱导形成官能团和自由基
为进一步表征这些表面及其老化特性,本研究评估了它们的润湿性。样品在室温下储存于环境条件中。未处理的PDMS具有109°±2的水接触角,经过O₂等离子体、PAC和APPJ处理后,分别降至5°±2°、28.0°±1.2°和4°±2°(图2A)。经过O₂等离子体或APPJ处理的PDMS在4天内恢复了其原始润湿性。未处理的玻璃具有62.37°±0.04°的水接触角,经过O₂等离子体、PAC和APPJ处理后,分别降至6°±2°、26°±2°和5°±3°(图2B)。在14天内,这些处理方法都没有恢复到玻璃的原始润湿性。疏水恢复受到空气暴露和较高温度的影响。因此,可以优化适当的无氧储存条件和较低的温度,以保持表面特性更长时间。
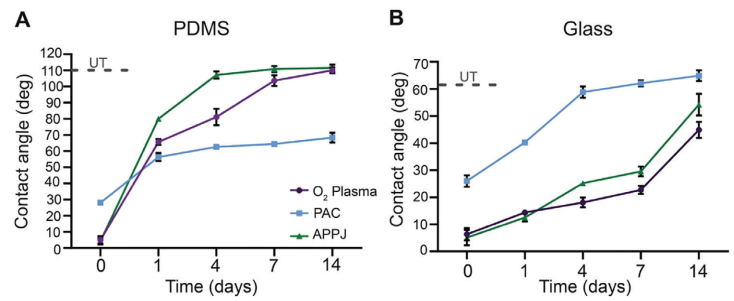
图2 PDMS上的PAC润湿性恢复较慢
PAC和APPJ可将纤连蛋白共价固定在PDMS和玻璃上
为实现蛋白质与表面的共价固定化,以及控制定向和高表面覆盖度,本研究探究了等离子体处理表面共价固定关键细胞外基质蛋白纤维连接蛋白的能力(图3A)。在PDMS和玻璃上的结果相似,在未处理和等离子体处理的基底上存在相当数量的物理吸附的纤维连接蛋白(图3B、C)。为具体量化共价固定,样品经过了SDS洗涤,这是一种已经被广泛接受的去除非共价结合生物分子的方法。在用SDS洗涤样品后,在未处理样品上观察到极少量的纤维连接蛋白,表明几乎没有或没有共价固定。值得注意的是,经过O₂等离子体处理的基底也未能在PDMS和玻璃上共价固定纤维连接蛋白,在SDS处理后显示出较低的蛋白质水平(图3B、C)。有趣的是,经过APPJ和PAC处理的基底含有显著更多的共价结合的纤维连接蛋白,在SDS洗涤后仍然保留(P < 0.05),与PDMS和玻璃上的O₂等离子体和未处理样品相比(图3B、C)。这些数据突出了APPJ和PAC在微流控技术中共价固定生物分子的潜力。
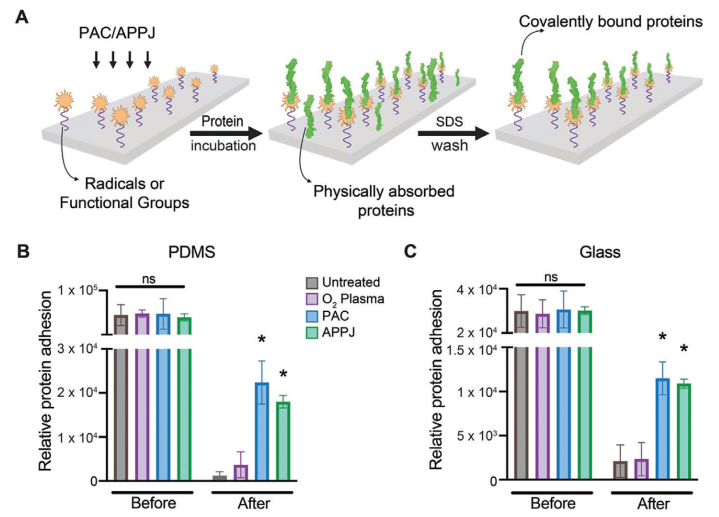
图3 PAC和APPJ可将纤维连接蛋白共价固定在PDMS和玻璃上
PAC和APPJ处理可促进HCAEC在玻璃基底上的附着
在确定了PAC和APPJ共价固定纤维连接蛋白的能力后,本研究探究了人冠状动脉内皮细胞(HCAEC)在玻璃和PDMS上的附着和增殖情况,以评估它们在器官芯片应用中的潜力(图4A)。在未处理的玻璃和PDMS上观察到极少的细胞附着,而组织培养(TC)塑料强烈促进了细胞附着。有趣的是,所有经过等离子体处理的PDMS样品的细胞附着情况相似(图4B)。类似地,与未处理的玻璃相比,O₂等离子体处理并未促进细胞附着,但在形态上,O₂等离子体处理表面上的HCAEC呈现出较少的圆形,表明更好地附着于底物上(图4C)。然而,与未处理的玻璃相比,PAC和APPJ处理显著提高了细胞在玻璃上的附着(P < 0.01),并且相对于O₂等离子体处理的玻璃也有显著改善(P < 0.05)(图4B)。
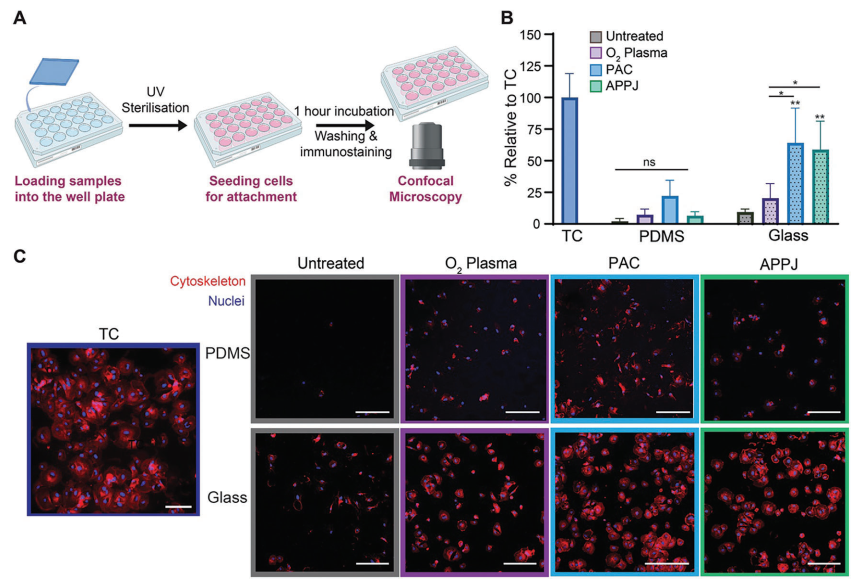
图4 PAC和APPJ处理可促进HCAEC在玻璃表面的附着
PAC促进HCAEC在PDMS和玻璃基底上增殖,APPJ促进HCAEC在玻璃上增殖
为更好地了解这些表面支持细胞生长的倾向,本研究评估了HCAEC在3天和5天后的增殖情况。未经处理的玻璃和PDMS上发生了极少的细胞附着,因此这些样品未包括在增殖研究中。正如预期的那样,TC塑料在3天和5天内强烈支持细胞增殖(图5A-C)。然而,在PDMS上,无论是经过O₂等离子体处理还是APPJ处理,都未能支持细胞生长,即使经过5天,表面上也只有少数细胞存在(图5A-C)。相比之下,与O₂等离子体和APPJ处理相比,经过PAC处理的PDMS上的细胞增殖率提高了四倍(P < 0.05),显示出与当前金标准材料TC塑料相当的支持细胞生长能力。在玻璃基底上,总体上与附着实验类似,HCAEC的增殖率比处理相似的PDMS基底要高。虽然O₂等离子体处理的玻璃与TC塑料表现相当,但经过PAC处理的玻璃上的细胞增殖率在3天内比O₂等离子体处理的玻璃高2.1倍(P < 0.05)(图5C)。相比TC塑料,PAC和APPJ处理的玻璃基底上的细胞增殖率增加了1.1倍(P < 0.05)。虽然在第5天时,等离子体处理的玻璃基底之间没有观察到差异,但这是因为样品上形成了近似连续单层的细胞。这些结果表明,PAC处理有效地支持PDMS和玻璃基底上的细胞增殖,而APPJ处理在玻璃基底上促进了最高程度的增殖。本研究还在类似条件下培养了人冠状动脉平滑肌细胞(HCASMCs),并获得了相同的增殖趋势。
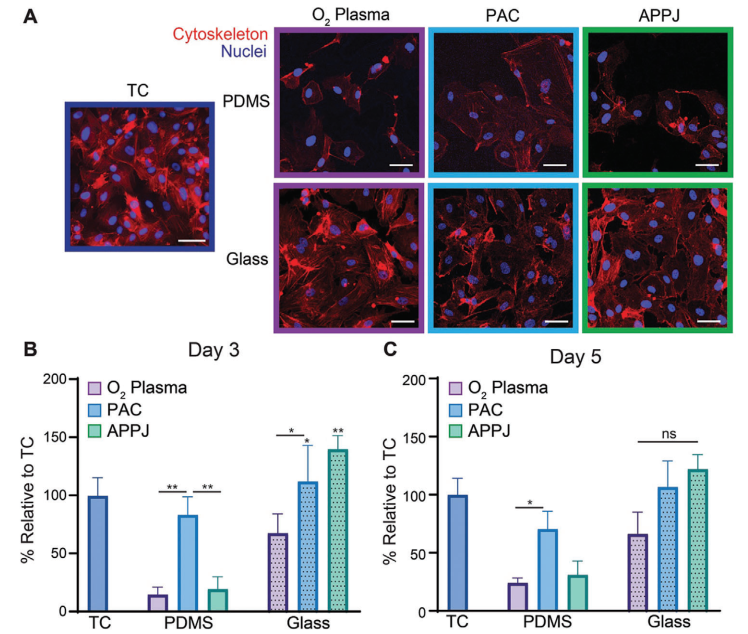
图5 PAC可促进HCAEC在PDMS和玻璃基底上增殖,APPJ可促进HCAEC在玻璃基底上增殖
PAC和APPJ处理促进了HCAEC在动脉芯片中的生长和功能
为确定使用PAC和APPJ处理共价固定纤维连接蛋白是否能够支持微流控通道中的细胞行为的改善,利用这些等离子体处理方法开发了一种动脉芯片系统。为此,对所有生长表面(玻璃和PDMS)进行了相关等离子体处理(包括O₂等离子体、PAC或APPJ)。以后,这些装置被称为O₂等离子体、PAC或APPJ装置(图6A)。HCAEC在这些装置中进行培养,连续灌注并在低剪切力(0.007 dyn/cm²)下培养3天。在没有斑点蛋白功能化的装置中,等离子体处理之间的细胞数量差异很小(图6B)。然而,在涂覆了斑点蛋白之后,在PAC(P < 0.001)和APPJ(P < 0.0001)装置上存在至少1.6倍的细胞,与本研究的共价固定数据和斑点蛋白促进细胞增殖的能力一致(图6C)。有趣的是,与O₂等离子体处理的装置相比,经斑点蛋白涂层后,APPJ装置和PAC装置上的细胞数量更多(分别为P < 0.01和P < 0.0001),APPJ装置上的细胞数量也比PAC装置多1.3倍(P < 0.01)。尽管斑点蛋白在微流控中促进了细胞增殖,但经过斑点蛋白涂层的氧等离子体处理装置与未涂层的PAC和APPJ装置的细胞计数相当(P > 0.05),突显了这些新型等离子体处理方法在器官芯片平台上的优越性。
本研究还对CD31的表达进行了定量分析。CD31是一种关键的内皮细胞标记物,在没有斑点蛋白涂层的情况下,O₂等离子体装置上的HCAEC表达的CD31比PAC装置少1.3倍(P < 0.01),但与APPJ装置相比没有差异,而且PAC和APPJ装置之间的CD31水平相当(P > 0.05)(图6D)。在斑点蛋白功能化之后,所有三种装置类型上的CD31水平都有所增加,但在处理之间没有观察到差异(P > 0.05)。与细胞增殖趋势类似,未涂覆斑点蛋白的PAC和APPJ装置中的HCAEC表达的CD31水平与涂覆斑点蛋白的氧等离子体装置相当(P > 0.05)。
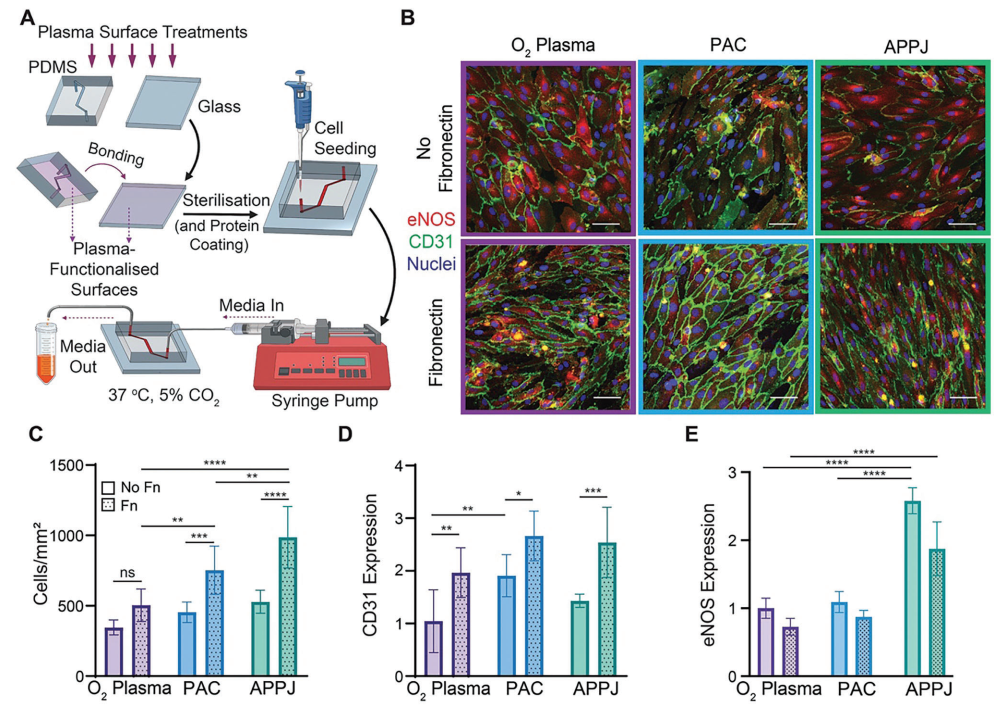
图6 PAC和APPJ治疗可促进HCAEC在芯片中的动脉的生长和功能
PAC-APPJ混合装置可改善低剪切力和冠状动脉剪切力条件下的内皮化效果
根据衰老和生物活性结果,本研究得出结论:对于PDMS材料,PAC处理是最佳选择;而对于玻璃基底,APPJ提供最佳结果。然而,只有APPJ处理的装置才能提供足够的稳定性和结合强度,以用于涉及高流体流动或剪切力的实验,这在许多器官芯片应用中是必需的。通过将APPJ处理的玻璃与PAC处理的PDMS结合,本研究开发了一种混合微流控装置,克服了PAC处理装置的结合强度问题,同时实现了蛋白质的共价固定和所有表面上优越的细胞生长。为了创建这种混合微流控装置,PDMS键合表面被屏蔽,只暴露通道表面,然后该区域经过PAC处理(图7A)。然后,移除屏蔽层,并将底物经过APPJ处理并与经过APPJ处理的玻璃盖片键合。由于键合是通过APPJ处理的表面进行的,所以这种混合微流控装置保持了这些键合的高强度,同时确保两种底物相对于标准方法都提供了优越的细胞增殖(图7A)。使用XPS和厚度分析评估,发现PAC表面在APPJ处理后没有显著变化。
为评估混合微流控装置在经过斑点蛋白功能化后用于器官芯片应用的潜力,将内皮细胞的生长与经过O₂等离子体处理的装置进行了比较。在混合装置中,发现在3天内几乎完全内皮化,而在经过O₂等离子体处理的装置中没有观察到这种情况(图7B-D)。与传统的O₂等离子体装置相比,混合装置上的顶部PDMS(P < 0.05)和底部玻璃基底(P < 0.01)上的细胞数量更多,这与静态增殖研究中观察到的趋势非常相似(图5C),突显了该平台的优越生物功能化。为了进一步优化其性能,本研究在冠状剪切条件(12.7 dyn/cm²)下在混合装置中培养HCAEC细胞3天,细胞在玻璃基底上形成了一层连续而有序的单层(这是典型的暴露于剪切力的内皮细胞的特征),在顶部PDMS表面上几乎完全内皮化(图7E)。相比之下,与顶部的PAC处理的PDMS相比,HCAEC在APPJ处理的玻璃表面上更加有序。与低剪切力装置上相同的表面相比,两种表面上的HCAEC都更加有序(P < 0.0001)(图7F)。综上所述,这些结果表明,本研究的混合微流控装置能够在低剪切力和冠状剪切条件下实现微流控芯片的优越内皮化。
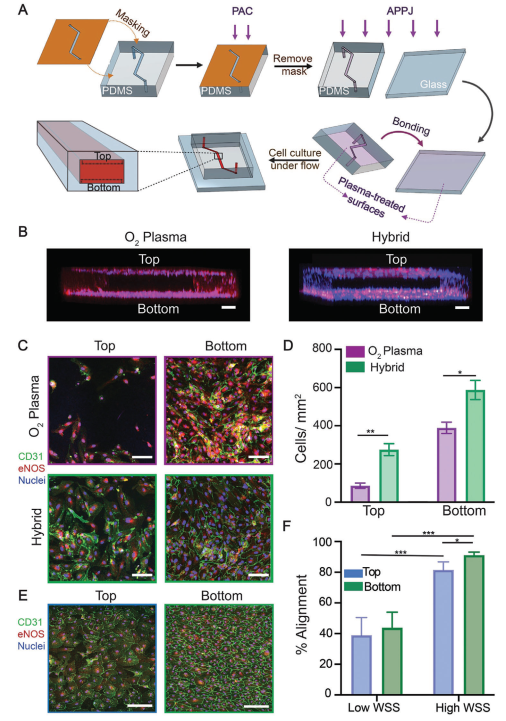
图7 混合微流控装置促进芯片动脉健康内皮的形成
综上所述,本研究开发了一种混合等离子体处理的微流控平台,利用PAC和APPJ在微流控表面上共价固定生物分子,极大地改善了动脉芯片中细胞的附着和增殖。本研究的系统具有与标准方法相当的键合强度,并且在PDMS上具有改善的老化特性。考虑到该平台能够在微流控系统中共价固定生物分子,本研究的技术可以应用于更广泛的领域,包括即时诊断、实验室芯片,或不同的器官芯片模型系统。此外,本研究的技术的广泛适用性还可以在生物学和医学以外的领域使用,例如进行食品或环境中分子的传感。
论文链接: https://doi.org/10.1002/adfm.202313664
-
芯片上的器官2013-07-12 3151
-
微流控分析芯片2018-06-22 2410
-
太赫兹(THz)光谱在生物大分子研究中有何应用?2019-05-29 2893
-
在AFM探针上固定生物分子用于MRFM和TREC研究应用简报2019-11-01 1288
-
有序介孔分子筛的生物大分子固定化研究2009-10-26 718
-
微流控生物芯片的磁场仿真及实验对比2010-01-11 1013
-
人体器官芯片的医学研究应用2019-04-21 7459
-
多器官微流控芯片的研究进展,并对其发展趋势进行了展望2019-05-06 5717
-
芯片上的器官模型 有专门的微流控平台2020-03-23 3745
-
微流控芯片不同基体材料生物相容性对比2022-08-19 3728
-
模块化微流控芯片可远程实时控制脑类器官生长2023-01-03 3020
-
综述:用于预测结直肠癌系统性治疗疗效的类器官和器官芯片研究进展2023-03-02 2414
-
生物应用微流控芯片中的磁珠操控综述2023-10-07 3234
-
高通量生物分析技术之微流控芯片2024-11-14 1189
-
飞秒激光技术在微流控芯片中的应用2025-04-22 1158
全部0条评论

快来发表一下你的评论吧 !

