

利用无标记光流控平台,实现对生物纳米颗粒的分子指纹识别
描述
以高通量方式对多种分析物进行无标记检测是生物传感应用领域长期追求的目标之一。然而,对于全光学方法而言,如何将最先进的无标记技术与能高通量处理小体积样品的微流控技术以及能赋予分析特异性的表面化学技术相结合,是迄今为止面临的一项重大挑战。
据麦姆斯咨询报道,近期,来自瑞士苏黎世联邦理工学院(ETH Zurich)和美国哈佛大学医学院附属麻省总医院(Massachusetts General Hospital,Harvard Medical School)的研究人员提出了一种无标记光流控(optofluidic)平台,它将最先进的数字全息技术与基于聚二甲基硅氧烷(PDMS)的微流控技术相结合,并利用支撑性脂质双层膜(SLB)作为表面化学构件,将这两种技术融为一体。具体而言,这种光流控平台通过具有单颗粒灵敏度的多路复用无标记免疫亲和检测方法,实现了对异质生物纳米颗粒群的指纹识别。相关研究成果以“Molecular fingerprinting of biological nanoparticles with a label-free optofluidic platform”为题发表在Nature Communications期刊上。
在这项工作中,研究人员围绕以下三个方面,实现了对异质纳米颗粒悬浮液进行无标记分子指纹分析的目标:(1)单颗粒灵敏度的大视场(FOV)成像;(2)高通量、小体积和可单独寻址的微流控通道;(3)用于拉下免疫亲和检测的片内表面功能化方法。
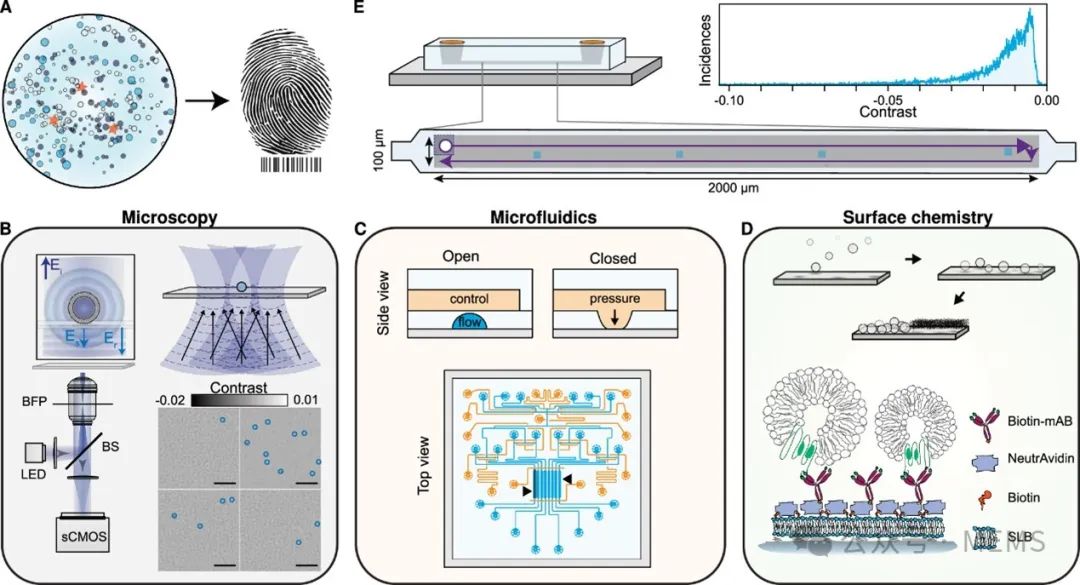
图1 无标记光流控平台的示意图和工作流程
首先,为了实现大视场(FOV)成像,研究人员使用了反射式内联全息显微镜,由于该研究只对微流控芯片表面和固定在其上的纳米颗粒之间的干涉感兴趣,因此需要借助空间非相干光源来实现。图1B展示了光流控平台的光学读出策略。作为成像区域,该研究的目标是实现100 μm × 100 μm左右的照明FOV,由于微流控芯片中多个密接界面反射产生的有害寄生条纹的存在,使用高数值孔径(NA)物镜的干涉散射(iSCAT)显微镜(一种数字内联全息方法)很难实现这种效果。通过微流控芯片成像时,利用空间非相干照明除了能够减少这些寄生干扰,还能大大降低斑点的影响。因此,该研究利用窄带光纤耦合发光二极管(LED)作为光源成像到样品上。样品的散射光以及微流控芯片基底界面的微弱反射光被NA物镜收集,随后,二者之间的干涉被成像到相机上。为了扩展FOV,研究人员按照既定的计算机视觉程序拼接了一系列光栅扫描图像。
为了满足小体积试剂、多路复用和通量的需求,研究人员使用了基于Quake微阀的PDMS基微流控芯片(图1C)。这种微流控芯片由控制层(橙色)和流动层(浅蓝色)组成,可独立处理不同的传感通道(黑色箭头),在不受使用者操作干扰的情况下可以精细控制免疫捕获检测的每一步。此外,在该研究提出的微流控芯片的每个微流控通道中可以独立进行不同的检测实验,并通过计算机界面对检测实验进行程序化控制,从而为实现免疫检测的长期自动化提供了可能。此外,就该微流控免疫检测平台使用的样品总体积而言,每个传感区域的体积大约为10 nL(长、宽、高分别为3 mm、0.3 mm和0.01 mm),加上通道的入口和出口路径区域,每个微流控通道的体积大约为40 nL。因此,整个微流控芯片使用的样品量总计不到0.5 μL。
最后,在表面化学方面,为了将建立的微流控技术和成像技术结合在一起,研究人员选择了SLB(图1D)作为片内功能化方案的基材,这是因为SLB具有仿生性质,易于制备,且具有内在防污特性和片上兼容性。通过熔融辅助囊泡融合方法制备的SLB可以同时作为防止非特异性结合的钝化涂层,以及免疫捕获拉下检测的构件。
随后,研究人员对构建的光流控免疫检测平台的稳健性和检测性能进行了表征,并将其应用于通过表面蛋白生物标志物对四种不同的卵巢细胞来源的细胞外囊泡(EV)群进行分析,从而为每种细胞系开发出独特的生物标志物指纹。
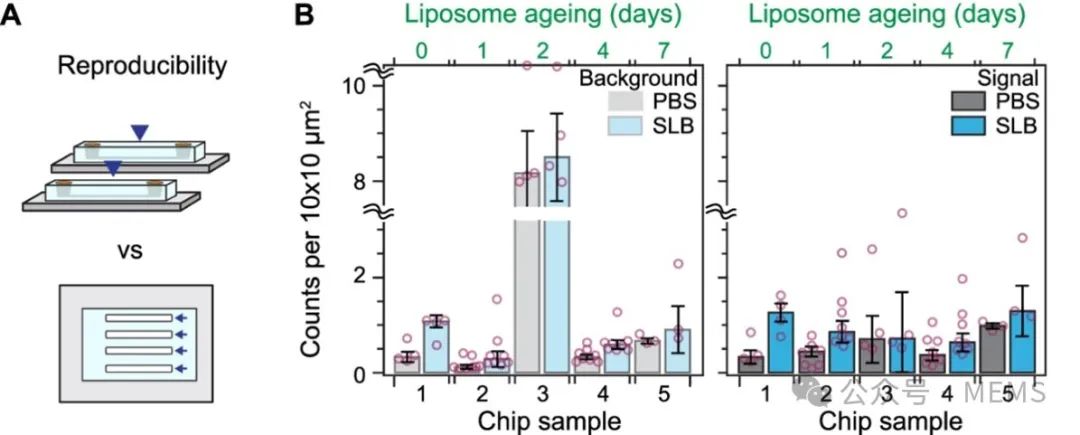
图2 光流控免疫检测平台的重现性和稳健性
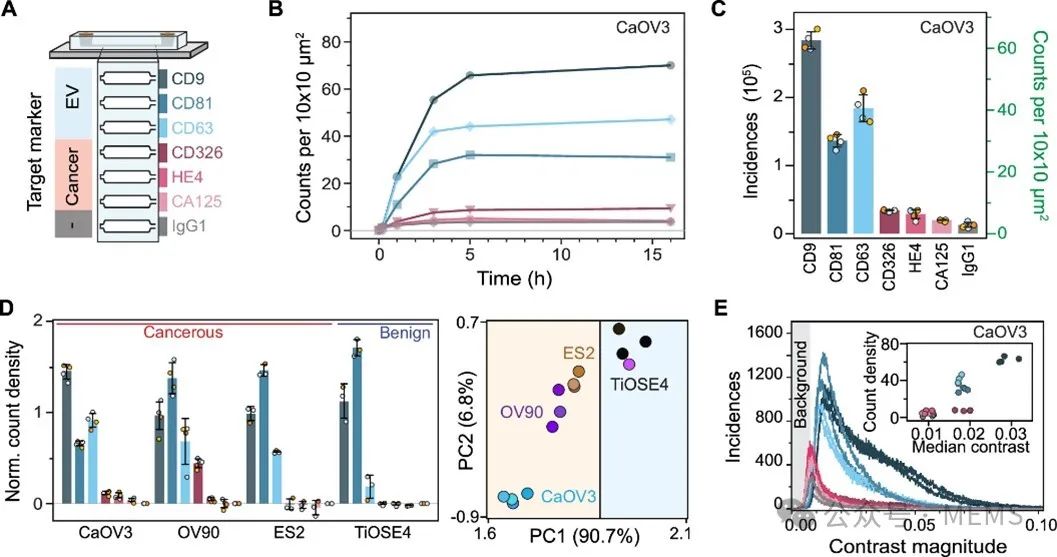
图3 多路复用细胞外囊泡(EV)指纹图谱
综上所述,这项研究提出了一种利用微流控芯片上空间相互隔离的微通道对溶液中的生物纳米颗粒进行多路复用和分析的方法。该研究提出的微流控芯片可以通过增加独立通道的数量对其进行扩展以实现更复杂的器件设计。因此,微流控器件的大小和复杂程度将成为多路复用的最终限制因素。不过,作为一种补充途径,该研究提出的平台也完全兼容单分子荧光读出方法,因此可以与最先进的荧光标记抗体或aptamer文库相结合,实现大规模单颗粒分析。展望未来,将该研究提出的光流控平台与片上标准加入法和改进的表面钝化技术相结合,就能根据选定的疾病生物标志物对疾病进行诊断和护理监测。
总之,研究结果表明,该研究提出的光流控平台整合了必要的检测步骤,能以无标记的方式对异质生物纳米颗粒(例如EV)群体进行分子级别的分析,并具有单颗粒灵敏度、数据统计的稳健性和高度的可重复性。该平台的光学读出技术,可以实现对免疫检测流程的持续原位监测,从而能够从稳健性、样品制备时间和所得涂层的高质量等方面优化表面功能化方案。此外,该方法具有通过结合生物标志物群的信息及其对比信息来研究EV潜在异质性的能力。可以预见,在不受颗粒对比度的大小和折射率影响后,这些检测方法将为在单个EV层面结合分子指纹、大小和有效物质组成信息,从而更好地表征和研究EV的异质性铺平道路。
论文链接:
https://doi.org/10.1038/s41467-024-48132-4
审核编辑:刘清
-
超声波指纹模组灵敏度飞升!低温纳米烧结银浆立大功2025-05-22 2285
-
指纹识别在新型学籍管理系统中的应用2010-04-24 3204
-
新唐指纹识别2015-01-27 5178
-
指纹识别算法2016-08-23 4288
-
指纹识别技术原理及发展2018-11-12 3841
-
基于Xilinx的指纹识别大学生体育锻炼管理系统设计2019-06-20 1966
-
基于嵌入式处理器指纹识别系统该怎么设计?2019-09-02 2703
-
基于嵌入式处理器的指纹识别系统该怎么设计?2019-09-17 1930
-
指纹识别传感器的原理是什么2020-05-20 3914
-
瑞萨MCU指纹识别解决方案!2020-09-02 2634
-
Android指纹识别系统的原理与使用相关资料分享2021-06-30 1202
-
怎样去设计一种基于单片机的指纹识别电子密码锁2021-07-13 1053
-
求一种指纹识别方案2021-07-21 1953
-
绝对实用的ARM指纹识别系统方案2021-11-09 1139
-
利用STM32单片机来实现指纹识别或RFID刷卡的门禁或考勤系统2022-02-18 3805
全部0条评论

快来发表一下你的评论吧 !

