

利用微流控探针诱导的化学质膜穿孔,实现单细胞胞内蛋白质递送
描述
将小分子、核酸、蛋白质和药物导入细胞是监测和了解细胞行为以及生物功能的重要途径。然而,质膜是阻止外源分子进入细胞的生物屏障。因此,如何在保持细胞活力的同时高效地将外源分子递送到细胞中是细胞生物学领域的一个重要课题。为了克服现有大规模细胞内递送方法的弱点,例如细胞活性和递送效率不一致,主要基于膜破坏介导机制的微技术已成为一种有前景的解决方案。然而,利用化学质膜穿孔进行单细胞递送的方法尚未得到广泛研究。
据麦姆斯咨询报道,近期,清华大学化学系林金明教授团队在ACS Applied Materials & Interfaces期刊上在线发表了题为“Chemical Plasma Membrane Perforation Generated by a Microfluidic Probe for Single-Cell Intracellular Protein Delivery”的论文。该研究使用微流控探针将含有毛地黄皂苷和目标递送物的溶液精确地作用到单细胞上。毛地黄皂苷与质膜中的胆固醇结合诱导质膜穿孔,目标递送物通过孔进入细胞。碘化丙啶(0.67 kDa)和FITC-葡聚糖(10、40和150 kDa)可以在3分钟内成功引入单细胞,同时保持细胞活力。两种蛋白质(细胞色素C和亲环素A)被递送进入细胞,并观察到它们在细胞中的生理功能。
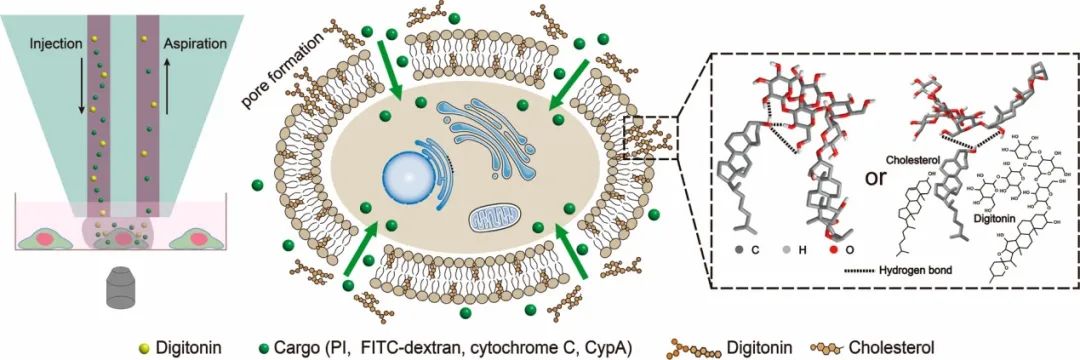
图1 微流控探针诱导单细胞化学质膜穿孔
随后,研究人员利用Comsol Multiphysics软件对微流控探针形成的微区域进行数值模拟。使用荧光素(扩散系数=500 μm²/s)来指示溶质扩散。结果表明,注入的溶液可以被完全吸出,并且溶质被限制在液滴状微区域内而不会扩散,且微区域内溶质浓度分布均匀。研究人员计算了基质上的剪切应力,结果表明,基质上的低剪切应力不会对细胞造成额外的机械损伤。实验在与模拟相同的条件下进行,使用荧光素显示微流控探针产生的微区域,其浓度分布与模拟结果一致。溶液的连续流动使微区域中毛地黄皂苷和目标递送物的浓度几乎恒定,有利于维持递送过程的连续性和稳定性。
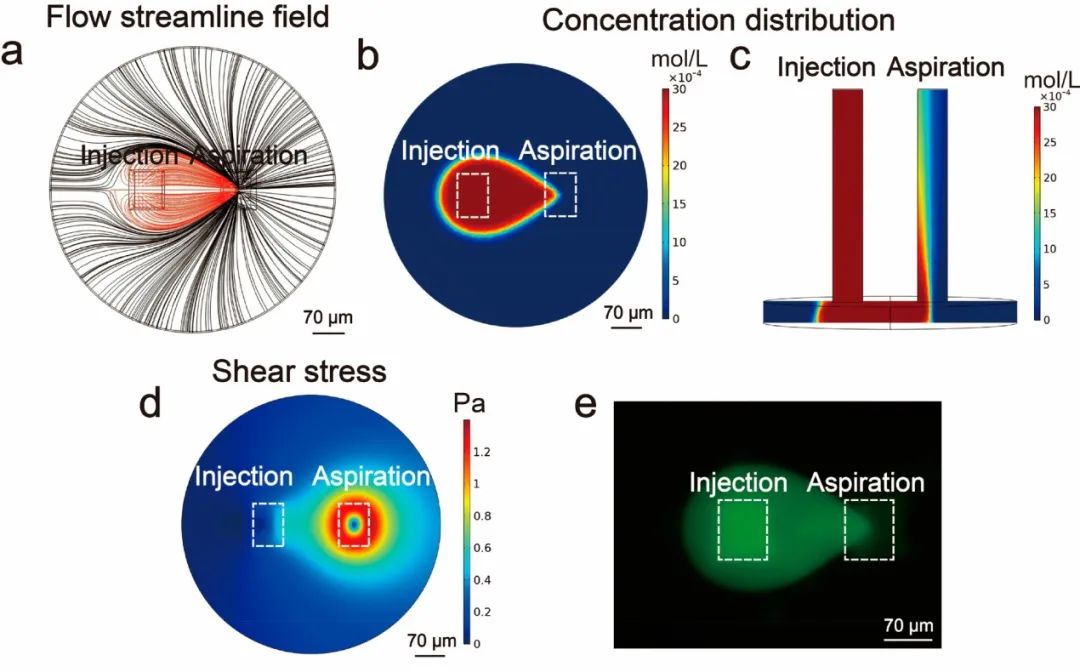
图2 流体的数值模拟
接着,研究人员通过微流控探针进行碘化丙啶(PI)的细胞内递送来验证该方法的可行性以及优化递送条件。研究人员尝试使用20 - 100 μg/mL毛地黄皂苷将PI递送至U87细胞。随着毛地黄皂苷浓度的增加,ts(PI开始进入时间)和tm(PI进入速度最大时间)逐渐减少,表明细胞穿孔加速。当毛地黄皂苷浓度为60 μg/mL时,ts约为20 s,1 min内即可观察到清晰的荧光。此外,还尝试了不同的PI浓度进行细胞内递送,较高的PI浓度也使得PI能够更快地进入细胞。还测试了流速对递送结果的影响。注入流量保持2 μL/min,抽出流量在6~14 μL/min之间调整。当抽吸流速大于8 μL/min时,进入细胞的PI量随着流速的增长而显著增加。
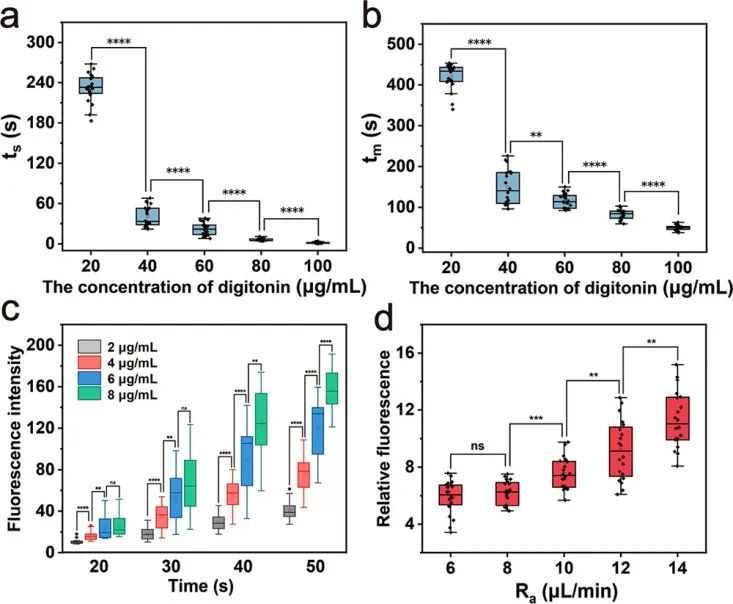
图3 毛地黄皂苷浓度、PI浓度和流速对细胞内递送的影响
为了证明该方法的效率和通用性,使用该方法将PI递送至U87、HUVEC和A549细胞。当递送时间为20秒时,三种类型的细胞几乎不发出荧光。随着递送时间逐渐增加,细胞的相对荧光强度显著增加,递送处理50 s后观察到强烈的红色荧光。由于洋地黄皂苷的作用,质膜逐渐透化,PI通过质膜上形成的孔继续进入细胞。接着,研究人员继续研究了该方法递送大分子的能力。使用不同分子量(10、40和150 kDa)的 FITC-葡聚糖作为目标递送物,结果显示,FITC-葡聚糖可以在3 min内进入细胞,并且FITC-葡聚糖进入的量随着递送时间的增加而增加。
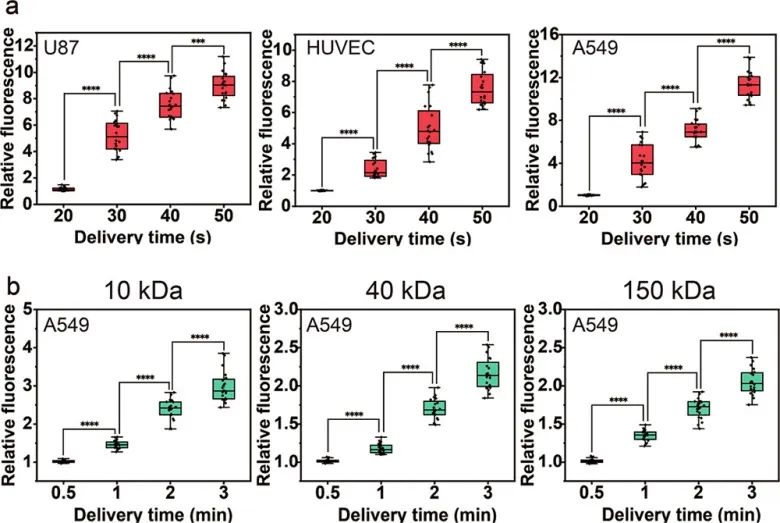
图4 PI和FITC-葡聚糖递送的结果
在验证了这种方法用于单细胞胞内递送的可行性后,研究人员尝试了细胞内蛋白质递送。细胞色素C(Cyt C)(Mw = 13 kDa)是线粒体中的一种蛋白质,可将电子转移到呼吸链以维持ATP的产生。当Cyt C释放到细胞质中时,它会引发细胞凋亡。由于外源Cyt C在正常情况下不能进入细胞,利用微流控探针将Cyt C递送至A549中作为抗肿瘤药物以诱导细胞凋亡。对照组和仅用毛地黄皂苷或Cyt C处理的细胞之间未观察到caspase-3水平和Hoechst 33342染色结果的显著差异。毛地黄皂苷诱导的质膜穿孔不会引起细胞凋亡。仅用Cyt C处理的细胞中caspase-3的水平也没有增加,表明正常情况下Cyt C不能穿过质膜进入细胞激活凋亡途径。然而,在进行毛地黄皂苷介导的Cyt C递送的细胞中,caspase-3水平显著增加,蓝色荧光显著增强。细胞形态发生明显变化,细胞体积缩小,并形成凋亡小体。这些结果表明,递送的Cyt C成功诱导细胞凋亡,并且外源蛋白可以通过微流控探针有效地引入细胞内并发挥作用。
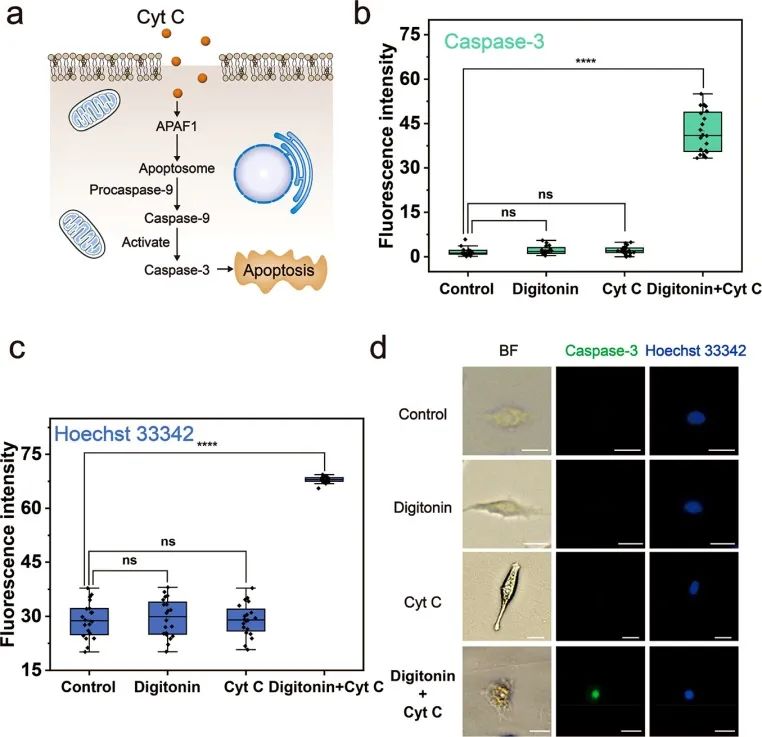
图5 Cyt C被递送至A549以诱导细胞凋亡
为了进一步探索这种方法在细胞研究中的潜力,研究人员利用它来研究肿瘤耐药性。CypA(Mw = 18 kDa)是一种广泛存在的细胞内蛋白质,可充当抗氧化剂。最近有报道称CypA通过重塑细胞氧化状态可以介导结直肠癌耐药。BCNU是一种常用的抗肿瘤药物,其诱导细胞毒性的机制之一是谷胱甘肽还原酶的抑制导致ROS的积累。利用微流控探针将CypA递送到U87中,研究CypA对胶质瘤耐药性的影响。与对照组相比,未经CypA递送的细胞经BCNU处理1小时后ROS水平显著升高,并且细胞形态发生改变。对于递送CypA的细胞,ROS含量显著低于未递送细胞,并且细胞保持正常形态。结果表明,递送的CypA在细胞中具有抗氧化作用,这可能增强U87对BCNU的耐药性。抑制CypA表达可能是治疗神经胶质瘤的潜在方法。
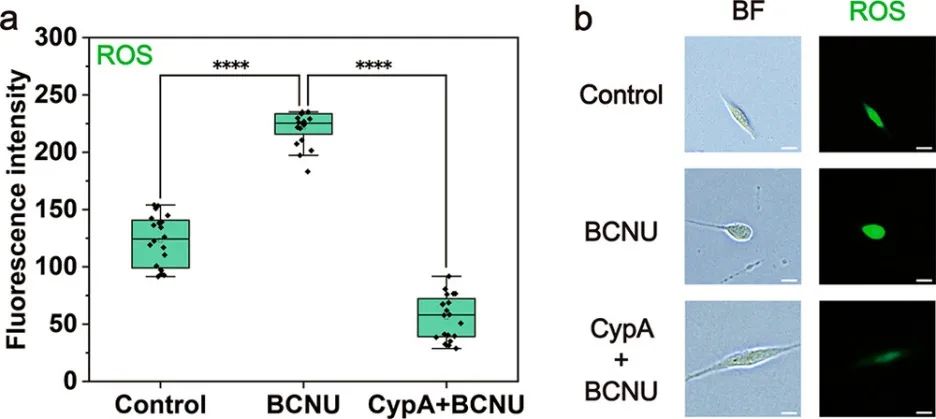
图6 CypA对胶质瘤耐药性的影响
综上所述,研究人员开发了一种基于开放式微流控探针的方法,以方便高效地实现单细胞递送。该方法通过使用化学试剂对单个细胞进行质膜穿孔,将最大分子量为150 kDa的外源目标递送物递送到细胞中。与载体介导或场辅助递送方法相比,该方法不需要对目标递送物进行额外处理,无需物理场辅助的温和递送条件也避免了对目标递送物和细胞的额外损伤。此外,研究人员展示了使用微流控探针进行Cyt C和CypA的细胞内递送,证明了该方法能够研究外源蛋白质对细胞生命活动的影响。未来,各种目标递送物(肽、蛋白质、mRNA、DNA、质粒、细胞器等)可以通过这种方法导入细胞内,调节细胞的生理功能和命运。而且该方法不需要昂贵的设备,操作简单,有望成为单细胞递送的一种理想方法。 清华大学化学系林金明教授为该论文的通讯作者,清华大学化学系2022级博士生宋扬为本论文的第一作者。该研究受到国家重点研发计划(No.2022YFC3400700)和国家自然科学基金(No.22034005)的支持。
论文链接:
https://pubs.acs.org/doi/10.1021/acsami.4c03013
审核编辑:刘清
-
以色列面向生物传感器和电路的蛋白质纳米线2018-11-20 2041
-
面向生物传感器和电路的蛋白质纳米线2018-12-03 1914
-
蛋白质组学技术与药物作用新靶点研究进展 精选资料分享2021-07-26 1625
-
点成分享 | 蛋白质浓度测定之BCA法2022-12-20 4601
-
氧化还原蛋白质电化学研究2009-07-16 1289
-
单细胞蛋白质组学分析研究新突破!将微流控液滴与蛋白质组分析技术相结合2018-07-19 8984
-
基于聚类与特征融合的蛋白质亚细胞定位方法2021-04-08 1068
-
基于CNN和LSTM的蛋白质亚细胞定位研究对比2021-06-11 848
-
基于衰减系数的动态蛋白质预测网络模型2021-06-15 810
-
蛋白质检测仪的使用方法2021-08-09 2324
-
蛋白质检测仪的功能介绍2021-08-27 895
-
食品中蛋白质含量测定仪介绍2021-09-01 965
-
NTA +LC-MS/MS组合在外泌体蛋白质组研究的应用2022-10-28 1919
-
利用纳米阱阵列阻抗传感器实现皮摩尔水平的蛋白质无标记传感2022-11-29 1566
-
可用于单细胞分析的选择性液滴提取微流控装置2023-04-10 1729
全部0条评论

快来发表一下你的评论吧 !

