

合成生物是什么-微流控芯片技术在合成生物学的应用前景
描述
1.“合成生物”是什么?
合成生物其实就是一种“造物”的技术。它融合了生物学、化学和工程学等多种技术,以可再生生物质为原料,以生物体作为生产介质,旨在利用廉价原料,以菌群、细胞和酶为制造工厂,规模化发酵获得目标产品,具有清洁、高效和可再生等特点。
以透明质酸(玻尿酸)为例。最初,透明质酸取自牛的眼睛,价格非常昂贵。但通过生物合成技术,相较于传统的化学技术,既安全环保,成本又低,真正实现了科技改变生活。合成生物学,蕴含着“一切皆可合成”的潜能,隐藏着解锁新质生产力的密码,也是目前从海外到国内最火的未来产业新赛道之一。如江南大学团队利用合成生物学技术,借助微生物发酵生产普通分子量的透明质酸,把成本降到每公斤几百元,实现了透明质酸大产量推广应用。团队通过人工合成方法,对现有的、天然存在的生物系统进行重新设计和改造,甚至创造出自然界不存在的“生物结构”,大大提高了产量。
2.合成生物学表型测试生物反应器有哪些?
合成生物学经过多年的发展,形成了典型的细胞工厂创制“设计-构建-测试-学习”(design-build-testlearn, DBTL) 循环,成为支撑面向加速生物制造发展的智慧生物育种的重要方法。其中,测试环节是对前期所设计与构建的生物体系进行表型测试,以提供大量数据用于后续的学习和迭代升级。测试阶段的通量主要依赖于细胞自身或其培养测试所使用的生物反应器及其装备,是整个DBTL流程的限速步骤。本文系统综述了合成生物学表型测试所开发的面向不同通量的生物反应器及装备,从单细胞检测和筛选及不同尺度生物反应器包括皮纳升级生物反应器、微升级生物反应器、毫升级生物反应器和升级生物反应器等。
在DBTL循环的表型测试环节中,针对不同应用目标和不同通量需求的测试,生物反应器成为主要的表型研究工具,比如单细胞检测筛选技术、基于多孔板的高通量筛选技术以及基于微流控的高通量筛选技术。
1)单细胞分选法
单细胞筛选是指根据细胞自身的特征,如细胞的形状、密度、大小、光信号、图像特征等进行筛选。单细胞悬滴法则是根据液滴重力或微泵将包含单个细胞的液滴分配到目标基板(如微孔板)上,而非目标液滴则被转移至废液收集瓶中,分选过程温和,但速度受限。此外,近年来有许多研究在微流控芯片上设计了许多微结构以实现细胞或粒子的主动分选,包括微井结构阵列单细胞捕获、确定性横向位移 (deterministic lateral displacement, DLD)和惯性流系统(inertial microfluidic),可基于单个细胞的直径大小和弹性对大量细胞进行快速高通量分选,且无需对细胞进行标记检测即可实现目标细胞分离。
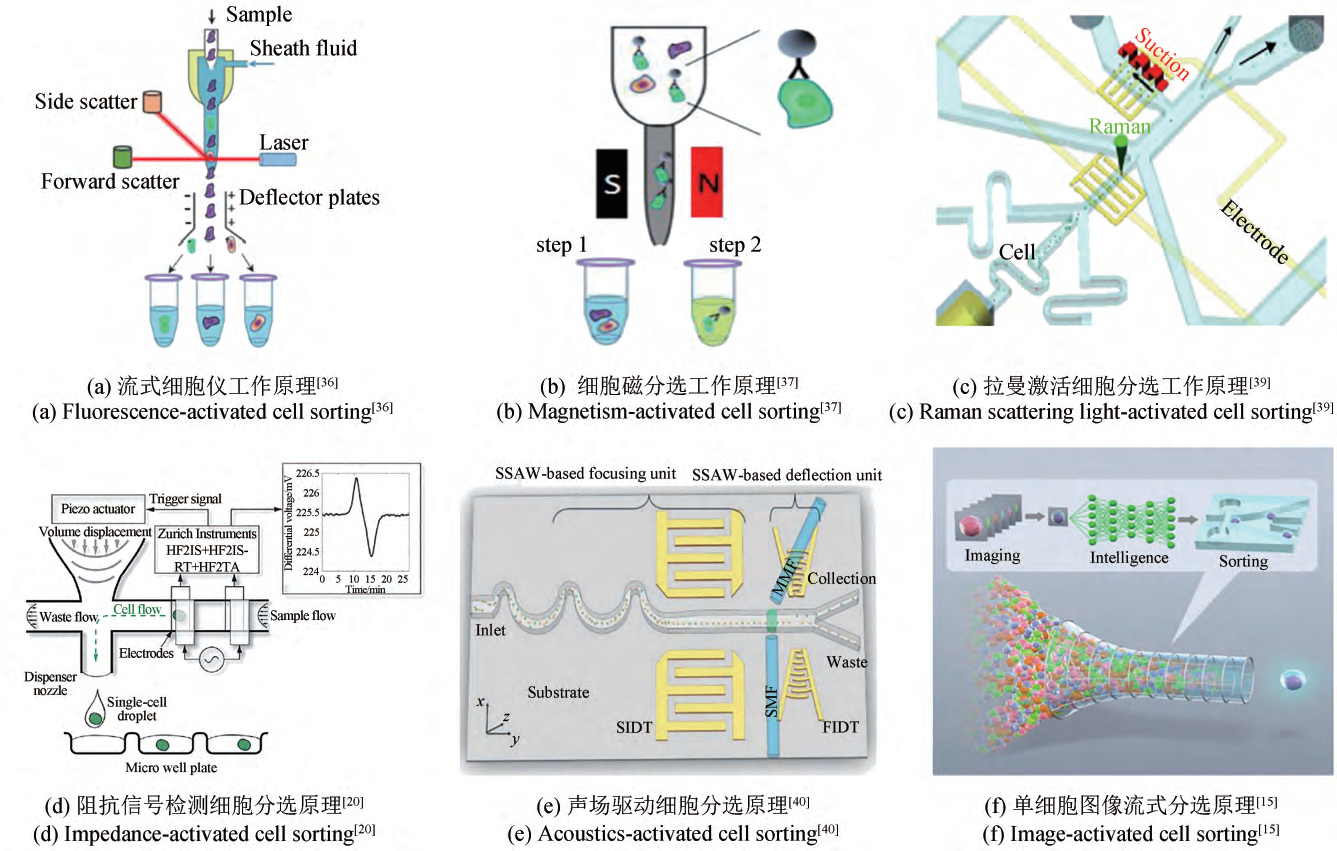
图1 单细胞检测与分选装置工作原理图
2)皮纳升级微型生物反应器
皮纳升级生物反应器体积范围 1 pL~100 nL,主要包括两种类型:一种是采用微加工技术在基板上制作微孔阵列,微孔直径常小于500 μm,细胞装入微孔中进行培养和检测,基于
微孔的单细胞筛选的通量约为102~103个;另一种是基于微液滴的生物反应器,它是由液滴微流控技术产生的,将细胞封装在液滴中进行培养和检测,液滴直径常小于 200 μm,基于微液滴的单细胞筛选技术的通量为105~108个。这些皮纳升规模的生物反应器相对于大型生物反应器可以有效提高细胞生长的初始浓度,为单细胞提供非竞争性的生长空间 ,更有利于细 胞的生长和代谢。
液滴微流控是指通过油相和水相在微流控芯片中进行相互剪切,形成大规模的均匀液滴群,这些液滴直径常小于 300 μm,在微生物学高通量单细胞培养和分析方面已显示出其独特优势。微液滴具有通量高、体积小、易操作、传质传热迅速等特点,已日益成为单细胞分析的重要工具,其应用包括聚合酶链反应(polymerase chain reaction,PCR)、细胞培养、分选、分离、克隆形成、细胞裂解、基因和蛋白质表达、抗体分泌以及细胞毒性分析研究。在微生物学领域,液滴通常是指油包水(Water-in-Oil, W/O)结构的微液滴,可以很容易地通过主动和被动的液滴生成技术制备。单细胞培养的液滴大小从皮升到纳升不等,由于细胞在生成液滴过程中是随机分配到液滴内的,被包裹在液滴中的细胞数量及其分布概率服从泊松分布统计学规律,这与有限稀释方法类似。为了提高单细胞包封率,研究人员利用惯性流体技术或介电泳技术对芯片上液滴生成单元上游的细胞进行排序,并控制其逐一进入液滴,使得单细胞包封率可提高至 80% 以上。液滴形成后,可将液滴群储存在小容器中,如离心管、微管或其他自制容器中,然后放置在合适的温度、湿度和气体环境中进行孵育,微生物可在液滴中进行增殖和代谢。考虑到不同微生物种类需要不同的氧气浓度,研究人员采用高透气性微管路来储存液滴,氧气和二氧化碳可以通过管壁不断渗透到油相中,或者对油相进行反复充氧,使其给液滴供氧。
液滴的检测与流式细胞术类似,其检测信号包括荧光、拉曼、图像、光散射、阻抗、核磁、电化学、质谱和光吸收度等。对于液滴分选,与单细胞分选方式类似,仍然可以利用电场、磁场、光场、声场、重力场、流体动力场所产生的力来驱动液滴到收集或废液通道。通过上述检测方式和分选方式的组合集成,可以实现高通量、高效率的微生物检测与筛选。在皮纳升微液滴反应器中,较为广泛使用的装置是荧光激活液滴分选系统(fluorescence activated droplet sorting,FADS)。其是将液滴荧光检测和介电泳分选方式进行集成设计,检测到液滴荧光信号后,如果是感兴趣的目标液滴,则在微流控芯片下游用介电泳所产生
的驱动力推动至收集通道中,完成液滴的检测分选,该技术平台在微生物高通量筛选和酶进化领域已经获得了广泛应用,有较多的相关文献综述报道。
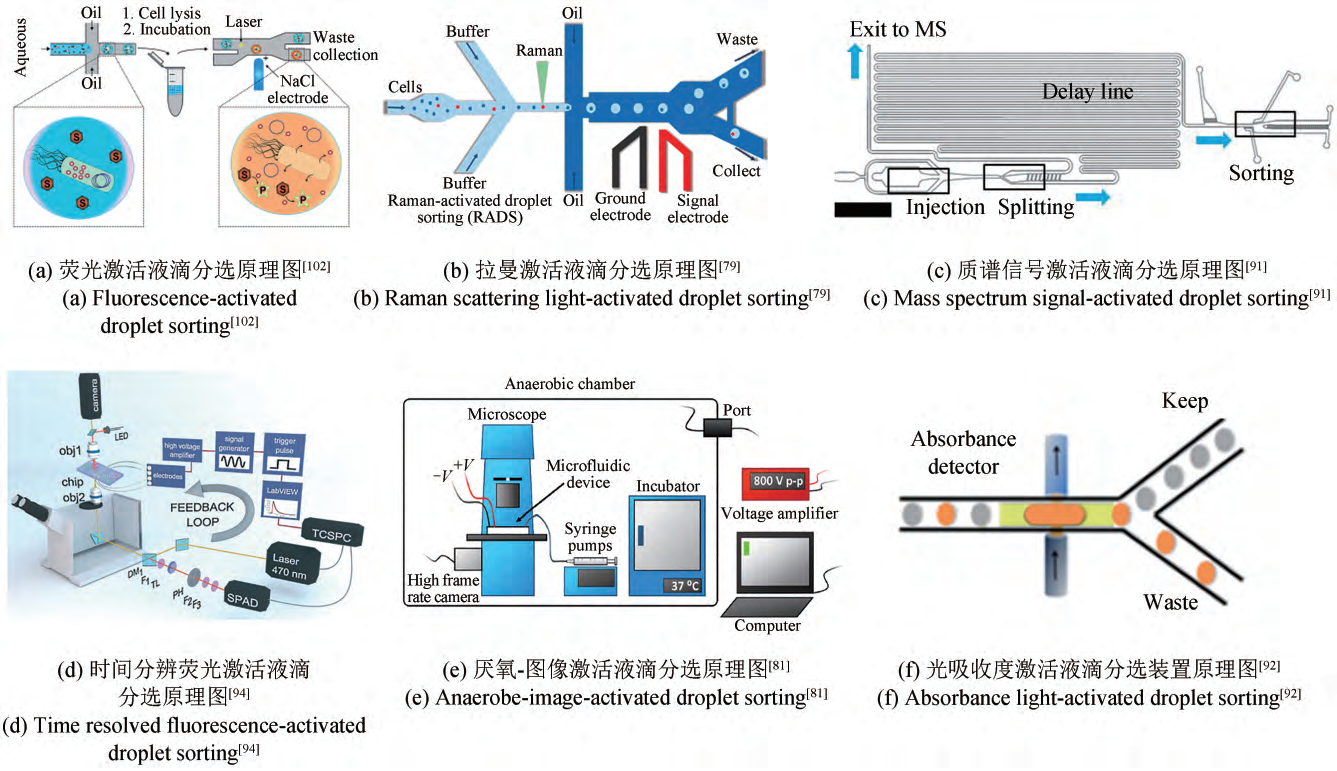
图2 基于皮纳升微液滴的单细胞表型测试与筛选
3.微流控技术在合成生物学的应用前景展望
液滴微流控技术具有操作容易、通量高、液滴培养数字化和易自动化等特点,是适于合成生物学高通量表型测试的颇具广泛应用前景的方法。商业化的装备系统体积小、运行成本低、使用和维护方便,越来越受到广大科研人员和工程技术人员的关注,成为合成生物学发展的智慧平台。目前,液滴微流控技术仍处于产业化上升期,虽然已有部分技术实现了产业化推广,但如何进一步实现微液滴的高度稳定、提升液滴通量的精准可控性、实现微液滴装备的创新定制化以及液滴操作的标准化和自动化等方面仍然存在大量的基础科学和工程科学问题需要深入研究。另外,需要发展更多适用于不同尺度液滴体系的表型测试传感器,显著提升表型表征能力,构建更多维度的基因型-表型模型,为液滴微流控技术在DBTL循环中的应用提供更强大的使能工具,最终实现开发国产替代高通量自动化合成生物设施平台,突破我国生物技术装备研发能力弱、自主创新设备欠缺等“卡脖子”问题,加速我国合成生物技术原始创新步伐,支撑绿色生物经济的高质量发展。
免责声明:本文资讯编译自学术期刊动态,以传播知识、有益学习和研究为宗旨,如内容有误,请批评指正。转载仅供参考学习传递有用信息,版权归原作者所有,如侵犯权益,请联系删除。
审核编辑 黄宇
- 相关推荐
- 热点推荐
- 微流控芯片
-
生物技术药物学实验指导书2009-03-18 3189
-
基于XML的生物学远程诊断系统2009-09-02 784
-
“建物致知”的合成生物学!引领“第三次生物科技革命”的合成生物学2018-08-10 18577
-
合成生物学的发展与面临的挑战2018-08-29 21997
-
如何利用微流控芯片来“合成”人造组织2018-12-25 6582
-
探析液滴微流控技术在植物生物学领域的巨大潜力2019-02-25 5895
-
未来的合成生物学“黑客”:他们用声音窃取DNA合成信息2019-03-18 3011
-
利用生物来制作商品,合成生物学也许将是制造业的未来2019-04-07 5210
-
科学家研发用于无细胞合成生物学的电子化学平台2019-11-28 1436
-
合成生物学为溶瘤病毒的工程改造提供了更先进的理论和技术工具2020-10-23 4031
-
基于合成生物学技术的材料设计2021-01-06 4720
-
挽救生命的合成生物学解决方案2021-02-19 1922
-
基于合成生物学技术生产的产品又有哪些优势呢?2021-06-22 3769
-
微流控技术的生物学应用2024-12-01 884
全部0条评论

快来发表一下你的评论吧 !

