

脑磁图(MEG)新型技术及功能特点-多通道光泵磁力计便携平台
描述
脑磁图(MEG)新型技术及功能特点
多通道光泵磁力计便携平台
脑磁图(MEG)发展背景前景介绍
脑磁图(MEG)通过评估神经电流产生的磁场来测量大脑功能。传统的MEG使用超导传感器,这对性能、实用性和部署产生了重大限制;然而,近年来,光泵磁力计optically-pumped-magnetometers(OPMs)的引入使该领域发生了革命性变化。OPMs可以在没有低温的情况下测量MEG信号,从而实现了“OPM-MEG”系统的概念,该系统表面上允许增加灵敏度和分辨率、寿命依从性、自由受试者移动和更低的成本。在这里,我们报告了一种新的OPM-MEG设计,具有小型化和集成的电子控制、高水平的便携性和改进的传感器动态范围(可以说是现有仪器的最大限制)。我们表明,与已建立的仪器相比,该系统产生等效的措施;具体而言,当测量任务诱导的beta带、伽马带和诱发的神经电反应时,来自两个系统的源定位具有高度可比性,时间相关性>0.7在个体水平和>0.9群体中。使用电磁体模,我们通过在背景场中运行系统来证明改进的动态范围8nT。我们表明,该系统在自由运动期间(包括坐立范式)收集数据是有效的,并且它与同时electroencephalography(EEG-临床标准)兼容。最后,我们通过在两个实验室之间移动系统来证明可移植性。总体而言,我们的新系统被证明是OPM-MEG技术的重要一步,并为下一代功能医学成像提供了一个有吸引力的平台。
脑磁图(MEG)测量电流通过大脑神经元组装产生的磁场(Cohen 1968)。这些磁场的数学建模产生三维图像,显示electrophysiological活动的空间和时间特征。MEG是研究大脑功能的成熟工具,在神经科学和临床实践中具有应用(Baillet,2017)。在神经科学中,它可用于测量诱发反应,神经振荡,功能连接和网络动力学-显示大脑如何不断形成和溶解支持认知的网络。临床上,MEG最常用于癫痫,以定位负责癫痫发作的大脑区域以及周围雄辩的皮层(De Tiège et al.,2017)。还有其他潜在的应用,从研究儿童常见疾病(例如,自闭症听觉诱发反应潜伏期的测量(Matsuzaki等人,2019年))到调查老年人的神经退行性疾病(例如,痴呆症皮质减缓的测量(Gouw等人,2021年))。MEG在空间精度(因为磁场对头骨的扭曲比EEG测量的电位小)和灵敏度(因为EEG更受非神经元来源(如肌肉)的人工制品的影响)方面优于临床标准electroencephalography(EEG)(Boto等人,2019年;Goldenholz等人,2009年)
近年来,MEG仪器通过引入光泵磁力计(OPMs)而发生了革命性的变化。(参见(Brookes等人,2022年;Schofield等人,2023年;Tierney等人,2019年)的评论。)OPMs测量磁场的灵敏度与传统MEG使用的传感器相似,但不需要低温冷却。它们也可以是微制造的(Schwindt等人,2007年;V. Shah等人,2007年,2020年;V.K.Shah&Wakai,2013年),因此它们小巧轻便。这导致了多种优势。例如,传感器可以放置在更靠近头皮表面的位置(与低温设备相比,不再需要热绝缘间隙);这显著提高了信号幅度(Boto等人,2016年,2017年;livanainen等人,2017,2019,2020)理论计算表明,这可以提供前所未有的空间分辨率(高于传统的MEG和EEG)(Nugent等人,2022年;Tierney等人,2022年;Wens,2023年)。阵列可以适应任何头部形状-从新生儿到成年人(Corvilain等人,2024年;Feys等人,2023年;Hill等人,2019年;Rier等人,2024年)。适应性还意味着阵列可以设计为优化对特定效应(Hill等人,2024年)或大脑区域(Lin等人,2019年;Tierney,Levy等人,2021年)的敏感性。当传感器随着头部移动时,参与者可以在记录期间自由移动(假设背景场得到良好控制)(Holmes等,2018,2019,2023;Rea等,2021)。这使得在新任务期间记录数据(Boto等,2018;Rea等,2022)甚至癫痫发作(Feys等,2023;Hillebrand等,2023)。对不同头部大小/形状的适应性加上运动鲁棒性(Feys&De Tiège,2024)意味着,像EEG一样,OPM-MEG系统是可穿戴的。然而,与EEG不同,传感器不需要与头部进行电接触,使得OPM-MEG在患者友好性方面比EEG更实用。
最后,即使在开发的早期阶段,基于OPM的系统也比传统的MEG设备更便宜。这些显著的优势在理论上可能导致OPMMEG成为electrophysiological测量的首选方法,甚至有可能取代EEG成为某些应用的临床工具。
多通道OPM-MEG系统数据采集分析
我们最初的目标是比较两种不同的OPM-MEG系统。两者都由64个三轴Quspin QZFM OPM传感器(QuSpin Inc. Colorado,USA)组成,每个传感器都能够在三个正交方向上测量磁场,从而实现192个独立通道的数据收集。传感器设计已经有了很好的记录(Boto等人,2022;V.Shah等人,2020),这里不再详细重复;简而言之,每个传感器头都是一个独立的单元,包括一个87Rb蒸汽电池,一个用于光泵浦的激光器,一个用于电池内场控制的板载电磁线圈和两个用于信号读出的光电二极管。光束分离器将激光输出分开,相关光学器件通过电池投射两个正交光束,以实现三轴场测量。传感器的中位数噪声底限预计~15fT/sqrt(Hz)在3-100 Hz范围内。这比典型的单轴或双轴OPM的噪声底略高,因为需要将激光束分开进行三轴测量(Boto et al.,2022)。两个系统的传感器安装在相同的3D打印头盔中(Cerca Magnetics Limited,Nottingham,UK),确保阵列几何形状对于所有测量都是相同的(参见图1A-插图)。阵列被放置在一个磁屏蔽室(MSR)中,包括四个金属层和一个铜层,以分别衰减DC/低频和高频磁干扰场(Magnetic Shields Limited,Kent,UK)。MSR墙壁配备了消磁线圈,以减少扫描前的残余磁化。MSR还配备了矩阵线圈(Holmeset al.,2023)和指纹线圈(Holmeset al.,2019)-两者都能够进行主动场控制(Cerca Magnetics Limited,Nottingham,UK)。单个“采集”计算机用于OPM-MEG控制和数据采集;该范式(以及相关的时间标记(“触发器”)描述了向受试者提供刺激的时间)由第二台“刺激”计算机控制。视觉刺激通过波导投影到位于受试者前方的背投影屏幕上~100 cm呈现。我们使用了Optoma HD39 Darbee投影仪,刷新率为120 Hz。两个系统的示意图如图1C所示。
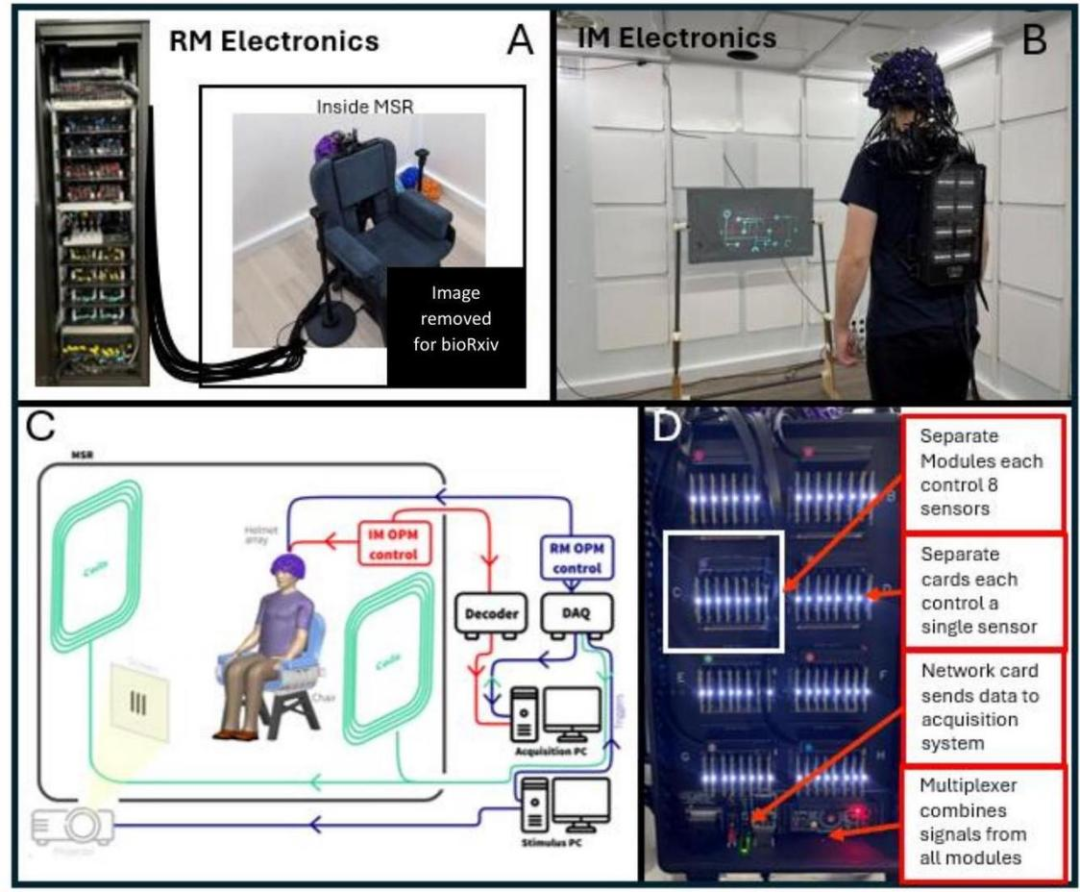
图1:OPM-MEG系统:A)机架安装(RM)OPM-MEG系统;传感器头通过MSR外的电子机架控制。B)集成小型化(IM)OPM-MEG系统;受试者佩戴的背包内包含所有控制和采集电子设备。系统原理图——对两个系统都有效,主要区别是电子OPM:红色路径显示IM系统,蓝色显示RM系统。集成微型系统的电子设备照片。
图2显示了我们的RM和IM系统之间的比较结果。单个主题的结果显示(在所有6次运行中平均);第二个主题的等效图在补充材料中提供。面板A显示按钮按下期间的beta调制。在这两个系统中,最大的beta调制被定位到左侧初级感觉运动皮层(由于右食指的运动),时间过程显示出明显的运动诱导beta幅度的减少,如预期的那样。图2B显示了圆刺激呈现期间的伽马调制。在这里,最大的刺激诱导增加在主要视觉区域,并观察到刺激呈现期间伽马幅度的预期增加。图2C显示了对面部呈现的诱发反应。图像显示了诱发反应的空间签名,其延迟为~170ms,主要在梭形区域。
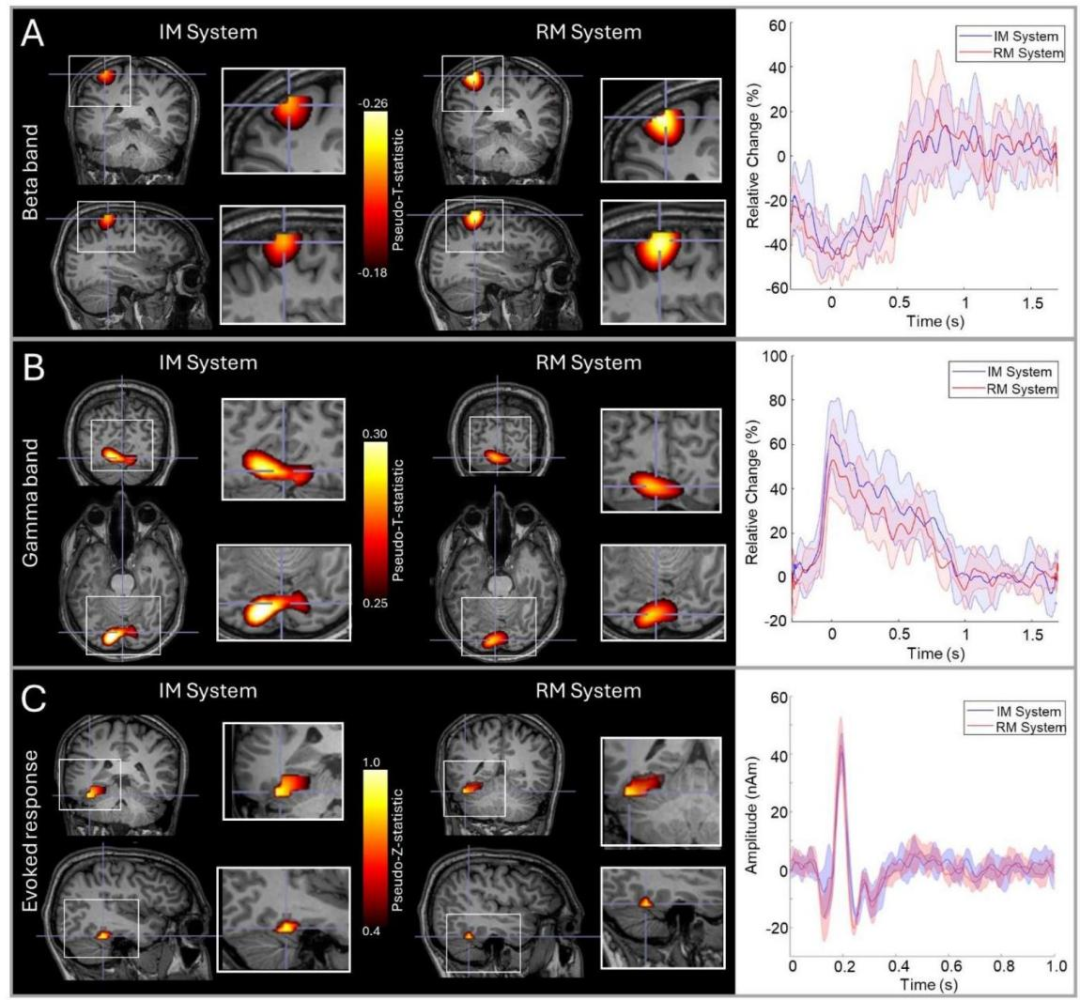
图2:RM和IM系统比较:A)手指运动的β带反应;在左边的图像中,叠加显示最大beta调制的位置,右边的时间过程显示beta带振幅的时间演变。b)对视觉刺激的伽马反应;图像显示伽马调制的位置,时间过程显示伽马带振幅的演变。c)对面部呈现的诱发反应;图像显示最高诱发功率的位置,时间过程显示试验平均诱发反应。在所有三种情况下,数据在6次运行中平均;显示了两个系统的图像,在时间过程图中,红色表示RM系统,蓝色表示IM系统,阴影区域表示运行均方差。
图3显示了我们的坐立任务的结果。图3A和C图分别显示了beta调制和从初级感觉运动皮层峰值提取的TFS的pseudo-T-statistical图像。最大的beta调制局限于双侧感觉运动区域,从手部区域中间延伸到负责腿部运动的区域(回想一下,任务涉及站立时手指运动,所以这是可以预料的)。TFS在每次试验的前4秒显示出清晰的beta带不同步,而受试者正在运动。图3 显示了传感器测量的原始磁场数据。大多数传感器显示由运动产生的背景场偏移,>1.5 nT这超过了传感器在开环模式下运行时的动态范围。尽管有这些大的场偏移,传感器仍保持运行。虽然传感器在开环运行时可以进行这些测量,但信号的准确性将受到增益和CAPE误差的显著阻碍(Borna et al.,2022)。
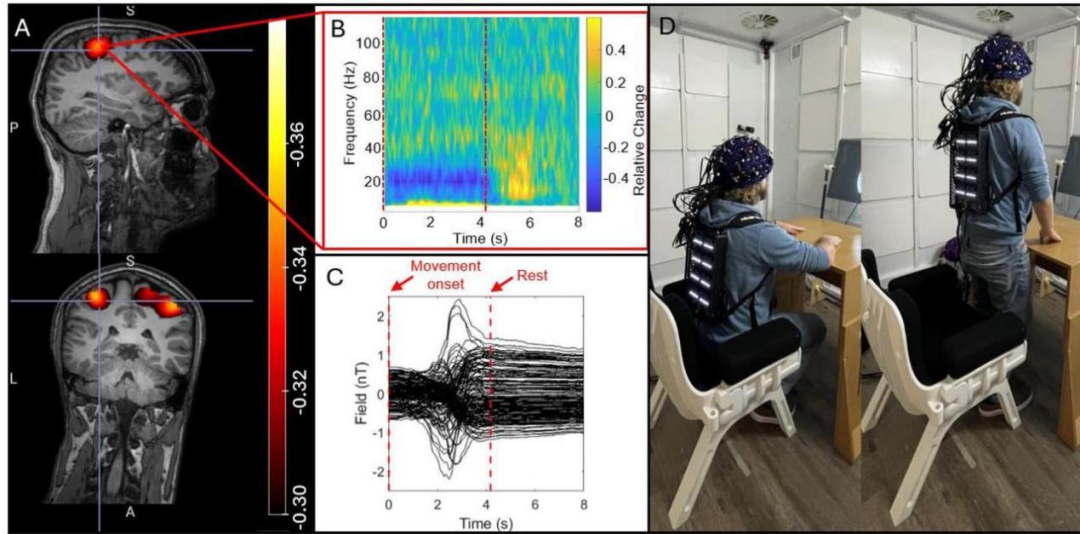
图3:坐立任务:A)任务引起的beta调制的空间特征。B)通道测量的原始磁场,显示传感器穿过a ~2 nT背景场,参与者从坐姿移动到站姿。C)来自感觉运动皮层的TFS,显示神经振荡的时频演变。D)任务的再现,以展示运动范围。
· 并发OPM-MEG/EEG联动对比 ·
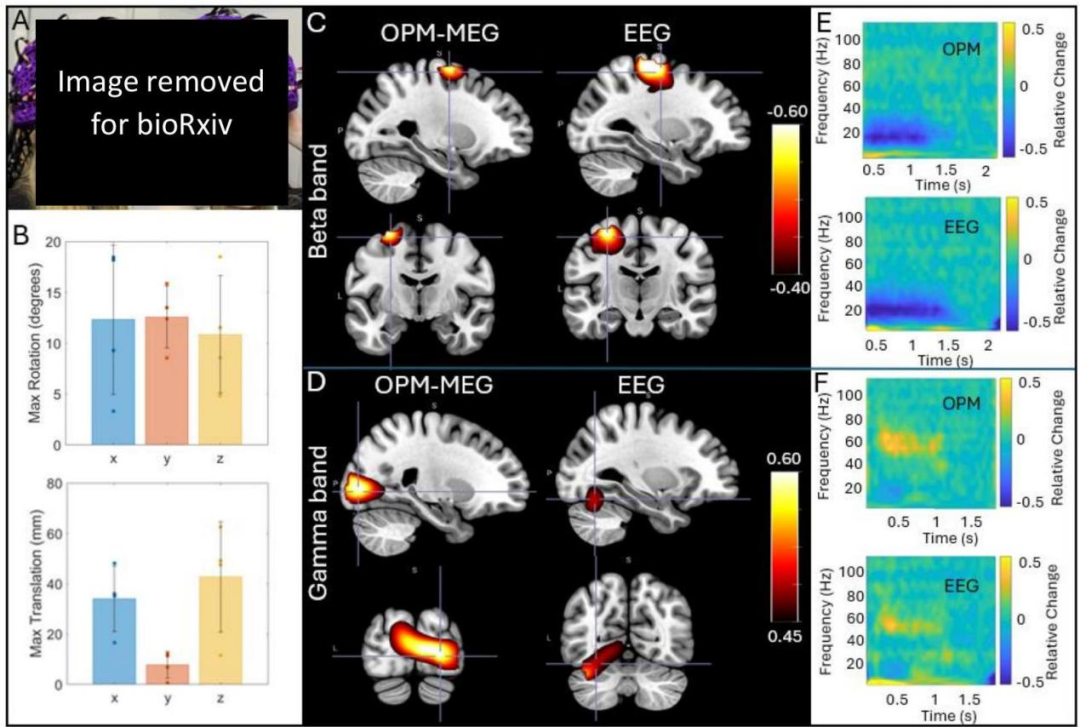
图4:并发OPM-MEG/EEG:A)戴着EEG帽和OPM-MEG头盔的参与者。b)在自然头部运动期间记录数据:显示了实验中受试者所做的最大平移和旋转。条代表受试者的平均值;数据点显示每个个体受试者的值。C)和D)分别显示组平均beta和伽马效应。在这两种情况下pseudo-T-statistical图像和相关的TFS(来自beta的最小值和伽马视觉皮层的中心点)在这些图像中显示了EEG和MEG。所有数据都是在运动的情况下记录的。
小型化OPM-MEG系统总结
我们的总体目标是展示一种新的OPM-MEG系统,具有集成和小型化的电子设备,并测试其评估人体electrophysiological功能的可行性。我们的主要演示看到新的IM系统在两个受试者中多次使用,以提供与已建立的OPM-MEG设备的比较,该设备以前已经得到广泛验证(Boto等人,2022;Rea等人,2022;Rier等人,2023,2024),包括与传统MEG(Boto等人,2021;Hill等人,2020;Rhodes等人,2023)。两个系统获得的结果显示出惊人的一致性。源时间在系统之间具有高度可重复性,平均相关性为~0.75对于单个运行,以及>0.9对于同一受试者的多次运行的平均值。总体而言,这些结果表明这两个系统提供了等效的性能。重要的是,这不仅验证了小型化的电子设备,而且还表明MSR内部的这种电子设备(作为背包佩戴)不会在OPM传感器处产生显著的磁干扰,这些干扰不能通过均匀场校正(Tierney等人,2021)和波束成形(Brookes等人,2021)等方法在后处理中被拒绝。
最后,从实际角度来看,IM系统表现良好。在之前的OPM中,MEG系统的鲁棒性一直是一个关键问题,特别是在测量中丢失的通道数量。在这里,在使用我们的IM系统的32个实验中,我们丢失了(平均)3±5通道。在我们丢失通道的情况下,原因通常是传感器头和带状电缆之间的连接。传感器头使用卡扣连接,卡在带状电缆上,进行电气连接。这在制造电缆时需要最小的公差,因为即使是电缆厚度的微小变化也会使卡扣连接器松动,从而导致连接不稳定(这也是IM系统中空房间噪音略微增加的可能原因)。这是该系统未来几代应该改变的事情。尽管有这个小限制,IM系统表现良好。64个Quspin QZFM传感器的设置时间通常约为三分钟——这包括加热蒸汽电池和激光器、用PID控制器锁定温度、优化所有传感器参数、将每个电池内的场归零、校准传感器和打开闭环的时间。每个OPM传感器头的特性略有不同,这意味着控制参数必须在每个传感器的基础上进行优化(就像超导量子干涉设备(SQUID)必须在传统MEG系统中单独调整一样)。在IM系统中,由于这些参数是在传感器启动时优化和设置的,传感器头可以轻松更换,而不需要在更换后重新启动传感器以外的任何东西。这是运行系统时的一个重要的实际优势,进一步增加了设计的模块化。
这里报告了一种全新的OPM-MEG系统设计,具有小型化和集成的电子控制、高水平的便携性和显著改善的动态范围。我们已经证明,与已建立的仪器相比,这种仪器提供了对刺激的诱导和诱发神经电反应的等效测量,并且它提供了改进的动态范围。我们已经证明,该系统在参与者运动期间(包括从坐到站的范例)收集数据是有效的,并且它与同步EEG记录兼容。最后,我们通过在两个实验室之间移动系统来证明便携性。总体而言,我们的新系统代表了OPM-MEG向前迈出的重要一步,并为下一代功能性医学成像提供了极具吸引力的平台。
-
[7.4.1]--7.4三轴磁力计李开鸿 2022-11-10
-
磁力计2013-09-01 5250
-
如何使用这款QMC5883L磁力计呢2022-02-11 2263
-
LIS3MDL三轴磁力计能满足磁通密度为0.23高斯的应用程序吗2022-12-14 662
-
磁力计测出来,x,y,z分别代表什么?2023-10-16 1134
-
新生通讯方式:磁力计2014-07-07 1926
-
磁力泵工作原理_磁力泵结构图及其特点2017-09-27 63111
-
关于小型磁力泵磁环的定制经验分享2018-08-29 747
-
技术分享:九轴传感器之磁力计2020-12-25 2058
-
未磁科技全球首款商用多通道零场原子磁力计研发成功2021-01-19 5422
-
昊量光电设推出第三代零场原子磁力计2022-03-25 2571
-
采用TMR技术具备独创场震恢复功能的BMM350磁力计2023-02-13 2481
-
高性能磁力计2023-09-20 1504
-
MEMS_惯性传感器16-磁力计椭球拟合校准步骤2023-10-15 4187
-
磁力计LIS2MDL开发(4)----MotionMC 执行磁力计校准2024-08-26 4126
全部0条评论

快来发表一下你的评论吧 !

