

ph计原理是什么(基本原理)_ph计测量原理
通用测试仪器
描述
pH计,是一种常用的仪器设备,主要用来精密测量液体介质的酸碱度值,配上相应的离子选择电极也可以测量离子电极电位MV值,pH计被广泛应用于环保、污水处理、科研、制药、发酵、化工、养殖、自来水等领域。该仪器也是食品厂、饮用水厂办QS、HACCP认证中的必备检验设备。
PH计的结构
PH计别名酸度计结构主要由3部分组成,PH酸度计是一种常用的仪器设备。 随着全民经济的迅速发展,PH酸度计应用范围和技术在不断提升,PH计品种繁多。各类酸度计产品被用来精密测量液体介质的酸碱度值, 例如工业生产加工,食品检测等各领域;PH计配上相应的离子选择电极也可以测量离子电极电位MV值。用PH计酸度计进行电位测量,是测量pH最精密的方法。对于初次使用PH计的用户而言,必须要对他们有一个基本的认识,pH计的主要三大结构部件是什么呢?
1、一个参比电极;
2、一个玻璃电极,其电位取决于周围溶液的pH;
3、一个电流计,该电流计能在电阻极大的电路中测量出微小的电位差。
以下是分别说明各部件的主要功能:
1、参比电极的基本功能是维持一个恒定的电位,作为测量各种偏离电位的对照。银-氧化银电极是目前pH中最常用的参比电极。
2、玻璃电极的功能是建立一个对所测量溶液的氢离子活度发生变化作出反应的电位差。把对pH敏感的电极和参比电极放在同一溶液中,就组成一个原电池,该电池的电位是玻璃电极和参比电极电位的代数和。E电池=E参比+E玻璃,如果温度恒定,这个电池的电位随待测溶液的pH变化而变化,而测量pH计中的电池产生的电位是困难的,因其电动势非常小,且电路的阻抗又非常大1-100MΩ;因此,必须把信号放大,使其足以推动标准毫伏表或毫安表。
3、电流计的功能就是将原电池的电位放大若干倍,放大了的信号通过电表显示出,电表指针偏转的程度表示其推动的信号的强度,为了使用上的需要,pH电流表的表盘刻有相应的pH数值;而数字式pH计则直接以数字显出pH值。
ph计原理是什么(基本原理)
离子活度是指电解质溶液中参与电化学反应的离子的有效浓度。离子活度(α)和浓度(c)之间存在定量的关系,其表达式为:α=γc式中:α为离子的活度;γ为离子的活度系数;c为离子的浓度。
γ通常小于1,在溶液无限稀时离子间相互作用趋于零,此时活度系数趋于1,活度等于溶液的实际浓度。一般在水溶液中H离子的浓度非常小,所以H离子的活度基本和其浓度相等。
根据能斯特方程,离子活度与电极电位成正比,因此可对溶液建立起电极电位与活度的关系曲线,此时测定了电位,即可确定离子活度,所以实际上我们是通过测量电位来计算H离子的浓度的。
ph计测量原理
pH计主要用于测量液体中的氢离子浓度。准确地说是测量氢离子活性,得出酸性、中性还是碱性的数值,在自来水、河水、饮料、食品、污水、医疗和化工等领域广泛地使用工业用液体分析仪。
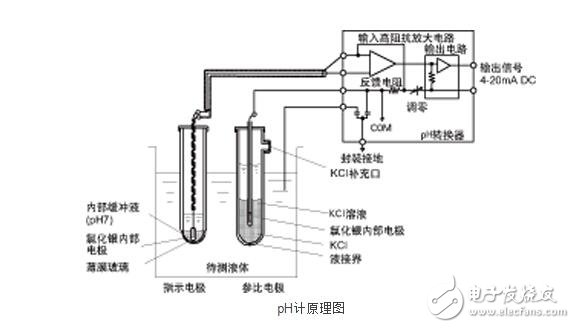
全量程是0~14pH,pH=7为中性,pH《7为酸性,pH值接近0为强酸性。pH》7为碱性,pH值接近14为强碱性。
普通pH计的原理和结构如上图所示,将待测液体氢离子活性作为两根电极之间产生的电位差,通过变送器得到传输信号。
成为基准的电极被称为玻璃电极,从外观来看与玻璃试管相似。但是前端为特殊玻璃制成的数十μmm的薄膜玻璃,内置有内部缓冲液和内部电极。内部电极与待测液体之间有玻璃薄膜,基本上是绝缘状态。
另一端的电极称为比较电极(或参比电极),结构与玻璃电极类似,但前端有液接界,内部液体与待测液体通过缝隙接触。液接界形态多样,包括玻璃纤维形、小孔形、陶瓷形、套管形等,根据具体的用途进行选择。
检测部分的阻抗由于隔着玻璃膜,阻抗大于10MΩ,所以变送部分需要更高的阻抗,必须达到1GΩ以上,放大器与电极之间也使用绝缘性高的导线和端子。
测量液的氢离子活性会使玻璃电极的薄膜玻璃两侧之间产生电位差。玻璃电极的薄膜玻璃内侧电位经过内部缓冲液,通过内电极导出;而接液的外侧电位经过待测液体-参比电极液接界-内部液体,通过参比电极的内部电极导出。
两电极的内部电极与内部液体之间产生的电位,大体相互抵消,所以能测量薄膜玻璃两侧的电位。
pH值与氢离子活性aH+的关系如下所示: pH=-log10aH+
也就是说,pH值与离子活性常用对数的倒数成比例,p是幂(power)的首字母,意思是乘方;H是氢(Hydrogen)的首字母,意思是氢离子。
此外,氢离子活性与氢离子浓度的关系如下: aH+=γH+(H+)
γH+: 氢离子活性系数(activity coefficient)
H+: 氢离子浓度
用小于1的数值表示氢离子活性系数,浓度很低时视为1。用能斯特方程式来表示测量电位差: E=(2.303RT/F)(pHi-pHs)+Eas
E: 测量电位差(V)
R: 气体常数(8.31441JK-1mol-1)
T: 绝对温度(K)
F: 法拉第常数(96484.56 C mol-1)
pHi: 玻璃电极内部缓冲液的pH值(=7)
pHs: 测量液的pH值
Eas: 不对称电位(理论值与实际值的电位偏移) (V)
- 相关推荐
- 热点推荐
- PH计
-
分享PH计正确使用步骤!jzyb 2025-11-11
-
ADI PH计应用方案 实现精准高效的水质测量2023-12-20 1695
-
看看厂家技师是怎么校准在线PH计的2023-08-10 1888
-
arduino项目PH计2022-11-30 979
-
如何制作一个Arduino pH计2022-08-12 6543
-
如何利用Arduino Uno制作台式pH计2022-08-04 3131
-
工业pH计的维护与标定2021-12-10 1528
-
ph计使用误区有哪些2020-05-21 3074
-
酸度计与ph计的区别_实验室ph计的使用方法_ph计的使用注意事项2017-12-28 46926
-
关于梅特勒pH计测量读数不准的原因2014-08-20 17215
-
如何选购PH计?关键小TIPS来帮你!2013-11-22 4382
-
pH计电路图2009-07-03 4142
全部0条评论

快来发表一下你的评论吧 !

