

电导率的定义和测量原理
描述
以下文章来源于Uselong Biotech,作者玉珠隆生物
电导率测量技术已经经历了一个多世纪的发展,至今它依然是分析领域中广泛使用的一个重要参数。由于其高度的可靠性、出色的灵敏度、迅速的响应能力以及相对低廉的成本,电导率测定成为了一个既高效又易于操作的质量控制工具。电导率反映的是溶液中所有溶解离子(如盐、酸、碱和某些有机物)的总体导电能力,这是一个非特异性的总体参数。该技术无法区分溶液中的各种不同离子。测量得到的电导率读数与样品内所有离子的综合效应成正比。因此,这项技术非常适合用于监测各种类型的水质(例如纯水、饮用水、天然水、工业用水等)以及其他溶剂,同时也适用于测量导电性化学品的浓度。
电导率是衡量物质导电能力的指标,它描述了物质能够多好地传递电流。电流的流动依赖于物质中带电粒子的存在。根据这些带电粒子的特性,导体可以分为两大类。第一类是由具有外层电子的原子晶格构成的导体。在这些材料中,电子构成了一个“电子云”,它们可以自由地脱离原子并在晶格或材料中移动,从而传导电流。金属、石墨以及某些其他化合物都属于这一类。第二类导体被称为离子导体,它们与第一类导体的主要区别在于,电流是由离子而非自由电子来传导的。在这类导体中,电荷的转移总是伴随着物质的迁移。这些导体由带电且可移动的离子组成,通常被称为电解液。它们通过在极性溶剂(如在水中)溶解或熔化来实现电离。
电导率定义:
根据欧姆定律V=R×I可知溶液中的电压V与电流I成正比。该公式中R为电阻(单位欧姆,Ω),V为电压(单位伏特,V),I为电流(单位安培,A)。电阻R是比例常数,可使用测得的电压V除以测得的电流I进行计算。
电导(用G表示,单位为西门子,S)的定义为电阻的倒数,即G=1/R
为了测定样品的电阻或电导,需要使用测量电极的设备。该设备至少包含两个带有相反电荷的电极板,它们共同构成了测量电极系统。这些电极板与绝缘支撑体一起,组合形成了一个完整的传感器单元。
读数取决于测量电极板的几何形状,以电极常数(K)表示。它是电极板距离(L)和面积(A)的比值,即K=L÷A。该公式中,K为电极常数(单位cm-1),L为电极板之间的距离(单位cm),A为电极板之间电解液的有效横截面积(单位cm²)
电导可转化为标准化的电导率(σ),其独立于测量电极的设置。该值通过电导乘以电极常数获得:σ=G×K= G×L÷A。电导率σ的单位为S/cm。
溶液的电导率:纯溶剂不具导电性,因此电导率接近零。只有带有离子或极性键的溶解固体才可使溶液导电。绝对纯水也包含一些离子,因此导电,该效果由水的自电离导致。
溶解离子:固体溶解和离子形成被称作电解电离。这是在溶剂中导电的前提。电解电离的示例如下所示:
NaCl→ Na++ Cl-
HCl→ H++ Cl-
CH3COOH→ CH3COO-+ H+
电解液可以根据其电离程度被划分为强电解液和弱电解液。强电解液,如氯化钠,在水中能够完全电离,生成钠离子(Na⁺)和氯离子(Cl⁻)。而弱电解液,如乙酸,则只能部分电离。在这种情况下,电解液中会同时存在离子形态的醋酸根离子(CH₃COO⁻)、质子(H⁺),以及未电离的乙酸分子(CH₃COOH)。
电解液的电离对温度的依赖性很强,可通过电离速率或电离常数进行定量。在电解液中,仅电离后的离子部分与电导率相关。离子对电导率的贡献率取决于其浓度、电荷和移动性。样品电导率σ可表示为溶解离子浓度及其电化学属性的函数,如下:

当量电导λ是离子的特定属性,它取决于离子类型、浓度以及温度。常见离子的当量电导见下表:
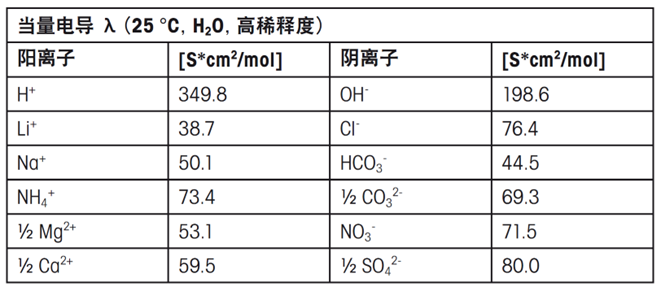
电导率会随着离子电荷数的增加而提高,但随着离子尺寸的增大而降低。实际测量的电导率可能与预期值有所差异,例如,锂离子的电导率通常低于铵离子,尽管锂离子的尺寸更小。这种现象是因为离子的溶剂化程度而非其本身的尺寸是影响电导率的关键因素。高电荷密度的小离子能够吸引更多的水分子,形成比大尺寸但电荷数较少的离子更大的溶剂化壳层。
此外,质子(H+)和氢氧根离子(OH-)的电导率异常高,这并非因为它们通过离子迁移来传输电荷。质子的传输是通过水合氢离子(H3O+)与周围水分子(H2O)之间的快速质子跳跃来实现的,而氢氧根离子的传输则是通过水分子与氢氧根离子(OH-)之间的质子跳跃来完成的。在这两种情况下,电荷的传输主要是通过水分子间的快速质子交换,而不是通过离子的物理迁移。
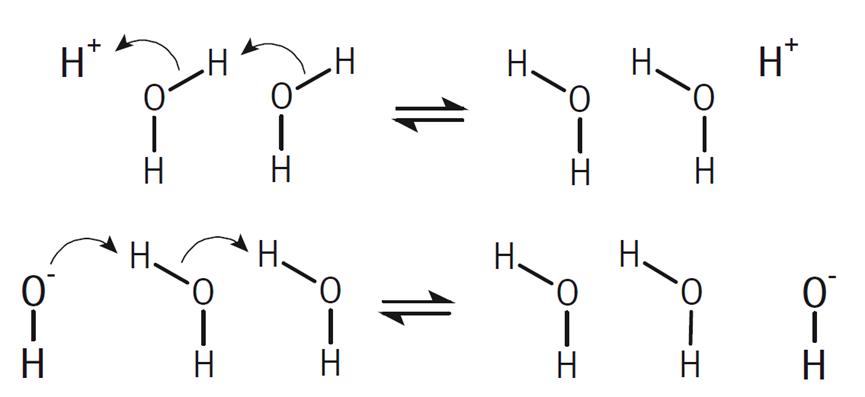
质子和氢氧化物电荷传输机制
正如之前所述,当量电导并非一个恒定值。它会受到多种因素的影响,其中包括浓度和温度。首先,随着溶液浓度的增加,当量电导会降低。这是因为在较高浓度下,相同电荷类型的离子数量增多,它们在溶液中的移动会受到更多干扰,从而降低了电导效率。对于弱电解质来说,当浓度较高时,电离程度会降低,这同样会导致当量电导的下降。这是因为在高浓度下,电解质的电离速率减慢,释放出的自由离子数量减少,进而影响了电导率。温度对当量电导的影响则更为复杂。一般来说,温度的升高会增加离子的运动速度,并减少溶剂的粘度。这种变化使得离子更容易在溶液中移动,从而提高了电导率。对于弱电解质而言,温度的升高还能促进其电离,增加溶液中的离子浓度,进一步提升电导率。
电导率是溶液的一个重要物理特性,它受到多个参数的影响,这些参数之间存在复杂的相互作用。影响溶液电导率的关键因素主要有:①溶解电解液的类型:包括离子的电荷量、离子的半径以及离子的移动性。电荷量较高的离子通常具有较高的电导率,而离子的半径和移动性也会影响其在溶液中的迁移速度。②溶解电解液的浓度:浓度的增加通常会导致离子间的相互作用增强,从而可能降低电导率,尤其是在高浓度下。③电解质的电离度:电离度较高的电解质会释放更多的自由离子,从而增加电导率。④溶剂的性质:包括溶剂的粘度和电容率。粘度较低的溶剂允许离子更自由地移动,而高电容率的溶剂有助于离子的迁移。⑤温度:温度的升高会增加离子的运动速度,减少溶剂的粘度,从而提高电导率。
水的自电离是一个重要的化学现象,它对溶液的电导率有直接影响。在纯净的水中,即使没有外部杂质,溶液仍然可以表现出一定的电导率。这是因为水分子自身可以发生电离,生成水合氢离子(H3O+)和氢氧根离子(OH-)。纯水的电导率大约为0.055 μS/cm,这一数值虽然相对较低,但在进行精确测量时仍然需要考虑。水的自电离反应是一个平衡过程,其中水分子的电离程度非常有限。在十亿个水分子中,大约只有两个分子会发生电离,生成离子。尽管自电离产生的离子数量很少,但它们对水的电导率有贡献。因此,在评估纯水或其他溶液的电导率时,需要考虑到这种自电离的影响,以确保测量结果的准确性。
电导率的测量原理:
电导率的测量是基于一个简单的原理:通过测量溶液中电流的流动来确定其电导性,测定方法如下图所示。
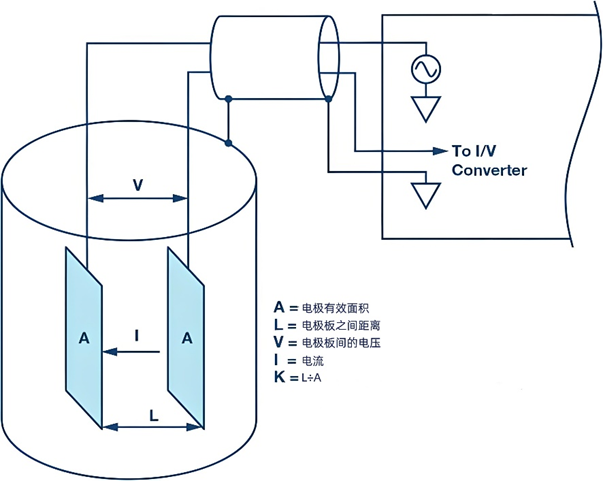
以下是测量电导率的步骤和涉及的关键概念:
测量装置:使用两个相互平行的电极(可以是平板或圆柱形),这些电极被放置在待测溶液中,并且它们之间的距离(L)是固定的。
施加电压:为了避免电解溶液,通常在电极两端施加一个正弦波电压,频率一般在1~3 kHz之间。
测量电导:通过电导仪测量两个电极之间的电导(G),即电流通过溶液的能力。
计算电导率:为了得到电导率σ= G×K,需要两个关键参数,即溶液的电导G和电极常数K。电导G可以通过测量电流和电压得到。电极常数K可以通过公式K =L÷A计算得出,其中A是电极的有效面积,L是两电极之间的距离。
电极常数的说明:当电极间存在均匀电场时,可以通过电极的几何尺寸直接计算电极常数。例如,如果两个面积各为1 cm²的方形电极相隔1 cm,那么电极常数K为1 cm⁻¹。如果使用这对电极测得电导G为1000 μS,则溶液的电导率K为1000 μS/cm。在实际应用中,电极间可能存在非均匀电场,这时电极常数(K)必须通过使用标准溶液来确定。常用的标准溶液是KCl溶液,因为它的电导率在不同温度和浓度下都非常稳定和准确。例如,0.1 mol/L的KCl溶液在25℃时的电导率为12.88 mS/cm。非均匀电场(也称为杂散场或漏泄场)的特点是它没有固定的常数,而是依赖于离子的种类和浓度。因此,一个纯杂散场电极是最复杂的,因为它不能通过单次校准来满足广泛的测量范围需求。
-
测电导率需要注意哪些事项2024-07-14 2740
-
水质电导率的测量方式(盘点)2024-01-29 2686
-
电极式电导率的种类有哪些?2023-10-09 1476
-
什么海思电导率,电导率原理解析2023-09-15 2543
-
海水电导率仪的测量范围与校准原理2022-03-17 5089
-
电导率的影响因素及测量方法2019-05-30 13650
-
电导率仪的使用方法和电导率仪工作原理2018-03-19 4344
-
电导率仪的概念、单位和测量原理的介绍2017-10-11 3134
-
电导率仪的测量方法2017-02-06 4984
-
最近在做水质仪 测温度和TDS 电导率的 卡在温度与电导率关系,电导率测量上2016-10-13 5222
-
什么是导电率?电磁流量计测量对液体电导率的2014-01-09 4432
-
关于电导率的测量原理和什么叫量程电阻2013-07-23 4155
-
电导率计测量基本原理及应用2009-07-18 1187
-
电导率的测量原理2008-11-09 7267
全部0条评论

快来发表一下你的评论吧 !

