

三电极体系工作原理
电子常识
描述
三电极体系组成
相应的三个电极为工作电极、参比电极和辅助电极。
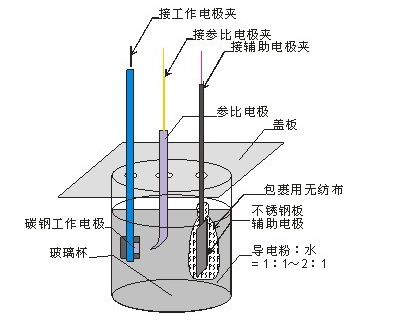
工作电极:又称研究电极,是指所研究的反应在该电极上发生。一般来讲,对工作电极的基本要求是:工作电极可以是固体,也可以是液体,各式各样的能导电的固体材料均能用作电极。(1)所研究的电化学反应不会因电极自身所发生的反应而受到影响,并且能够在较大的电位区域中进行测定;(2)电极必须不与溶剂或电解液组分发生反应;(3)电极面积不宜太大,电极表面最好应是均一平滑的,且能够通过简单的方法进行表面净化等等。
工作电极的选择:通常根据研究的性质来预先确定电极材料,但最普通的“惰性”固体电极材料是玻碳(铂、金、银、铅和导电玻璃)等。采用固体电极时,为了保证实验的重现性,必须注意建立合适的电极预处理步骤,以保证氧化还原、表面形貌和不存在吸附杂质的可重现状态。在液体电极中,汞和汞齐是最常用的工作电极,它们都是液体,都有可重现的均相表面,制备和保持清洁都较容易,同时电极上高的氢析出超电势提高了在负电位下的工作窗口记被广泛用于电化学分析中。
辅助电极:又称对电极,辅助电极和工作电极组成回路,使工作电极上电流畅通,以保证所研究的反应在工作电极上发生,但必须无任何方式限制电池观测的响应。由于工作电极发生氧化或还原反应时,辅助电极上可以安排为气体的析出反应或工作电极反应的逆反应,以使电解液组分不变,即辅助电极的性能一般不显著影响研究电极上的反应。但减少辅助电极上的反应对工作电极干扰的最好办法可能是用烧结玻璃、多孔陶瓷或离子交换膜等来隔离两电极区的溶液。
三电极体系结构及电路图
电化学测试的方法很多,根据测试的特质,可以分为以下几大类:1.稳态测试方法;2.暂态测试方法;3.伏安法;4.交流阻抗法等。这里小编只给大家简单介绍一些使用最普遍,功能最强大的电化学测试方法。在此之前,先对电化学测试最常用的三电极测试体系进行简单介绍。
所谓的三电极体系,是为了排除电极电势因极化电流而产生的较大误差而设计的。它在普通的两电极体系(工作电极与对电极)的基础上引入了用以稳定工作电极的参比电极,如图2示。如左图,电解池由三个电极组成:工作电极(W),对电极(C)以及参比电极(R)。
W是主要的电极研究和操作对象,R是电势电极的比较标准,而C主要用以通过极化电流,实现对电极的极化。右图中,我们可以看到,三电极体系在电路中时,P代表极化电源,为研究电极提供极化电流。mA和V分别为电流表和电压表,用以测试电流和电势。P,mA,C,W构成的左侧回路,称为极化回路,在极化回路中有极化电流通过,可对参比电极进行测量和控制。V,R,W构成了右侧回路,称为测量控制回路。在此回路中,对研究电极的电势进行测量和控制,由于回路中无极化电流流过,仅有极小的测量电流,所以不会研究电极的极化状态和参比电极的稳定性造成干扰。由此可见,三电极体系可使研究电极表面通过极化电流,又不会妨碍研究的电极电势的控制和测量,可同时实现电势和电流的控制和测量。所以,大部分电化学研究测试均在三电极体系完成。
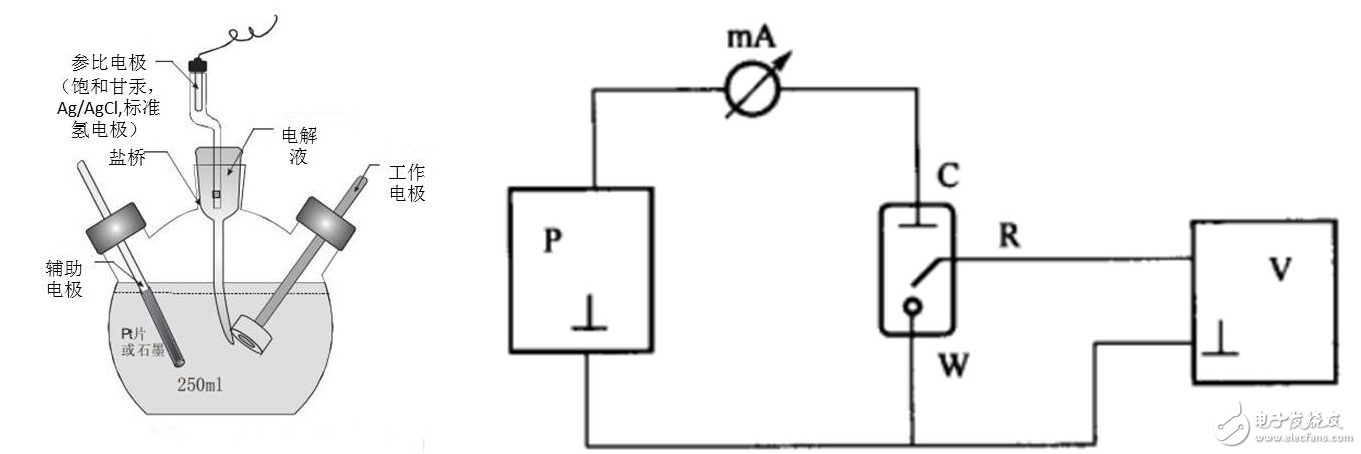
图2 三电极体系结构图及电路图
接下来,小编就把最常用的几种电化学测试手段进行简单介绍。
1.稳态测试:恒电流法及恒电势法
所谓的稳态,即电化学参量(电极电势,电流密度,电极界面状态等)变化甚微或基本不变的状态。最常用的稳态测试方法,当然就是恒电流法及恒电势法,故名思意,就是给电化学体系一个恒定不变的电流或者电极电势的条件。通常我们可以利用恒电位仪或者电化学工作站来实现这种条件。通过在电化学工作站简单地设置电流或电势以及时间这几个参数,就可以有效地使用这两种方法啦。该方法用的比较多的地方主要有:活性材料的电化学沉积以及金属稳态极化曲线的测定(如图3)等等。
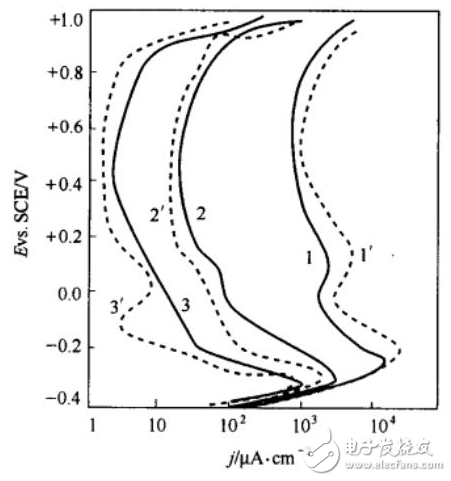
图3 不同扫速下金属的稳态极化曲线
2.暂态测试:控制电流阶跃及控制电势阶跃法
所谓的暂态,当然是相对于稳态而言的。在一个稳态向另一个稳态的转变过程中,任意一个电极还未达到稳态时,都处于暂态过程,如双电层充电过程,电化学反应过程以及扩散传质过程等。最常见的方法要数控制电流阶跃法以及控制电势阶跃法这两种。控制电流阶跃法,也叫计时电位法,即在某一时间点,电流发生突变,而在其他时间段,电流保持相应的恒定状态。
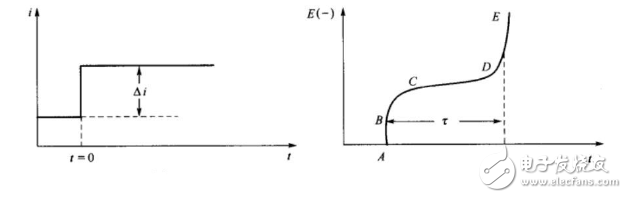
图4 计时电位法电流阶跃(左图)及相应的电势变化(右图)。
同理,控制电势阶跃法也就是计时电流法,即在某一时间点,电势发生突变,而在其他时间段,电势保持相应的恒定状态。
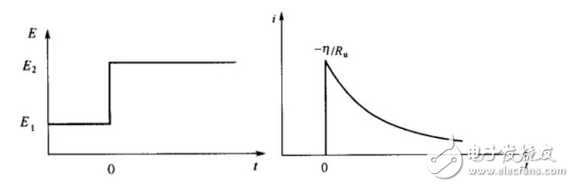
图5 计时电位法电势阶跃(左图)及相应的电流变化(右图)。
利用这种暂态的控制方法,一般可以探究一些电化学变化过程的性质,如能源存储设备充电过程的快慢,界面的吸附或扩散作用的判断等。计时电流法还可以用以探究电致变色材料变色性能的优劣。
3.伏安法:线性伏安法,循环伏安法
伏安法应该算是电化学测试中最为常用的方法,因为电流、电压均保持动态的过程,才是最常见的电化学反应过程。一般而言,伏安法主要有线性伏安法以及循环伏安法,两者的区别在于,线性伏安法“有去无回”,而循环伏安法“从哪里出发就回哪去”。线性伏安法即在一定的电压变化速率下,观察电流相应的响应状态。同理,循环伏安法也是一样,只不过电压的变化是循环的,从起点到终点再回到起点。
线性伏安法使用的领域较广,主要包括太阳能电池光电性能的测试,燃料电池等氧还原曲线的测试以及电催化中催化曲线的测试等。而循环伏安法,主要用以探究超级电容器的储能大小及电容行为、材料的氧化还原特性等等。
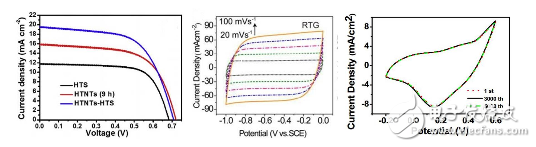
图6伏安法电化学测试:左图为线性伏安测试太阳能电池的开路电压及短路电流;中间为循环伏安法测试电容行为较强的碳材料;右图为含有氧化还原行为的电极材料的循环伏安测试
4.交流阻抗法
交流阻抗法的主要实现方法是,控制电化学系统的电流在小幅度的条件下随时间变化,同时测量电势随时间的变化获取阻抗或导纳的性能,进而进行电化学系统的反应机理分析及计算系统的相关参数等。交流阻抗谱可以分为电化学阻抗谱(EIS)和交流伏安法。EIS探究的是某一极化状态下,不同频率下的电化学阻抗性能;而交流伏安法是在某一特定频率下,研究交流电流的振幅和相位随时间的变化。
这里我们重点介绍一下EIS。由于采用小幅度的正弦电势信号对系统进行微扰,电极上交替出现阳极和阴极过程,二者作用相反,因此,即使扰动信号长时间作用于电极,也不会导致极化现象的积累性发展和电极表面状态的积累性变化。因此EIS是一种“准稳态方法”。通过EIS,我们一般可以分析出一些表面吸附作用以及离子扩散作用的贡献分配,电化学系统的阻抗大小、频谱特性以及电荷电子传输的能力强弱等等。
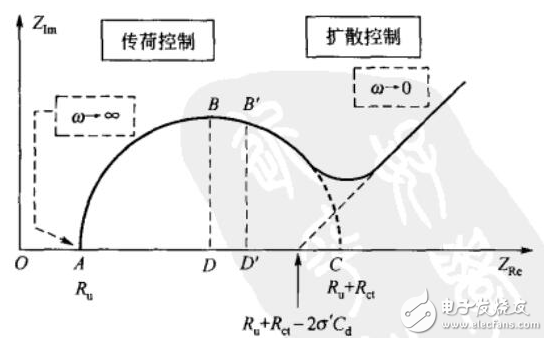
图7 EIS中Nyquist图谱
-
三极管工作原理 3极管的三种工作状态判断方法2024-02-01 8200
-
三电极体系中各个电极的作用是什么2023-12-19 15517
-
三电极体系工作电极的作用2023-12-14 4365
-
电极液位开关接口电路的工作原理2023-10-19 2253
-
绝缘电极实验装置的工作原理和重要性2023-09-13 1081
-
集电极开路电路的工作原理、输出接线图、优缺点2023-07-17 4898
-
三极管集电极开路电路工作原理详细分析2023-02-06 6468
-
集电极开路电路工作原理讲解2023-01-13 3119
-
水位电极的工作原理及作用2021-01-01 15773
-
ph电极的工作原理(PH电极的特点和分类及用途)2018-03-19 111340
-
三极管的基础知识及工作原理2009-11-05 8491
-
Gnutella文件共享体系架构的工作原理2009-07-30 3635
-
共集电极电路和共基极电路2009-03-03 4231
全部0条评论

快来发表一下你的评论吧 !

