

研发闭环经颅超声神经刺激——变形皮质粘附传感器
电子说
1.4w人已加入
描述
经颅聚焦超声因其空间分辨率和深度穿透性,已显示出对药物难治性癫痫具有良好前景的非侵入性治疗效果。然而,目前采用固定神经刺激方案的手动策略,由于缺乏对超声波不敏感的闭环神经刺激装置,无法提供针对特定患者的精准治疗。本文,我们报道了一种用于闭环经颅超声神经刺激的可变形皮质粘附传感器。该传感器由儿茶酚共轭海藻酸盐水凝胶粘合剂、可拉伸的16通道电极阵列和粘塑性自修复聚合物基底组成,并与脉冲控制的经颅聚焦超声装置耦合。它可以对弯曲的皮质表面进行适形且牢固的固定,并且我们证明它能够在清醒的癫痫啮齿动物中进行经颅聚焦超声神经刺激期间稳定地记录神经信号。传感性能允许实时检测具有意外和不规则高频振荡的癫痫前信号,并且我们展示了在清醒啮齿动物的超声刺激下由完整的皮质活动监督的闭环癫痫控制。 由于对难治性癫痫治疗机制的理解不完全,导致传统药物疗效低下。为了解决这个问题,人们一直致力于开发针对药物抵抗性癫痫发作的组织部位特异性神经刺激工具,包括深部脑刺激和迷走神经刺激。 然而,此类方法存在与侵入性电刺激不稳定性相关的问题。经颅聚焦超声 (tFUS) 因其无炎症和长期稳定的刺激以及高空间分辨率而显示出对药物抵抗性癫痫发作的有效抑制作用。然而,迄今为止报道的临床前和临床试验使用固定的 tFUS 协议,在确定患者特定神经刺激参数方面进展有限。此外,尽管先前的转化研究证明了采用固定方案的 tFUS 刺激对动物模型中的癫痫发作具有抑制作用,但这些研究仅在麻醉或癫痫行为症状相对轻微的清醒动物中进行了验证,而没有考虑神经活动的状态。我们需要一个闭环系统,能够根据癫痫发作的严重程度, 通过刺激工具上准确的神经生理反馈来识别,从而设置最佳治疗方案。在这方面,具有适形接触、 牢固固定和在生物-非生物界面机械适应性的软脑装置对于早期检测致痫组织产生的高频振荡(HFOs)(80-500 Hz)以及向闭环 tFUS 神经刺激系统提供持久的神经生理反馈至关重要。尤其是微皮层电图(ECoG)设备在电神经信号传导方面具有高保真度和高时空分辨率,由于其高频容量和大面积覆盖,使其非常适合此类用途。然而,典型的基板和/或封装材料(例如厚聚酰亚胺(PI)和热生长二氧化硅(SiO 2 ))本质上具有较高的刚度和较差的形状适应性 , 导致皮质表面的卷积结构接触不均匀。具有可溶解基板的超薄网状设备可以在提高信号质量的同时提供脑部适形性,但由于脑脊液和组织的微运动,它们对微型目标组织点的感测位置精度可能受到限制。 现有的接口装置与脑组织的结合强度较低 , 也容易受到超声波的影响,因为传递声压的神经调节超声会产生与振动相关的机械噪声。这给脑集成电极装置的神经信号反馈带来了挑战,并且由于源自超声诱导的振荡的电伪影干预,无法实现最佳的闭环 tFUS 神经刺激。因此,需要即使在曲面上也具有强大的组织粘附性和顺应性的软脑接口材料, 以实现与超声刺激耦合的对伪影不敏感的神经装置。在本文中,作者报告了一种用于闭环 tFUS 神经刺激的可变形皮质粘合剂 (SMCA) 传感器(图 1a )。SMCA 传感器由作为粘弹性水凝胶粘合剂的儿茶酚共轭海藻酸盐 (Alg-CA)(补充图 1a )、 可拉伸的薄(~3 μm)16 通道微电极阵列和作为粘塑性自修复聚合物 (SHP) 基底的异佛尔酮双脲官能化聚二甲基硅氧烷 (PDMS-IU)(补充图 1b )组成。我们表明,它能够通过主动形状适应和坚韧的粘合性与啮齿动物大脑保形且牢固地固定(图 1a 中的插图)。 SMCA 传感器的皮质接口步骤(图 1b 和补充说明 1 )如下。首先,通过接触处 Alg-CA 水凝胶的瞬时凝胶化实现牢固的组织粘附,这包括通过用膨胀的水凝胶填充界面微孔区域进行保形接触、组织-设备界面的脑模拟刚度匹配以及共价或非共价化学键的形成(补充图 1c 和补充说明 1 )。其次,贴片的形状变形过程和完全的粘合剂凝胶化导致在皱纹皮质上的保形接触,这是 SHP 基质的粘塑性行为和膨胀的 Alg-CA 水凝胶的粘弹性的协同效应。最后,无应力生物电子接口涉及由于 SHP 基质的动态应力松弛而有效耗散皮质上变形引起的压缩应力能量。
由于对难治性癫痫治疗机制的理解不完全,导致传统药物疗效低下。为了解决这个问题,人们一直致力于开发针对药物抵抗性癫痫发作的组织部位特异性神经刺激工具,包括深部脑刺激和迷走神经刺激。 然而,此类方法存在与侵入性电刺激不稳定性相关的问题。经颅聚焦超声 (tFUS) 因其无炎症和长期稳定的刺激以及高空间分辨率而显示出对药物抵抗性癫痫发作的有效抑制作用。然而,迄今为止报道的临床前和临床试验使用固定的 tFUS 协议,在确定患者特定神经刺激参数方面进展有限。此外,尽管先前的转化研究证明了采用固定方案的 tFUS 刺激对动物模型中的癫痫发作具有抑制作用,但这些研究仅在麻醉或癫痫行为症状相对轻微的清醒动物中进行了验证,而没有考虑神经活动的状态。我们需要一个闭环系统,能够根据癫痫发作的严重程度, 通过刺激工具上准确的神经生理反馈来识别,从而设置最佳治疗方案。在这方面,具有适形接触、 牢固固定和在生物-非生物界面机械适应性的软脑装置对于早期检测致痫组织产生的高频振荡(HFOs)(80-500 Hz)以及向闭环 tFUS 神经刺激系统提供持久的神经生理反馈至关重要。尤其是微皮层电图(ECoG)设备在电神经信号传导方面具有高保真度和高时空分辨率,由于其高频容量和大面积覆盖,使其非常适合此类用途。然而,典型的基板和/或封装材料(例如厚聚酰亚胺(PI)和热生长二氧化硅(SiO 2 ))本质上具有较高的刚度和较差的形状适应性 , 导致皮质表面的卷积结构接触不均匀。具有可溶解基板的超薄网状设备可以在提高信号质量的同时提供脑部适形性,但由于脑脊液和组织的微运动,它们对微型目标组织点的感测位置精度可能受到限制。 现有的接口装置与脑组织的结合强度较低 , 也容易受到超声波的影响,因为传递声压的神经调节超声会产生与振动相关的机械噪声。这给脑集成电极装置的神经信号反馈带来了挑战,并且由于源自超声诱导的振荡的电伪影干预,无法实现最佳的闭环 tFUS 神经刺激。因此,需要即使在曲面上也具有强大的组织粘附性和顺应性的软脑接口材料, 以实现与超声刺激耦合的对伪影不敏感的神经装置。在本文中,作者报告了一种用于闭环 tFUS 神经刺激的可变形皮质粘合剂 (SMCA) 传感器(图 1a )。SMCA 传感器由作为粘弹性水凝胶粘合剂的儿茶酚共轭海藻酸盐 (Alg-CA)(补充图 1a )、 可拉伸的薄(~3 μm)16 通道微电极阵列和作为粘塑性自修复聚合物 (SHP) 基底的异佛尔酮双脲官能化聚二甲基硅氧烷 (PDMS-IU)(补充图 1b )组成。我们表明,它能够通过主动形状适应和坚韧的粘合性与啮齿动物大脑保形且牢固地固定(图 1a 中的插图)。 SMCA 传感器的皮质接口步骤(图 1b 和补充说明 1 )如下。首先,通过接触处 Alg-CA 水凝胶的瞬时凝胶化实现牢固的组织粘附,这包括通过用膨胀的水凝胶填充界面微孔区域进行保形接触、组织-设备界面的脑模拟刚度匹配以及共价或非共价化学键的形成(补充图 1c 和补充说明 1 )。其次,贴片的形状变形过程和完全的粘合剂凝胶化导致在皱纹皮质上的保形接触,这是 SHP 基质的粘塑性行为和膨胀的 Alg-CA 水凝胶的粘弹性的协同效应。最后,无应力生物电子接口涉及由于 SHP 基质的动态应力松弛而有效耗散皮质上变形引起的压缩应力能量。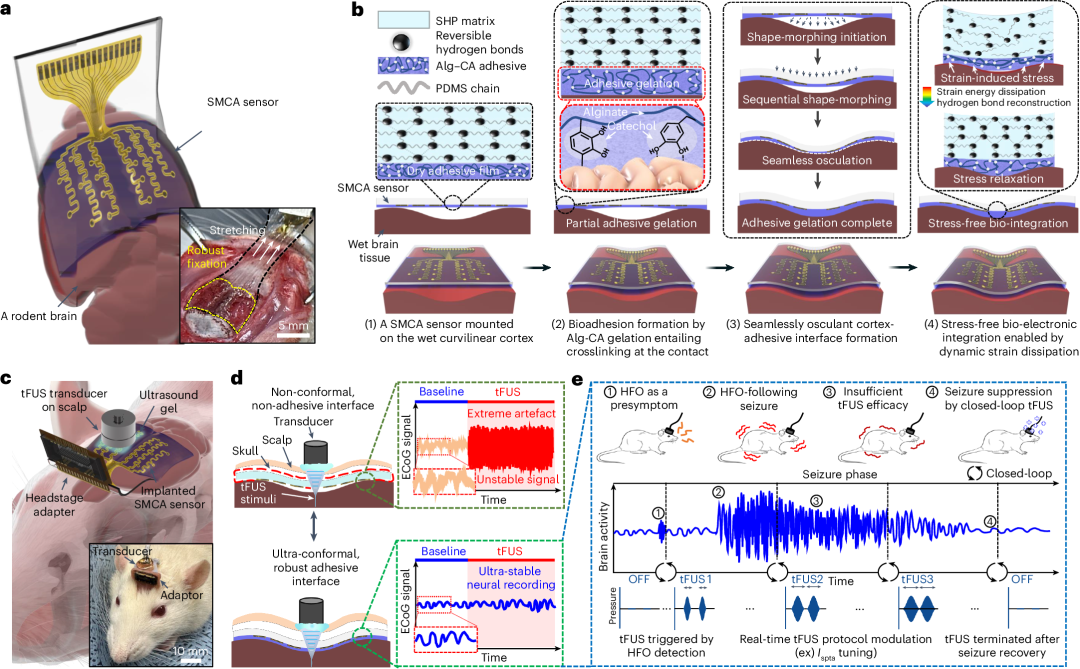 图 1:用于超稳定脑接口的 SMCA 传感器可实现闭环 tFUS 神经治疗。将微型 tFUS 换能器用于带有颅内 SMCA 传感器的清醒啮齿动物模型(图 1c )。为了实现用于闭环脑接口的便携式头置系统,使用三维打印支架将 tFUS 设备与植入式 SMCA 传感器的适配器耦合(图 1c 中的插图)。通过这种方法,我们在麻醉动物和清醒癫痫动物的 tFUS 神经刺激下展示了无伪影的 ECoG。(图 1d )。稳定的神经信号传导性能使我们的平台能够作为慢性癫痫发作预测器并通过检测高质量的癫痫 HFO 来自动触发神经刺激。我们还使用这些功能创建基于 tFUS 和 SMCA-ECoG 的闭环癫痫发作控制策略:由癫痫发作前的 HFO 检测触发的 tFUS 启动;在预定时间间隔内以初始剂量进行持续神经刺激;根据实时反馈对 tFUS 方案的修改,如果反馈表明抑制效果不足,则进行修改;如果确定癫痫发作已被抑制,则终止 tFUS(图 1e )。我们在清醒啮齿动物中说明了我们的方法,突出了 SMCA 传感器稳定的闭环反馈性能。
图 1:用于超稳定脑接口的 SMCA 传感器可实现闭环 tFUS 神经治疗。将微型 tFUS 换能器用于带有颅内 SMCA 传感器的清醒啮齿动物模型(图 1c )。为了实现用于闭环脑接口的便携式头置系统,使用三维打印支架将 tFUS 设备与植入式 SMCA 传感器的适配器耦合(图 1c 中的插图)。通过这种方法,我们在麻醉动物和清醒癫痫动物的 tFUS 神经刺激下展示了无伪影的 ECoG。(图 1d )。稳定的神经信号传导性能使我们的平台能够作为慢性癫痫发作预测器并通过检测高质量的癫痫 HFO 来自动触发神经刺激。我们还使用这些功能创建基于 tFUS 和 SMCA-ECoG 的闭环癫痫发作控制策略:由癫痫发作前的 HFO 检测触发的 tFUS 启动;在预定时间间隔内以初始剂量进行持续神经刺激;根据实时反馈对 tFUS 方案的修改,如果反馈表明抑制效果不足,则进行修改;如果确定癫痫发作已被抑制,则终止 tFUS(图 1e )。我们在清醒啮齿动物中说明了我们的方法,突出了 SMCA 传感器稳定的闭环反馈性能。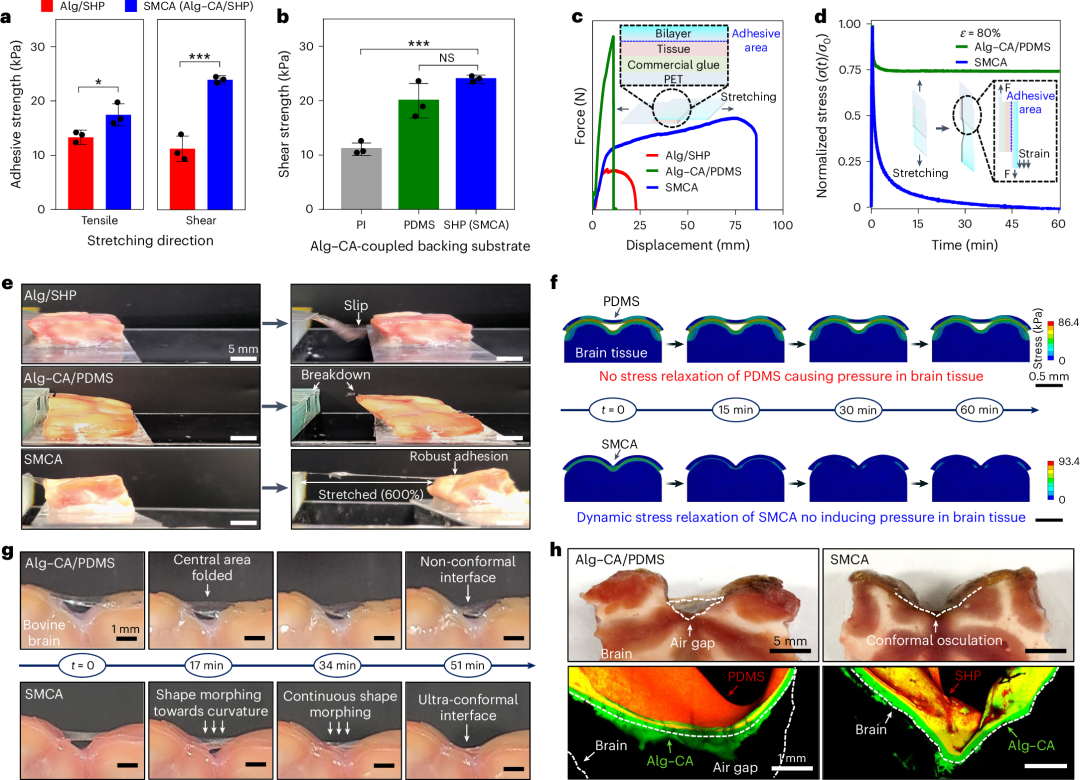 图 2:SMCA 的脑接口功能。我们还研究了 SMCA 贴片的无应力形状自适应特性(有关 SMCA 形状变形行为驱动源的推理,请参见补充说明 5 )。根据有限元分析(FEA),SMCA 薄膜可以很好地填充弯曲物体(例如脑皱纹)的空隙空间,并减轻变形引起的应力(补充图 4b 和 5 ),而 PDMS 不仅无法与曲率共形接触,而且无法在界面平面处松弛应力(图 2f ,FEA 分析方法的详细信息在补充说明 6 中描述)。与计算模型相对应,在使用牛脑组织的离体试验中也观察到了 SMCA 薄膜的自发形状变形特性(图 2g 和补充视频 1 )。虽然 Alg-CA/PDMS 双层膜没有变形成脑皱纹(图 2g ,顶部照片),但 SMCA 薄膜无需任何外部施加的驱动力(例如,电磁场、压力、热能)即可自主变形为皮质的凹曲,从而完全贴合表面轮廓(图 2g ,底部照片)(有关结果的详细讨论,请参阅补充说明 7 )。 确认了与大脑接触的荧光染料标记双层膜贴片(Alg-CA 为绿色标签,PDMS 和 SHP 为红色标签)的横截面照片(顶部)和三维(3D)共聚焦显微镜(底部)图像(图 2h 和补充图 7 ),这验证了 SMCA 贴片的接触能力,它不会在界面处产生空间空隙(图。 2h ,右图),而皮质表面和 Alg-CA/PDMS 双层之间存在较大的气隙(图 2h ,左图)。组织附着的 SMCA 贴片中肿胀的 Alg-CA 的保湿性即使在离体条件下也能稳定维持 7 天而没有大量水分流失,这强烈表明 SMCA 传感器可以通过 Alg-CA 界面层与皮质长期整合在体内充满脑脊液的颅内空间条件下(补充图 8 )。这些结果全面证明了我们的材料策略将具有软流动性和瞬时凝胶化的 Alg-CA 聚合物与具有热塑性变形和有效应变能量耗散的 PDMS-IU SHP 相结合,适用于生物相容性和脑接触界面。
图 2:SMCA 的脑接口功能。我们还研究了 SMCA 贴片的无应力形状自适应特性(有关 SMCA 形状变形行为驱动源的推理,请参见补充说明 5 )。根据有限元分析(FEA),SMCA 薄膜可以很好地填充弯曲物体(例如脑皱纹)的空隙空间,并减轻变形引起的应力(补充图 4b 和 5 ),而 PDMS 不仅无法与曲率共形接触,而且无法在界面平面处松弛应力(图 2f ,FEA 分析方法的详细信息在补充说明 6 中描述)。与计算模型相对应,在使用牛脑组织的离体试验中也观察到了 SMCA 薄膜的自发形状变形特性(图 2g 和补充视频 1 )。虽然 Alg-CA/PDMS 双层膜没有变形成脑皱纹(图 2g ,顶部照片),但 SMCA 薄膜无需任何外部施加的驱动力(例如,电磁场、压力、热能)即可自主变形为皮质的凹曲,从而完全贴合表面轮廓(图 2g ,底部照片)(有关结果的详细讨论,请参阅补充说明 7 )。 确认了与大脑接触的荧光染料标记双层膜贴片(Alg-CA 为绿色标签,PDMS 和 SHP 为红色标签)的横截面照片(顶部)和三维(3D)共聚焦显微镜(底部)图像(图 2h 和补充图 7 ),这验证了 SMCA 贴片的接触能力,它不会在界面处产生空间空隙(图。 2h ,右图),而皮质表面和 Alg-CA/PDMS 双层之间存在较大的气隙(图 2h ,左图)。组织附着的 SMCA 贴片中肿胀的 Alg-CA 的保湿性即使在离体条件下也能稳定维持 7 天而没有大量水分流失,这强烈表明 SMCA 传感器可以通过 Alg-CA 界面层与皮质长期整合在体内充满脑脊液的颅内空间条件下(补充图 8 )。这些结果全面证明了我们的材料策略将具有软流动性和瞬时凝胶化的 Alg-CA 聚合物与具有热塑性变形和有效应变能量耗散的 PDMS-IU SHP 相结合,适用于生物相容性和脑接触界面。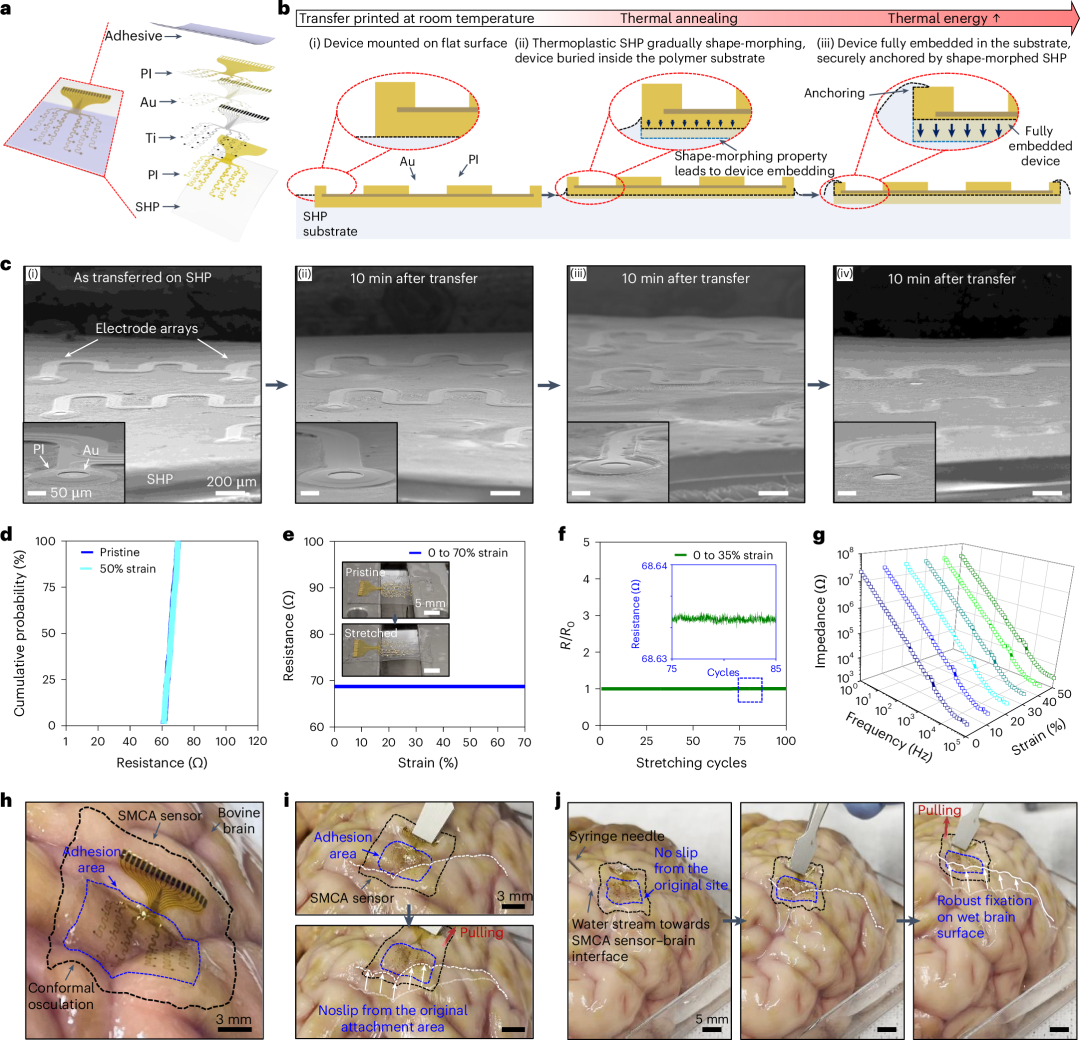 图 3:通过直接转印工艺制作的可拉伸 ECoG 阵列。在体内演示使用 SMCA 传感器之前,先在离体牛皮质上研究了其在脑内的粘附情况(图 3h-j )。SMCA 传感器被共形地安装在不平整的皱纹皮质表面,并自发变形为不同深度的各种山谷(图 3h )。可以清楚地证实,与裸露的 SHP 薄膜相比,超薄可拉伸电极阵列与网状蛇形互连图案的集成不会降低 SMCA 传感器贴片的热塑性或应力松弛性能,从而导致皮质接口装置的超共形性(补充图 12 )。当剪切应力施加到 SMCA 传感器时,这种组织粘附性能得以稳定保持(图 3i 和补充视频 2 );此外,即使在水冲洗条件下,也证明了其强大的粘附性能(图 3j 、补充图 13 为扩展序列图像,补充视频 3 展示了冲洗条件下粘附测试的完整序列)。考虑到成功的体外演示,我们的 SMCA 传感器非常适合实现终极脑机接口。
图 3:通过直接转印工艺制作的可拉伸 ECoG 阵列。在体内演示使用 SMCA 传感器之前,先在离体牛皮质上研究了其在脑内的粘附情况(图 3h-j )。SMCA 传感器被共形地安装在不平整的皱纹皮质表面,并自发变形为不同深度的各种山谷(图 3h )。可以清楚地证实,与裸露的 SHP 薄膜相比,超薄可拉伸电极阵列与网状蛇形互连图案的集成不会降低 SMCA 传感器贴片的热塑性或应力松弛性能,从而导致皮质接口装置的超共形性(补充图 12 )。当剪切应力施加到 SMCA 传感器时,这种组织粘附性能得以稳定保持(图 3i 和补充视频 2 );此外,即使在水冲洗条件下,也证明了其强大的粘附性能(图 3j 、补充图 13 为扩展序列图像,补充视频 3 展示了冲洗条件下粘附测试的完整序列)。考虑到成功的体外演示,我们的 SMCA 传感器非常适合实现终极脑机接口。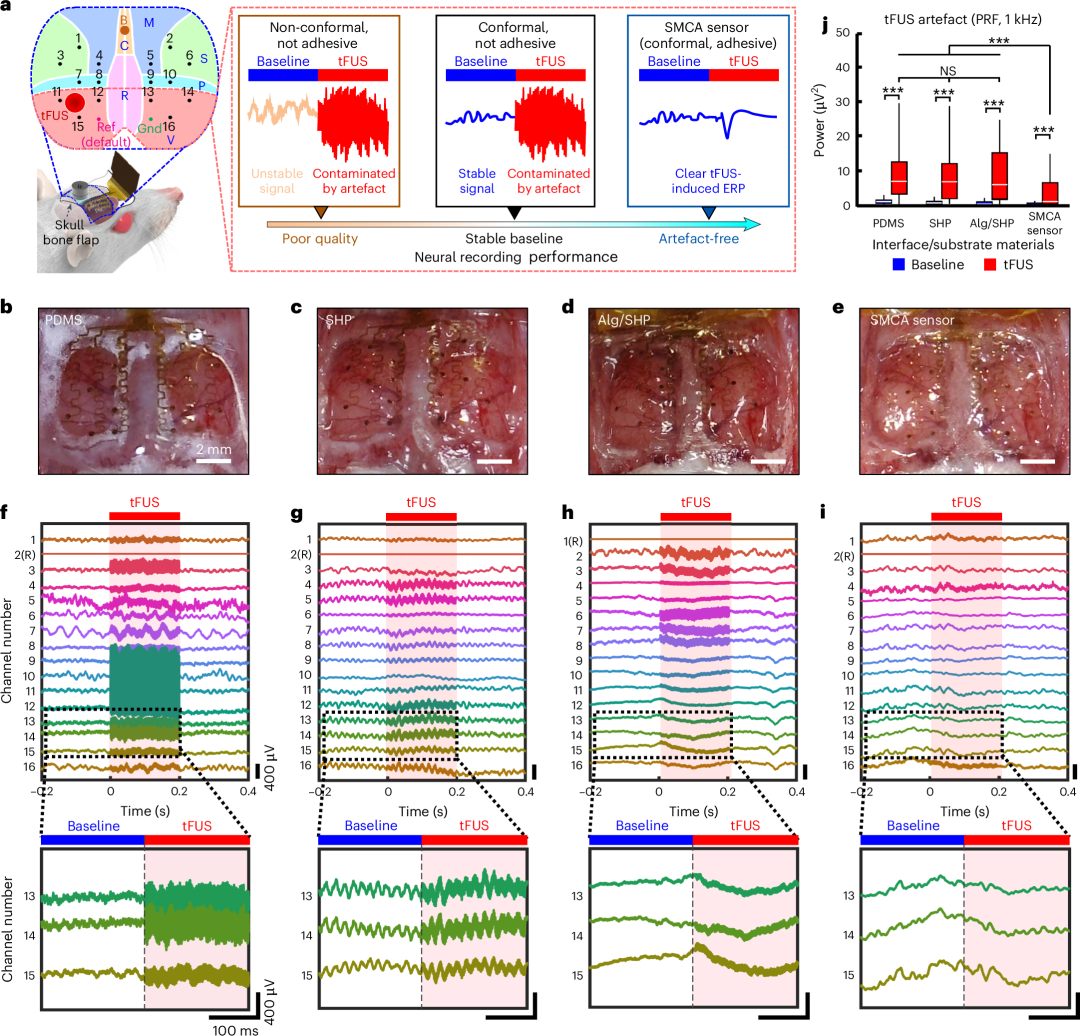 图 4:在麻醉啮齿动物模型中,与不同的脑接口材料相比,SMCA 传感器在 tFUS 刺激下的急性体内神经记录性能。显然,使用 SHP、Alg/SHP 和 SMCA 的 ECoG 设备与 PDMS 以外的皮质表面均可保形地适应,这使我们推断这种保形性源自 SHP 基底的形状变形特性(图 4b-e )。与 SHP 基底上支撑的电极打印设备相比,基于 PDMS 的 ECoG 设备与皮质之间的界面主要形成不透明的气隙,因为由于缺乏形状适应性,即使在轻轻触摸后设备的支撑贴片也不符合皮质表面,这表明与传统弹性体基底耦合而没有自身组织保形性的软 ECoG 设备无法形成均匀的接触界面,即使小动物的大脑与非人类灵长类动物或人类相比,其脑沟和脑回的皮质结构不是很弯曲(图 4b )。非共形生物电子界面导致神经信号衰减,可能是由于 60 Hz 的线路噪声(图 4f 和补充图 16 )。此外,这种不稳定的组织界面导致 tFUS 超声处理下原始神经信号发生很大失真(下面的放大图,图 4f )。另一方面,使用形状变形 SHP 基板(包括 SMCA 传感器)的软 ECoG 设备平台由于轻柔触摸加速形状变形,在短时间内(1 分钟内)均匀地贴合皮质的表面形貌,没有任何空隙(图 4c-e )。打印在 SHP 基板上的 ECoG 设备表现出更好的基线信号质量(图 4c、g 和补充图 16 )。 具有流体材料特性和模量匹配能力的 Alg 水凝胶进一步增强了脑适形性(图 4d )和基线稳定性(图 4h 和补充图 16 )。尽管相对于基线有令人满意的改善,但 tFUS 引起的噪声在神经调节期间仍然有很大的干扰,这表明仅靠组织适形性无法完全防止机械伪影(图 4g、h ,下图放大图)。在这方面,我们观察到在适形固定在皮层的 SMCA 传感器中,此类伪影得到了有效减少(图 4e、i )。除了由于与离子导电软水凝胶极其共形的界面而实现的稳定基线神经记录(图 4i 和补充图 12 和 16 )之外,SMCA 传感器在 tFUS 超声处理下的连续神经生理学能力还可以实现以来自靠近超声视觉皮层的通道的特定 ERP 模式的方式监测完整的 tFUS 调节神经反应(图 4i ,放大图)。多通道 ECoG 流的时间轨迹图进一步验证了在 Alg/SHP 设备和使用皮质接口水凝胶层作为整体的 SMCA 传感器中的电极之间没有串扰问题 35 。为了进一步定量支持 SMCA 传感器在 tFUS 神经刺激下前所未有的神经生理稳定性,我们分析了从上述四个 ECoG 设备记录的体内神经信号中 1 kHz PRF 超声诱导伪影的 PSD(图 4j )。 考虑到神经振荡 41 的频率范围,如果在 tFUS 刺激期间 1 kHz 频率的功率增加,则它被视为 tFUS 引起的伪影,而不是神经信号。关于每个 ECoG 平台功率水平趋势的代表性和统计结果清楚地支持了我们的假设(图 4j 和补充图 17 )。没有组织粘附功能的对照组显然容易受到 tFUS 神经刺激的影响(图 4f-h 和补充图 17a-c )。相反,我们的 SMCA 传感器有效地将 1 kHz PRF 相关的机械伪影干预降至最低(补充图 17d ),这不足以仅通过保形性而没有强大的表面固定特性来实现(补充图 17b,c )(关于记录的神经信号中可视化的 tFUS 引起的伪影的详细讨论出现在补充说明 9 中)。综上所述,结果强调了 SMCA 传感器平台固有的强粘附性和形状变形特性的共存对于实现与超声调制相结合的皮质活动高保真监测起着最重要的作用,从而增加了实现闭环 tFUS 神经刺激的可能性(有关包括 SMCA 传感器在内的软 ECoG 设备平台的可能运行机制以及材料功能和神经信号传导性能之间的相关性的讨论,请参见补充图 18 和补充说明 10 )。
图 4:在麻醉啮齿动物模型中,与不同的脑接口材料相比,SMCA 传感器在 tFUS 刺激下的急性体内神经记录性能。显然,使用 SHP、Alg/SHP 和 SMCA 的 ECoG 设备与 PDMS 以外的皮质表面均可保形地适应,这使我们推断这种保形性源自 SHP 基底的形状变形特性(图 4b-e )。与 SHP 基底上支撑的电极打印设备相比,基于 PDMS 的 ECoG 设备与皮质之间的界面主要形成不透明的气隙,因为由于缺乏形状适应性,即使在轻轻触摸后设备的支撑贴片也不符合皮质表面,这表明与传统弹性体基底耦合而没有自身组织保形性的软 ECoG 设备无法形成均匀的接触界面,即使小动物的大脑与非人类灵长类动物或人类相比,其脑沟和脑回的皮质结构不是很弯曲(图 4b )。非共形生物电子界面导致神经信号衰减,可能是由于 60 Hz 的线路噪声(图 4f 和补充图 16 )。此外,这种不稳定的组织界面导致 tFUS 超声处理下原始神经信号发生很大失真(下面的放大图,图 4f )。另一方面,使用形状变形 SHP 基板(包括 SMCA 传感器)的软 ECoG 设备平台由于轻柔触摸加速形状变形,在短时间内(1 分钟内)均匀地贴合皮质的表面形貌,没有任何空隙(图 4c-e )。打印在 SHP 基板上的 ECoG 设备表现出更好的基线信号质量(图 4c、g 和补充图 16 )。 具有流体材料特性和模量匹配能力的 Alg 水凝胶进一步增强了脑适形性(图 4d )和基线稳定性(图 4h 和补充图 16 )。尽管相对于基线有令人满意的改善,但 tFUS 引起的噪声在神经调节期间仍然有很大的干扰,这表明仅靠组织适形性无法完全防止机械伪影(图 4g、h ,下图放大图)。在这方面,我们观察到在适形固定在皮层的 SMCA 传感器中,此类伪影得到了有效减少(图 4e、i )。除了由于与离子导电软水凝胶极其共形的界面而实现的稳定基线神经记录(图 4i 和补充图 12 和 16 )之外,SMCA 传感器在 tFUS 超声处理下的连续神经生理学能力还可以实现以来自靠近超声视觉皮层的通道的特定 ERP 模式的方式监测完整的 tFUS 调节神经反应(图 4i ,放大图)。多通道 ECoG 流的时间轨迹图进一步验证了在 Alg/SHP 设备和使用皮质接口水凝胶层作为整体的 SMCA 传感器中的电极之间没有串扰问题 35 。为了进一步定量支持 SMCA 传感器在 tFUS 神经刺激下前所未有的神经生理稳定性,我们分析了从上述四个 ECoG 设备记录的体内神经信号中 1 kHz PRF 超声诱导伪影的 PSD(图 4j )。 考虑到神经振荡 41 的频率范围,如果在 tFUS 刺激期间 1 kHz 频率的功率增加,则它被视为 tFUS 引起的伪影,而不是神经信号。关于每个 ECoG 平台功率水平趋势的代表性和统计结果清楚地支持了我们的假设(图 4j 和补充图 17 )。没有组织粘附功能的对照组显然容易受到 tFUS 神经刺激的影响(图 4f-h 和补充图 17a-c )。相反,我们的 SMCA 传感器有效地将 1 kHz PRF 相关的机械伪影干预降至最低(补充图 17d ),这不足以仅通过保形性而没有强大的表面固定特性来实现(补充图 17b,c )(关于记录的神经信号中可视化的 tFUS 引起的伪影的详细讨论出现在补充说明 9 中)。综上所述,结果强调了 SMCA 传感器平台固有的强粘附性和形状变形特性的共存对于实现与超声调制相结合的皮质活动高保真监测起着最重要的作用,从而增加了实现闭环 tFUS 神经刺激的可能性(有关包括 SMCA 传感器在内的软 ECoG 设备平台的可能运行机制以及材料功能和神经信号传导性能之间的相关性的讨论,请参见补充图 18 和补充说明 10 )。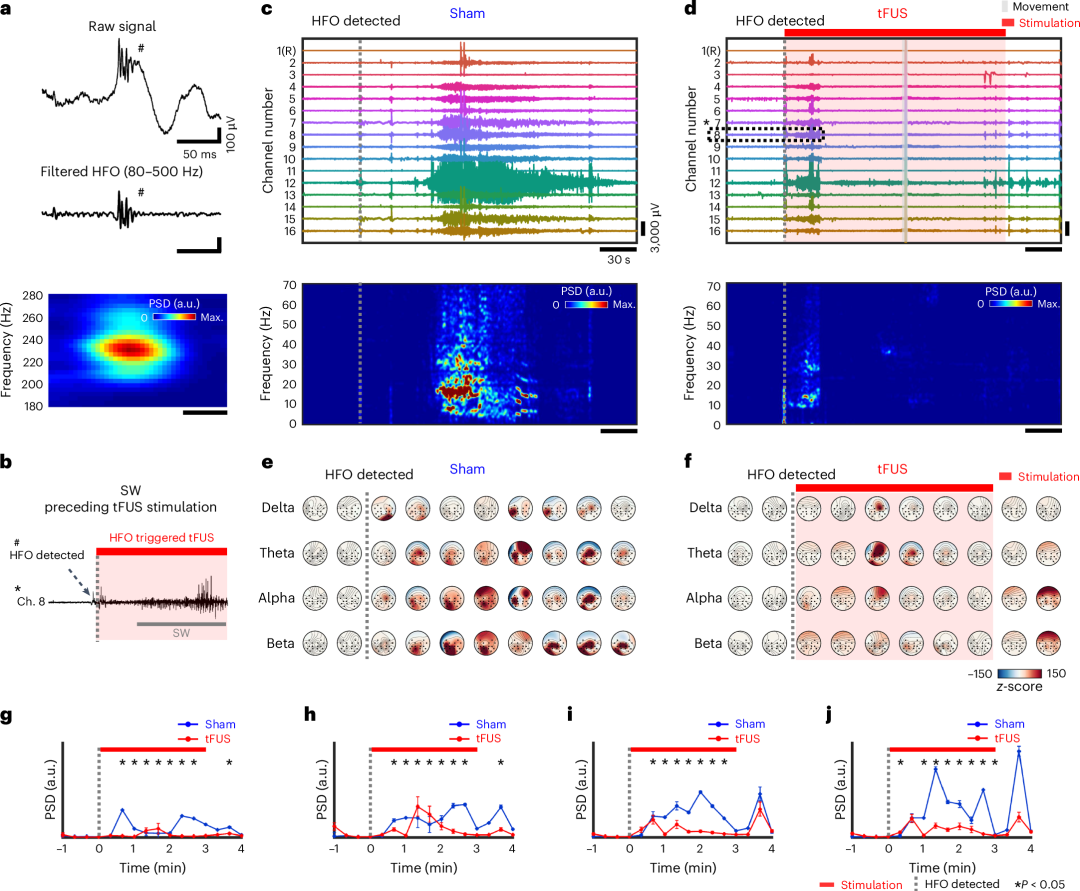 图 5:tFUS 诱导的体内实时癫痫发作控制与 HFO 检测触发的前尖峰波刺激。接下来,研究了 SMCA 传感器与定制 tFUS 刺激相结合的神经记录性能,并研究了在清醒动物中采用治疗方案来监测和治疗癫痫发作。为了更好地在自由活动的动物中使用便携式双向神经接口平台,设计了一种定制的头置系统,该系统结合了 tFUS 换能器和植入式 SMCA 传感器(补充图 22 和补充说明 12 )。在该系统中,将由癫痫发作前的 HFO 检测确定的反应性 tFUS 刺激设置为在发作前针对海马区域的右侧 CA3 区。通过这种方法,我们的定制系统精确预测了随后的癫痫发作棘波并适当地执行了主动治疗措施(图 5b )。我们采用 40 Hz PRF 的 tFUS 方案作为治疗试验 42, 应用于清醒的癫痫动物(有关 tFUS 方案的基本原理和刺激脉冲工程的详细信息,请参见补充图 23 和补充说明 13 )。因此,无论是否进行连续 tFUS 神经刺激干预,清醒癫痫大鼠的 SMCA 传感器神经记录性能都能稳定维持(图 5c、d )(有关系统设置和体内实验程序的详细信息,请参阅补充图 24 和 25 )。在所有通道的代表性时间轨迹中,从同一癫痫动物记录的原始信号,我们观察到,在 tFUS 刺激的癫痫发作(称为 tFUS)期间,从癫痫发作前的 HFO 检测时刻开始的 3 分钟刺激,癫痫棘波的幅度和持续时间显著减少,刺激方案为 40 Hz PRF 和 5% 占空比(图 5d ,上图),与 tFUS 情况之前同一时间段的假性癫痫发作(称为假性癫痫)期间的发作波相比(在检测到 HFO 后 3 分钟内没有神经刺激进行记录)(图 5c ,上图)。与癫痫发作时期记录的电生理活动相对应,靠近 tFUS 神经刺激点(第 9 章)的 SMCA 传感器阵列中通道电极的归一化功率谱图支持了 tFUS 神经刺激的在线癫痫抑制效果(图 5c、d ,下图)。值得注意的是,在脑活动的任何频带(包括对应于癫痫抑制方案 PRF 的 40 Hz)中均未出现 tFUS 伪影干扰,这再次凸显了我们 SMCA 传感器平台抗超声伪影的神经信号传导性能,使我们能够评估神经刺激方案的有效性。 在此前提下,从不受伪影影响的功率谱图来看,治疗结果表明,异常神经活动的趋势得到了 tFUS 神经刺激控制方案的有效抑制,而不是像假手术病例中那样随着时间的推移而自然镇静(图 5c ,下图)(有关单通道 tFUS 调节癫痫发作活动的控制研究以及主要癫痫发作期神经记录的时空模式,请参见扩展数据图 2 ,详情见补充说明 14 和 15 )。此外,对多个动物受试者累积研究了 40 Hz PRF 刺激对癫痫发作的控制效果,以评估 tFUS 神经刺激方案的平均功效并确定其对个体体内模型的预后差异。根据从所有假手术和 tFUS 病例对的平均大脑活动主频带分类的一系列二维 z 分数地形图表明,在将由 HFO 检测触发的 tFUS 神经刺激应用于右侧 CA3 区域后(图 5f ),与假手术病例相比(图 5e ),从 delta(1-4 Hz)到 beta(13-30 Hz)振荡的振荡功率和持续时间在两个半球区域中均受到很大抑制。每个平均振荡功率密度值还表明,与同一时间间隔内的假手术病例相比,在 tFUS 刺激期间从 delta 到 beta 频带的振荡能量受到很大抑制(图 5g-j )。这些结果一致表明,40 Hz PRF 协议降低了发作振荡的幅度和癫痫样多动的持续时间,成功验证了其在线治疗效果。
图 5:tFUS 诱导的体内实时癫痫发作控制与 HFO 检测触发的前尖峰波刺激。接下来,研究了 SMCA 传感器与定制 tFUS 刺激相结合的神经记录性能,并研究了在清醒动物中采用治疗方案来监测和治疗癫痫发作。为了更好地在自由活动的动物中使用便携式双向神经接口平台,设计了一种定制的头置系统,该系统结合了 tFUS 换能器和植入式 SMCA 传感器(补充图 22 和补充说明 12 )。在该系统中,将由癫痫发作前的 HFO 检测确定的反应性 tFUS 刺激设置为在发作前针对海马区域的右侧 CA3 区。通过这种方法,我们的定制系统精确预测了随后的癫痫发作棘波并适当地执行了主动治疗措施(图 5b )。我们采用 40 Hz PRF 的 tFUS 方案作为治疗试验 42, 应用于清醒的癫痫动物(有关 tFUS 方案的基本原理和刺激脉冲工程的详细信息,请参见补充图 23 和补充说明 13 )。因此,无论是否进行连续 tFUS 神经刺激干预,清醒癫痫大鼠的 SMCA 传感器神经记录性能都能稳定维持(图 5c、d )(有关系统设置和体内实验程序的详细信息,请参阅补充图 24 和 25 )。在所有通道的代表性时间轨迹中,从同一癫痫动物记录的原始信号,我们观察到,在 tFUS 刺激的癫痫发作(称为 tFUS)期间,从癫痫发作前的 HFO 检测时刻开始的 3 分钟刺激,癫痫棘波的幅度和持续时间显著减少,刺激方案为 40 Hz PRF 和 5% 占空比(图 5d ,上图),与 tFUS 情况之前同一时间段的假性癫痫发作(称为假性癫痫)期间的发作波相比(在检测到 HFO 后 3 分钟内没有神经刺激进行记录)(图 5c ,上图)。与癫痫发作时期记录的电生理活动相对应,靠近 tFUS 神经刺激点(第 9 章)的 SMCA 传感器阵列中通道电极的归一化功率谱图支持了 tFUS 神经刺激的在线癫痫抑制效果(图 5c、d ,下图)。值得注意的是,在脑活动的任何频带(包括对应于癫痫抑制方案 PRF 的 40 Hz)中均未出现 tFUS 伪影干扰,这再次凸显了我们 SMCA 传感器平台抗超声伪影的神经信号传导性能,使我们能够评估神经刺激方案的有效性。 在此前提下,从不受伪影影响的功率谱图来看,治疗结果表明,异常神经活动的趋势得到了 tFUS 神经刺激控制方案的有效抑制,而不是像假手术病例中那样随着时间的推移而自然镇静(图 5c ,下图)(有关单通道 tFUS 调节癫痫发作活动的控制研究以及主要癫痫发作期神经记录的时空模式,请参见扩展数据图 2 ,详情见补充说明 14 和 15 )。此外,对多个动物受试者累积研究了 40 Hz PRF 刺激对癫痫发作的控制效果,以评估 tFUS 神经刺激方案的平均功效并确定其对个体体内模型的预后差异。根据从所有假手术和 tFUS 病例对的平均大脑活动主频带分类的一系列二维 z 分数地形图表明,在将由 HFO 检测触发的 tFUS 神经刺激应用于右侧 CA3 区域后(图 5f ),与假手术病例相比(图 5e ),从 delta(1-4 Hz)到 beta(13-30 Hz)振荡的振荡功率和持续时间在两个半球区域中均受到很大抑制。每个平均振荡功率密度值还表明,与同一时间间隔内的假手术病例相比,在 tFUS 刺激期间从 delta 到 beta 频带的振荡能量受到很大抑制(图 5g-j )。这些结果一致表明,40 Hz PRF 协议降低了发作振荡的幅度和癫痫样多动的持续时间,成功验证了其在线治疗效果。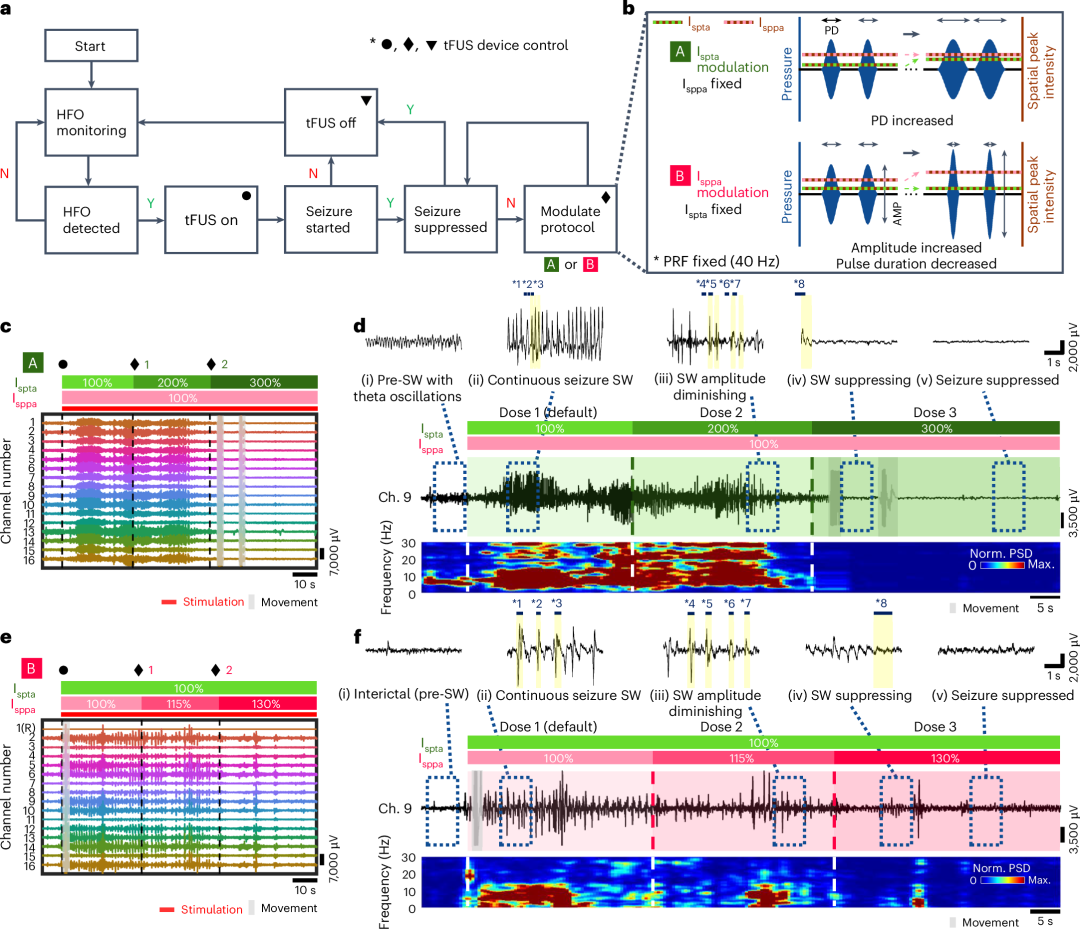 图 6:带有 SMCA 传感器监测反馈的 tFUS 剂量调节的闭环癫痫控制系统。总的来说,基于通过 SMCA 传感器进行的精确 HFO 检测,在我们的闭环系统中,采用默认协议(空间峰值时间平均强度 (I spta ) 为 0.05 W cm −2 和空间峰值脉冲平均强度 (I sppa ) 为 1 W cm −2 ),tFUS 神经刺激可以有效控制诱发的癫痫振荡(扩展数据图 3 和补充说明 17 )。对于默认设置无法解决的更多不良情况,我们还演示了两种类型的闭环。“A”模式和“B”模式闭环的代表性示例说明了通过 I spta 或 I sppa 调制的三级 tFUS 协议控制癫痫(图 6c、e )。在从位于后顶叶皮质的通道记录的放大轮廓的详细神经活动轨迹中,可以在三级闭环 tFUS 神经刺激下,在从癫痫发作前(或发作间期)(阶段 I)振荡到癫痫发作期再到基线恢复范围的各个神经波形上索引闭环序列的五个不同阶段(图 6d、f )。在这两种情况下,诱发的癫痫发作模型都是顽固型,在默认设置(阶段 II)下的初始神经刺激试验(剂量 1)无法缓解,导致剂量增加。虽然随后的 I spta 和 I sppa 调节(剂量 2)肯定有效,但仍然观察到相当大的发作波幅度和持续时间(阶段 III)。 另一个剂量增量(剂量 3)最终导致残留癫痫样放电(IV 期)完全缓解(有关闭环 I spta 或 I sppa 剂量调节 tFUS 癫痫发作抑制的详细描述,请参阅补充说明 18 和 19 )。相应的功率谱图也支持剂量调节闭环系统可有效抑制不同类型的随机癫痫发作。闭环系统中使用的 tFUS 方案的最大强度满足 tFUS 刺激生物物理安全的最新指南 43 ,诱导组织温度升高低于 2°C,被认为是安全的并且不太可能导致组织损伤问题(补充图 27 )。我们使用的最强烈的声波也被证实没有不良的血脑屏障(BBB)开放问题(有关 BBB 开放验证测试的详细信息,请参阅补充图 28 和补充说明 20 )。除了单通道驱动的神经信号轨迹外,SMCA 传感器阵列还获得了 tFUS 调控的癫痫抑制全序列中三种神经动力学时空振幅地形图数据(扩展数据图 4 和图 5 、补充说明 21 和视频 6 )。值得注意的是,SMCA 传感器中多电极阵列记录的癫痫发作尖峰清楚地表明神经信号中没有电干扰,这得到了来自信号源附近通道的时间延迟发作峰值的支持(补充图 26 )。 闭环 tFUS 癫痫抑制的案例研究包括一个癫痫模型,该模型具有重复的径向动力学,由位于后顶叶皮层的通道触发,该通道可能被视为癫痫源(第 13 章)并扩散到整个右半球区域(图 4 、扩展数据图 5 和补充视频 7 )。在三级闭环 tFUS 时期,彩色图中电癫痫发作活动的二维地形图也显示出其最强烈水平(代表峰 *1 至 *3,II 期)几乎不受剂量 1 方案的影响,癫痫发作强度和振荡频率呈逐渐衰减趋势,但剂量 2 方案保持了其特征性的传播模式,剂量 3 方案抑制了残余发作波(代表峰 *8,IV 期)(有关闭环 I spta 调节癫痫发作抑制发作期间时空电图神经动力学的连续地形剪辑,请参见补充视频 6 )。关于有效抑制各种癫痫样放电和来自个体动物的每个癫痫发作案例中涉及的不同发作动力学的此类信息性发现被清晰地可视化。
图 6:带有 SMCA 传感器监测反馈的 tFUS 剂量调节的闭环癫痫控制系统。总的来说,基于通过 SMCA 传感器进行的精确 HFO 检测,在我们的闭环系统中,采用默认协议(空间峰值时间平均强度 (I spta ) 为 0.05 W cm −2 和空间峰值脉冲平均强度 (I sppa ) 为 1 W cm −2 ),tFUS 神经刺激可以有效控制诱发的癫痫振荡(扩展数据图 3 和补充说明 17 )。对于默认设置无法解决的更多不良情况,我们还演示了两种类型的闭环。“A”模式和“B”模式闭环的代表性示例说明了通过 I spta 或 I sppa 调制的三级 tFUS 协议控制癫痫(图 6c、e )。在从位于后顶叶皮质的通道记录的放大轮廓的详细神经活动轨迹中,可以在三级闭环 tFUS 神经刺激下,在从癫痫发作前(或发作间期)(阶段 I)振荡到癫痫发作期再到基线恢复范围的各个神经波形上索引闭环序列的五个不同阶段(图 6d、f )。在这两种情况下,诱发的癫痫发作模型都是顽固型,在默认设置(阶段 II)下的初始神经刺激试验(剂量 1)无法缓解,导致剂量增加。虽然随后的 I spta 和 I sppa 调节(剂量 2)肯定有效,但仍然观察到相当大的发作波幅度和持续时间(阶段 III)。 另一个剂量增量(剂量 3)最终导致残留癫痫样放电(IV 期)完全缓解(有关闭环 I spta 或 I sppa 剂量调节 tFUS 癫痫发作抑制的详细描述,请参阅补充说明 18 和 19 )。相应的功率谱图也支持剂量调节闭环系统可有效抑制不同类型的随机癫痫发作。闭环系统中使用的 tFUS 方案的最大强度满足 tFUS 刺激生物物理安全的最新指南 43 ,诱导组织温度升高低于 2°C,被认为是安全的并且不太可能导致组织损伤问题(补充图 27 )。我们使用的最强烈的声波也被证实没有不良的血脑屏障(BBB)开放问题(有关 BBB 开放验证测试的详细信息,请参阅补充图 28 和补充说明 20 )。除了单通道驱动的神经信号轨迹外,SMCA 传感器阵列还获得了 tFUS 调控的癫痫抑制全序列中三种神经动力学时空振幅地形图数据(扩展数据图 4 和图 5 、补充说明 21 和视频 6 )。值得注意的是,SMCA 传感器中多电极阵列记录的癫痫发作尖峰清楚地表明神经信号中没有电干扰,这得到了来自信号源附近通道的时间延迟发作峰值的支持(补充图 26 )。 闭环 tFUS 癫痫抑制的案例研究包括一个癫痫模型,该模型具有重复的径向动力学,由位于后顶叶皮层的通道触发,该通道可能被视为癫痫源(第 13 章)并扩散到整个右半球区域(图 4 、扩展数据图 5 和补充视频 7 )。在三级闭环 tFUS 时期,彩色图中电癫痫发作活动的二维地形图也显示出其最强烈水平(代表峰 *1 至 *3,II 期)几乎不受剂量 1 方案的影响,癫痫发作强度和振荡频率呈逐渐衰减趋势,但剂量 2 方案保持了其特征性的传播模式,剂量 3 方案抑制了残余发作波(代表峰 *8,IV 期)(有关闭环 I spta 调节癫痫发作抑制发作期间时空电图神经动力学的连续地形剪辑,请参见补充视频 6 )。关于有效抑制各种癫痫样放电和来自个体动物的每个癫痫发作案例中涉及的不同发作动力学的此类信息性发现被清晰地可视化。
 由于对难治性癫痫治疗机制的理解不完全,导致传统药物疗效低下。为了解决这个问题,人们一直致力于开发针对药物抵抗性癫痫发作的组织部位特异性神经刺激工具,包括深部脑刺激和迷走神经刺激。 然而,此类方法存在与侵入性电刺激不稳定性相关的问题。经颅聚焦超声 (tFUS) 因其无炎症和长期稳定的刺激以及高空间分辨率而显示出对药物抵抗性癫痫发作的有效抑制作用。然而,迄今为止报道的临床前和临床试验使用固定的 tFUS 协议,在确定患者特定神经刺激参数方面进展有限。此外,尽管先前的转化研究证明了采用固定方案的 tFUS 刺激对动物模型中的癫痫发作具有抑制作用,但这些研究仅在麻醉或癫痫行为症状相对轻微的清醒动物中进行了验证,而没有考虑神经活动的状态。我们需要一个闭环系统,能够根据癫痫发作的严重程度, 通过刺激工具上准确的神经生理反馈来识别,从而设置最佳治疗方案。在这方面,具有适形接触、 牢固固定和在生物-非生物界面机械适应性的软脑装置对于早期检测致痫组织产生的高频振荡(HFOs)(80-500 Hz)以及向闭环 tFUS 神经刺激系统提供持久的神经生理反馈至关重要。尤其是微皮层电图(ECoG)设备在电神经信号传导方面具有高保真度和高时空分辨率,由于其高频容量和大面积覆盖,使其非常适合此类用途。然而,典型的基板和/或封装材料(例如厚聚酰亚胺(PI)和热生长二氧化硅(SiO 2 ))本质上具有较高的刚度和较差的形状适应性 , 导致皮质表面的卷积结构接触不均匀。具有可溶解基板的超薄网状设备可以在提高信号质量的同时提供脑部适形性,但由于脑脊液和组织的微运动,它们对微型目标组织点的感测位置精度可能受到限制。 现有的接口装置与脑组织的结合强度较低 , 也容易受到超声波的影响,因为传递声压的神经调节超声会产生与振动相关的机械噪声。这给脑集成电极装置的神经信号反馈带来了挑战,并且由于源自超声诱导的振荡的电伪影干预,无法实现最佳的闭环 tFUS 神经刺激。因此,需要即使在曲面上也具有强大的组织粘附性和顺应性的软脑接口材料, 以实现与超声刺激耦合的对伪影不敏感的神经装置。在本文中,作者报告了一种用于闭环 tFUS 神经刺激的可变形皮质粘合剂 (SMCA) 传感器(图 1a )。SMCA 传感器由作为粘弹性水凝胶粘合剂的儿茶酚共轭海藻酸盐 (Alg-CA)(补充图 1a )、 可拉伸的薄(~3 μm)16 通道微电极阵列和作为粘塑性自修复聚合物 (SHP) 基底的异佛尔酮双脲官能化聚二甲基硅氧烷 (PDMS-IU)(补充图 1b )组成。我们表明,它能够通过主动形状适应和坚韧的粘合性与啮齿动物大脑保形且牢固地固定(图 1a 中的插图)。 SMCA 传感器的皮质接口步骤(图 1b 和补充说明 1 )如下。首先,通过接触处 Alg-CA 水凝胶的瞬时凝胶化实现牢固的组织粘附,这包括通过用膨胀的水凝胶填充界面微孔区域进行保形接触、组织-设备界面的脑模拟刚度匹配以及共价或非共价化学键的形成(补充图 1c 和补充说明 1 )。其次,贴片的形状变形过程和完全的粘合剂凝胶化导致在皱纹皮质上的保形接触,这是 SHP 基质的粘塑性行为和膨胀的 Alg-CA 水凝胶的粘弹性的协同效应。最后,无应力生物电子接口涉及由于 SHP 基质的动态应力松弛而有效耗散皮质上变形引起的压缩应力能量。
由于对难治性癫痫治疗机制的理解不完全,导致传统药物疗效低下。为了解决这个问题,人们一直致力于开发针对药物抵抗性癫痫发作的组织部位特异性神经刺激工具,包括深部脑刺激和迷走神经刺激。 然而,此类方法存在与侵入性电刺激不稳定性相关的问题。经颅聚焦超声 (tFUS) 因其无炎症和长期稳定的刺激以及高空间分辨率而显示出对药物抵抗性癫痫发作的有效抑制作用。然而,迄今为止报道的临床前和临床试验使用固定的 tFUS 协议,在确定患者特定神经刺激参数方面进展有限。此外,尽管先前的转化研究证明了采用固定方案的 tFUS 刺激对动物模型中的癫痫发作具有抑制作用,但这些研究仅在麻醉或癫痫行为症状相对轻微的清醒动物中进行了验证,而没有考虑神经活动的状态。我们需要一个闭环系统,能够根据癫痫发作的严重程度, 通过刺激工具上准确的神经生理反馈来识别,从而设置最佳治疗方案。在这方面,具有适形接触、 牢固固定和在生物-非生物界面机械适应性的软脑装置对于早期检测致痫组织产生的高频振荡(HFOs)(80-500 Hz)以及向闭环 tFUS 神经刺激系统提供持久的神经生理反馈至关重要。尤其是微皮层电图(ECoG)设备在电神经信号传导方面具有高保真度和高时空分辨率,由于其高频容量和大面积覆盖,使其非常适合此类用途。然而,典型的基板和/或封装材料(例如厚聚酰亚胺(PI)和热生长二氧化硅(SiO 2 ))本质上具有较高的刚度和较差的形状适应性 , 导致皮质表面的卷积结构接触不均匀。具有可溶解基板的超薄网状设备可以在提高信号质量的同时提供脑部适形性,但由于脑脊液和组织的微运动,它们对微型目标组织点的感测位置精度可能受到限制。 现有的接口装置与脑组织的结合强度较低 , 也容易受到超声波的影响,因为传递声压的神经调节超声会产生与振动相关的机械噪声。这给脑集成电极装置的神经信号反馈带来了挑战,并且由于源自超声诱导的振荡的电伪影干预,无法实现最佳的闭环 tFUS 神经刺激。因此,需要即使在曲面上也具有强大的组织粘附性和顺应性的软脑接口材料, 以实现与超声刺激耦合的对伪影不敏感的神经装置。在本文中,作者报告了一种用于闭环 tFUS 神经刺激的可变形皮质粘合剂 (SMCA) 传感器(图 1a )。SMCA 传感器由作为粘弹性水凝胶粘合剂的儿茶酚共轭海藻酸盐 (Alg-CA)(补充图 1a )、 可拉伸的薄(~3 μm)16 通道微电极阵列和作为粘塑性自修复聚合物 (SHP) 基底的异佛尔酮双脲官能化聚二甲基硅氧烷 (PDMS-IU)(补充图 1b )组成。我们表明,它能够通过主动形状适应和坚韧的粘合性与啮齿动物大脑保形且牢固地固定(图 1a 中的插图)。 SMCA 传感器的皮质接口步骤(图 1b 和补充说明 1 )如下。首先,通过接触处 Alg-CA 水凝胶的瞬时凝胶化实现牢固的组织粘附,这包括通过用膨胀的水凝胶填充界面微孔区域进行保形接触、组织-设备界面的脑模拟刚度匹配以及共价或非共价化学键的形成(补充图 1c 和补充说明 1 )。其次,贴片的形状变形过程和完全的粘合剂凝胶化导致在皱纹皮质上的保形接触,这是 SHP 基质的粘塑性行为和膨胀的 Alg-CA 水凝胶的粘弹性的协同效应。最后,无应力生物电子接口涉及由于 SHP 基质的动态应力松弛而有效耗散皮质上变形引起的压缩应力能量。 图 1:用于超稳定脑接口的 SMCA 传感器可实现闭环 tFUS 神经治疗。将微型 tFUS 换能器用于带有颅内 SMCA 传感器的清醒啮齿动物模型(图 1c )。为了实现用于闭环脑接口的便携式头置系统,使用三维打印支架将 tFUS 设备与植入式 SMCA 传感器的适配器耦合(图 1c 中的插图)。通过这种方法,我们在麻醉动物和清醒癫痫动物的 tFUS 神经刺激下展示了无伪影的 ECoG。(图 1d )。稳定的神经信号传导性能使我们的平台能够作为慢性癫痫发作预测器并通过检测高质量的癫痫 HFO 来自动触发神经刺激。我们还使用这些功能创建基于 tFUS 和 SMCA-ECoG 的闭环癫痫发作控制策略:由癫痫发作前的 HFO 检测触发的 tFUS 启动;在预定时间间隔内以初始剂量进行持续神经刺激;根据实时反馈对 tFUS 方案的修改,如果反馈表明抑制效果不足,则进行修改;如果确定癫痫发作已被抑制,则终止 tFUS(图 1e )。我们在清醒啮齿动物中说明了我们的方法,突出了 SMCA 传感器稳定的闭环反馈性能。
图 1:用于超稳定脑接口的 SMCA 传感器可实现闭环 tFUS 神经治疗。将微型 tFUS 换能器用于带有颅内 SMCA 传感器的清醒啮齿动物模型(图 1c )。为了实现用于闭环脑接口的便携式头置系统,使用三维打印支架将 tFUS 设备与植入式 SMCA 传感器的适配器耦合(图 1c 中的插图)。通过这种方法,我们在麻醉动物和清醒癫痫动物的 tFUS 神经刺激下展示了无伪影的 ECoG。(图 1d )。稳定的神经信号传导性能使我们的平台能够作为慢性癫痫发作预测器并通过检测高质量的癫痫 HFO 来自动触发神经刺激。我们还使用这些功能创建基于 tFUS 和 SMCA-ECoG 的闭环癫痫发作控制策略:由癫痫发作前的 HFO 检测触发的 tFUS 启动;在预定时间间隔内以初始剂量进行持续神经刺激;根据实时反馈对 tFUS 方案的修改,如果反馈表明抑制效果不足,则进行修改;如果确定癫痫发作已被抑制,则终止 tFUS(图 1e )。我们在清醒啮齿动物中说明了我们的方法,突出了 SMCA 传感器稳定的闭环反馈性能。自发变形皮质粘连
为了验证由粘弹性 Alg-CA 水凝胶(补充图 2 和补充说明 2 )和粘塑性 PDMS-IU SHP(材料选择的理由在补充说明 3 中描述)组成的 SMCA 的脑接口功能,作为耐声压的软贴片平台,通过对照测试全面研究了其组织粘附性能和形状适应行为。与涂在 SHP 上的未改性 Alg 的粘附强度(例如,~12 kPa)(图 2a ,红色条)相比,Alg-CA 表现出对拉伸和剪切应力的强组织粘附性(例如,拉伸试验为 17.4 kPa,搭接剪切试验为 23.9 kPa)(蓝色条),源于儿茶酚基团的存在。特别是,Alg-CA 的高剪切粘附性对于实现植入装置在大脑皮层上不分层至关重要,即使在超声引起的机械振动下也是如此。此外,为了验证杨氏模量为几百 kPa 的粘塑性 SHP 对于稳定脑接口的重要性,比较了涂覆在其他刚性或弹性基底材料(即 PI 或聚二甲基硅氧烷 (PDMS))上的 Alg-CA 的粘附强度(图 2b )。正如预期的那样,Alg-CA 在硅氧烷基可拉伸材料(例如 PDMS 或 SHP)上的剪切粘附强度明显高于在传统柔性基底(即具有 GPa 级机械模量的刚性 PI 板)上的剪切粘附强度(图 2b )。 应当注意,这些结果是在实验环境下确定的,其中每个基底固定在刚性背衬膜(例如,聚对苯二甲酸乙二醇酯(PET))上,以验证涂在聚合物基底上的组织界面水凝胶本身的粘合强度,这可能无法反映导致整个软装置贴片变形的体内机械动态环境。因此,我们在没有背衬膜的情况下进行了额外的粘附测试,以研究基底材料对组织粘附功能的影响(图 2c )。在对涂在 SHP 上的 Alg-CA(例如,SMCA 膜)的末端施加剪切应力时,粘塑性基底(补充图 4a )被有效拉伸至其初始长度的 860%,验证了 SMCA 贴片通过结合高断裂韧性和强粘附性实现的最大化组织粘附性能(图 2c ,蓝色和补充图 3 ,底部照片)。相比之下,其他薄膜,例如 SHP 上的 Alg(图 2c ,红色,以及补充图 3 ,顶部照片)或 PDMS 上的 Alg-CA(绿色,以及补充图 3 ,中间照片),具有相对较低的韧性值和拉伸性(例如,Alg/SHP 为 78%,Alg-CA/PDMS 为 109%)。此外,SMCA 薄膜随时间表现出显著的应力松弛行为,表明其典型的粘塑性(图 2d ,蓝色,补充图 4 和 5 以及补充说明 4 )。然而,Alg-CA/PDMS 薄膜在施加应变后具有恒定的应力(绿色,补充图 4 和 5 以及补充说明 4 )。在定性测试中,SMCA 薄膜高达 600% 的优异拉伸性也使其在湿脑组织上具有很强的粘附性能(图 2e ,下图),而 Alg-CA/PDMS 薄膜表现出机械故障(中间照片),Alg/SHP 薄膜很容易从脑组织上脱落(上图)。SMCA 最大化脑粘附性的所有结果一致证明了基于可逆氢键的高韧性粘塑性基质和动态应力耗散与通过组织特异性化学键牢固附着的粘弹性粘合剂之间的协同效应。 图 2:SMCA 的脑接口功能。我们还研究了 SMCA 贴片的无应力形状自适应特性(有关 SMCA 形状变形行为驱动源的推理,请参见补充说明 5 )。根据有限元分析(FEA),SMCA 薄膜可以很好地填充弯曲物体(例如脑皱纹)的空隙空间,并减轻变形引起的应力(补充图 4b 和 5 ),而 PDMS 不仅无法与曲率共形接触,而且无法在界面平面处松弛应力(图 2f ,FEA 分析方法的详细信息在补充说明 6 中描述)。与计算模型相对应,在使用牛脑组织的离体试验中也观察到了 SMCA 薄膜的自发形状变形特性(图 2g 和补充视频 1 )。虽然 Alg-CA/PDMS 双层膜没有变形成脑皱纹(图 2g ,顶部照片),但 SMCA 薄膜无需任何外部施加的驱动力(例如,电磁场、压力、热能)即可自主变形为皮质的凹曲,从而完全贴合表面轮廓(图 2g ,底部照片)(有关结果的详细讨论,请参阅补充说明 7 )。 确认了与大脑接触的荧光染料标记双层膜贴片(Alg-CA 为绿色标签,PDMS 和 SHP 为红色标签)的横截面照片(顶部)和三维(3D)共聚焦显微镜(底部)图像(图 2h 和补充图 7 ),这验证了 SMCA 贴片的接触能力,它不会在界面处产生空间空隙(图。 2h ,右图),而皮质表面和 Alg-CA/PDMS 双层之间存在较大的气隙(图 2h ,左图)。组织附着的 SMCA 贴片中肿胀的 Alg-CA 的保湿性即使在离体条件下也能稳定维持 7 天而没有大量水分流失,这强烈表明 SMCA 传感器可以通过 Alg-CA 界面层与皮质长期整合在体内充满脑脊液的颅内空间条件下(补充图 8 )。这些结果全面证明了我们的材料策略将具有软流动性和瞬时凝胶化的 Alg-CA 聚合物与具有热塑性变形和有效应变能量耗散的 PDMS-IU SHP 相结合,适用于生物相容性和脑接触界面。
图 2:SMCA 的脑接口功能。我们还研究了 SMCA 贴片的无应力形状自适应特性(有关 SMCA 形状变形行为驱动源的推理,请参见补充说明 5 )。根据有限元分析(FEA),SMCA 薄膜可以很好地填充弯曲物体(例如脑皱纹)的空隙空间,并减轻变形引起的应力(补充图 4b 和 5 ),而 PDMS 不仅无法与曲率共形接触,而且无法在界面平面处松弛应力(图 2f ,FEA 分析方法的详细信息在补充说明 6 中描述)。与计算模型相对应,在使用牛脑组织的离体试验中也观察到了 SMCA 薄膜的自发形状变形特性(图 2g 和补充视频 1 )。虽然 Alg-CA/PDMS 双层膜没有变形成脑皱纹(图 2g ,顶部照片),但 SMCA 薄膜无需任何外部施加的驱动力(例如,电磁场、压力、热能)即可自主变形为皮质的凹曲,从而完全贴合表面轮廓(图 2g ,底部照片)(有关结果的详细讨论,请参阅补充说明 7 )。 确认了与大脑接触的荧光染料标记双层膜贴片(Alg-CA 为绿色标签,PDMS 和 SHP 为红色标签)的横截面照片(顶部)和三维(3D)共聚焦显微镜(底部)图像(图 2h 和补充图 7 ),这验证了 SMCA 贴片的接触能力,它不会在界面处产生空间空隙(图。 2h ,右图),而皮质表面和 Alg-CA/PDMS 双层之间存在较大的气隙(图 2h ,左图)。组织附着的 SMCA 贴片中肿胀的 Alg-CA 的保湿性即使在离体条件下也能稳定维持 7 天而没有大量水分流失,这强烈表明 SMCA 传感器可以通过 Alg-CA 界面层与皮质长期整合在体内充满脑脊液的颅内空间条件下(补充图 8 )。这些结果全面证明了我们的材料策略将具有软流动性和瞬时凝胶化的 Alg-CA 聚合物与具有热塑性变形和有效应变能量耗散的 PDMS-IU SHP 相结合,适用于生物相容性和脑接触界面。SMCA 传感器直接转印工艺
除了源自粘塑性 SHP 的热塑性的自发形状变形性能之外,这种机械功能还可用于集成 SMCA 传感器,该传感器结合了新一类的印刷可拉伸电极装置(图 3a 和补充图 9 ,参见方法中用于 SMCA 传感器的超薄可拉伸多电极装置的详细制造过程)。可拉伸电子器件的非常规平台有望以这样的方式实现:即使没有表面粘性,超薄和波浪结构(~3μm)也可以直接转移印刷到 SHP 基板上,方法是将设备的底部嵌入到 SHP 层的浅表面中,并将设备的锚定框架固定在温和的压力诱导形状变形的基板中,该基板的热塑性行为因更高的热能而加速(图 3b 和补充图 6 )。为了充分支持我们的假设,我们准备了不同温度(25、40 和 60°C)的转印工艺。正如预期,SEM 图像显示热塑性 SHP 在高温下变形逐渐增强,这明显验证了通过锚定和嵌入工艺实现的超薄电极直接转印打印方法的可靠性(图 3c ),而这在热固性聚合物中是无法实现的。采用该方法,晶圆级批量生产的 SHP 打印多电极阵列(补充图 9 )在 0% 和 50% 应变下均能确保较高的面积均匀性(图 3d )。 我们的直接转印工艺还能使可拉伸电极的电阻(线性拉伸测试中高达 70% 的应变,重复拉伸测试中 100 次循环中高达 35% 的应变)和电化学阻抗(高达 50% 的应变)值高度均匀(图 3e-g )。然后,我们通过轻松涂覆和脱水 Alg-CA 分散水溶液在电极阵列正面形成 Alg-CA 薄膜,完成了 SMCA 传感器(补充图 10 )。水凝胶溶液很容易形成粘性干膜,只需将其整片涂覆在电极阵列正面,无需担心相邻通道之间的电串扰,因为去质子化的多糖水凝胶仍然具有高电阻。此外,使用离子导电粘合水凝胶作为生物界面层导致电容效应(补充图 11b )导致电化学阻抗降低(补充图 11a ),表明 Alg-CA 层本身可用作低阻抗涂层,而无需额外的微图案化或纳米结构膜(例如,聚(3,4-乙撑二氧噻吩)-聚苯乙烯磺酸盐(PEDOT:PSS),氧化铱(IrO x )和氮化钛(TiN))。因此,除了在组织-设备接触处提供界面模量匹配(补充图 2 )和粘合功能(图 2a-c )之外,Alg-CA 水凝胶有望改善 SMCA 传感器平台的神经信号传导性能。 图 3:通过直接转印工艺制作的可拉伸 ECoG 阵列。在体内演示使用 SMCA 传感器之前,先在离体牛皮质上研究了其在脑内的粘附情况(图 3h-j )。SMCA 传感器被共形地安装在不平整的皱纹皮质表面,并自发变形为不同深度的各种山谷(图 3h )。可以清楚地证实,与裸露的 SHP 薄膜相比,超薄可拉伸电极阵列与网状蛇形互连图案的集成不会降低 SMCA 传感器贴片的热塑性或应力松弛性能,从而导致皮质接口装置的超共形性(补充图 12 )。当剪切应力施加到 SMCA 传感器时,这种组织粘附性能得以稳定保持(图 3i 和补充视频 2 );此外,即使在水冲洗条件下,也证明了其强大的粘附性能(图 3j 、补充图 13 为扩展序列图像,补充视频 3 展示了冲洗条件下粘附测试的完整序列)。考虑到成功的体外演示,我们的 SMCA 传感器非常适合实现终极脑机接口。
图 3:通过直接转印工艺制作的可拉伸 ECoG 阵列。在体内演示使用 SMCA 传感器之前,先在离体牛皮质上研究了其在脑内的粘附情况(图 3h-j )。SMCA 传感器被共形地安装在不平整的皱纹皮质表面,并自发变形为不同深度的各种山谷(图 3h )。可以清楚地证实,与裸露的 SHP 薄膜相比,超薄可拉伸电极阵列与网状蛇形互连图案的集成不会降低 SMCA 传感器贴片的热塑性或应力松弛性能,从而导致皮质接口装置的超共形性(补充图 12 )。当剪切应力施加到 SMCA 传感器时,这种组织粘附性能得以稳定保持(图 3i 和补充视频 2 );此外,即使在水冲洗条件下,也证明了其强大的粘附性能(图 3j 、补充图 13 为扩展序列图像,补充视频 3 展示了冲洗条件下粘附测试的完整序列)。考虑到成功的体外演示,我们的 SMCA 传感器非常适合实现终极脑机接口。tFUS 抗伪影神经记录
SMCA 传感器专为自发适应皮质的 3D 曲线几何和表面形态而设计,其形状变形和组织粘附功能有望有助于在 tFUS 神经刺激期间确保清晰的脑电活动,而不会产生超声引起的伪影,这是其他软神经装置平台无法实现的(图 4a )。为了证明我们的假设,我们准备了一个急性体内实验环境,研究了 SMCA 传感器在 tFUS 超声处理下的神经信号稳定性(实验装置的细节在补充说明 8 中描述)。我们通过基线活动的信号质量和 tFUS 诱发的事件相关电位(ERP)展示了软 ECoG 设备与超声刺激相结合的定量神经生理学性能。通过平均噪声源的功率谱密度 (PSD) 来评估每个参数,噪声源分别是 60 Hz 线路噪声和 tFUS 定义的脉冲重复频率 (PRF),从多个动物的神经信号中提取(有关急性体内实验的详细信息,请参阅方法 、补充图 14 和表 1 )。之前已报道过一种典型的 tFUS 方案,其 PRF 为 1 kHz,占空比为 50%,可用于引发神经元反应 40 ,这不仅因为它能保证神经激活作用,而且它的识别频率与大脑活动的主要范围(大鼠为 0.1 至 600 Hz) 41 不同,在功率谱分析中,这很容易被视为 tFUS 引起的伪影(参见补充图。 15 有关急性体内超声设置和神经刺激方案的详细信息)。 图 4:在麻醉啮齿动物模型中,与不同的脑接口材料相比,SMCA 传感器在 tFUS 刺激下的急性体内神经记录性能。显然,使用 SHP、Alg/SHP 和 SMCA 的 ECoG 设备与 PDMS 以外的皮质表面均可保形地适应,这使我们推断这种保形性源自 SHP 基底的形状变形特性(图 4b-e )。与 SHP 基底上支撑的电极打印设备相比,基于 PDMS 的 ECoG 设备与皮质之间的界面主要形成不透明的气隙,因为由于缺乏形状适应性,即使在轻轻触摸后设备的支撑贴片也不符合皮质表面,这表明与传统弹性体基底耦合而没有自身组织保形性的软 ECoG 设备无法形成均匀的接触界面,即使小动物的大脑与非人类灵长类动物或人类相比,其脑沟和脑回的皮质结构不是很弯曲(图 4b )。非共形生物电子界面导致神经信号衰减,可能是由于 60 Hz 的线路噪声(图 4f 和补充图 16 )。此外,这种不稳定的组织界面导致 tFUS 超声处理下原始神经信号发生很大失真(下面的放大图,图 4f )。另一方面,使用形状变形 SHP 基板(包括 SMCA 传感器)的软 ECoG 设备平台由于轻柔触摸加速形状变形,在短时间内(1 分钟内)均匀地贴合皮质的表面形貌,没有任何空隙(图 4c-e )。打印在 SHP 基板上的 ECoG 设备表现出更好的基线信号质量(图 4c、g 和补充图 16 )。 具有流体材料特性和模量匹配能力的 Alg 水凝胶进一步增强了脑适形性(图 4d )和基线稳定性(图 4h 和补充图 16 )。尽管相对于基线有令人满意的改善,但 tFUS 引起的噪声在神经调节期间仍然有很大的干扰,这表明仅靠组织适形性无法完全防止机械伪影(图 4g、h ,下图放大图)。在这方面,我们观察到在适形固定在皮层的 SMCA 传感器中,此类伪影得到了有效减少(图 4e、i )。除了由于与离子导电软水凝胶极其共形的界面而实现的稳定基线神经记录(图 4i 和补充图 12 和 16 )之外,SMCA 传感器在 tFUS 超声处理下的连续神经生理学能力还可以实现以来自靠近超声视觉皮层的通道的特定 ERP 模式的方式监测完整的 tFUS 调节神经反应(图 4i ,放大图)。多通道 ECoG 流的时间轨迹图进一步验证了在 Alg/SHP 设备和使用皮质接口水凝胶层作为整体的 SMCA 传感器中的电极之间没有串扰问题 35 。为了进一步定量支持 SMCA 传感器在 tFUS 神经刺激下前所未有的神经生理稳定性,我们分析了从上述四个 ECoG 设备记录的体内神经信号中 1 kHz PRF 超声诱导伪影的 PSD(图 4j )。 考虑到神经振荡 41 的频率范围,如果在 tFUS 刺激期间 1 kHz 频率的功率增加,则它被视为 tFUS 引起的伪影,而不是神经信号。关于每个 ECoG 平台功率水平趋势的代表性和统计结果清楚地支持了我们的假设(图 4j 和补充图 17 )。没有组织粘附功能的对照组显然容易受到 tFUS 神经刺激的影响(图 4f-h 和补充图 17a-c )。相反,我们的 SMCA 传感器有效地将 1 kHz PRF 相关的机械伪影干预降至最低(补充图 17d ),这不足以仅通过保形性而没有强大的表面固定特性来实现(补充图 17b,c )(关于记录的神经信号中可视化的 tFUS 引起的伪影的详细讨论出现在补充说明 9 中)。综上所述,结果强调了 SMCA 传感器平台固有的强粘附性和形状变形特性的共存对于实现与超声调制相结合的皮质活动高保真监测起着最重要的作用,从而增加了实现闭环 tFUS 神经刺激的可能性(有关包括 SMCA 传感器在内的软 ECoG 设备平台的可能运行机制以及材料功能和神经信号传导性能之间的相关性的讨论,请参见补充图 18 和补充说明 10 )。
图 4:在麻醉啮齿动物模型中,与不同的脑接口材料相比,SMCA 传感器在 tFUS 刺激下的急性体内神经记录性能。显然,使用 SHP、Alg/SHP 和 SMCA 的 ECoG 设备与 PDMS 以外的皮质表面均可保形地适应,这使我们推断这种保形性源自 SHP 基底的形状变形特性(图 4b-e )。与 SHP 基底上支撑的电极打印设备相比,基于 PDMS 的 ECoG 设备与皮质之间的界面主要形成不透明的气隙,因为由于缺乏形状适应性,即使在轻轻触摸后设备的支撑贴片也不符合皮质表面,这表明与传统弹性体基底耦合而没有自身组织保形性的软 ECoG 设备无法形成均匀的接触界面,即使小动物的大脑与非人类灵长类动物或人类相比,其脑沟和脑回的皮质结构不是很弯曲(图 4b )。非共形生物电子界面导致神经信号衰减,可能是由于 60 Hz 的线路噪声(图 4f 和补充图 16 )。此外,这种不稳定的组织界面导致 tFUS 超声处理下原始神经信号发生很大失真(下面的放大图,图 4f )。另一方面,使用形状变形 SHP 基板(包括 SMCA 传感器)的软 ECoG 设备平台由于轻柔触摸加速形状变形,在短时间内(1 分钟内)均匀地贴合皮质的表面形貌,没有任何空隙(图 4c-e )。打印在 SHP 基板上的 ECoG 设备表现出更好的基线信号质量(图 4c、g 和补充图 16 )。 具有流体材料特性和模量匹配能力的 Alg 水凝胶进一步增强了脑适形性(图 4d )和基线稳定性(图 4h 和补充图 16 )。尽管相对于基线有令人满意的改善,但 tFUS 引起的噪声在神经调节期间仍然有很大的干扰,这表明仅靠组织适形性无法完全防止机械伪影(图 4g、h ,下图放大图)。在这方面,我们观察到在适形固定在皮层的 SMCA 传感器中,此类伪影得到了有效减少(图 4e、i )。除了由于与离子导电软水凝胶极其共形的界面而实现的稳定基线神经记录(图 4i 和补充图 12 和 16 )之外,SMCA 传感器在 tFUS 超声处理下的连续神经生理学能力还可以实现以来自靠近超声视觉皮层的通道的特定 ERP 模式的方式监测完整的 tFUS 调节神经反应(图 4i ,放大图)。多通道 ECoG 流的时间轨迹图进一步验证了在 Alg/SHP 设备和使用皮质接口水凝胶层作为整体的 SMCA 传感器中的电极之间没有串扰问题 35 。为了进一步定量支持 SMCA 传感器在 tFUS 神经刺激下前所未有的神经生理稳定性,我们分析了从上述四个 ECoG 设备记录的体内神经信号中 1 kHz PRF 超声诱导伪影的 PSD(图 4j )。 考虑到神经振荡 41 的频率范围,如果在 tFUS 刺激期间 1 kHz 频率的功率增加,则它被视为 tFUS 引起的伪影,而不是神经信号。关于每个 ECoG 平台功率水平趋势的代表性和统计结果清楚地支持了我们的假设(图 4j 和补充图 17 )。没有组织粘附功能的对照组显然容易受到 tFUS 神经刺激的影响(图 4f-h 和补充图 17a-c )。相反,我们的 SMCA 传感器有效地将 1 kHz PRF 相关的机械伪影干预降至最低(补充图 17d ),这不足以仅通过保形性而没有强大的表面固定特性来实现(补充图 17b,c )(关于记录的神经信号中可视化的 tFUS 引起的伪影的详细讨论出现在补充说明 9 中)。综上所述,结果强调了 SMCA 传感器平台固有的强粘附性和形状变形特性的共存对于实现与超声调制相结合的皮质活动高保真监测起着最重要的作用,从而增加了实现闭环 tFUS 神经刺激的可能性(有关包括 SMCA 传感器在内的软 ECoG 设备平台的可能运行机制以及材料功能和神经信号传导性能之间的相关性的讨论,请参见补充图 18 和补充说明 10 )。tFUS 控制癫痫发作前癫痫
考虑到 SMCA 传感器具有抗 tFUS 伪影的神经信号监测性能,我们的材料合成和器件制造策略即使在长期颅内植入后,也有望保持与正常和癫痫诱发脑组织的声学透明接口。值得注意的是,准确检测癫痫发作前的 HFO 作为后续发作期的生物标志物,可以瞬间触发有效的神经刺激,从而早期抑制癫痫发作。为此,我们研究了 SMCA 传感器在清醒大鼠(该大鼠患有海人酸诱发癫痫)模型中的 HFO 记录能力(图 5a-d )。通过 80 至 500 Hz 范围内的快速和短脉冲振荡(图 5a ,顶部和中间)和相应的功率谱(图 5a ,底部)确认了原始皮质活动中包含的典型 HFO 信号,其信号质量不会因长期植入而降低(有关详情,请参阅补充图 19 和 20 以及补充说明 11 )。植入的 SMCA 传感器不仅能够进行长期多通道 ECoG 记录,还能验证其慢性生物相容性(扩展数据图 1 和补充图 21 )。对胶质纤维酸性蛋白进行染色以显示其在星形胶质细胞中的表达,以及代表小胶质细胞中离子化钙结合衔接分子 1 蛋白表达的 IBA-1,揭示了与假手术组相比,SMCA 传感器在短期(4 周)和长期(24 周)内均具有持续的生物安全性。 图 5:tFUS 诱导的体内实时癫痫发作控制与 HFO 检测触发的前尖峰波刺激。接下来,研究了 SMCA 传感器与定制 tFUS 刺激相结合的神经记录性能,并研究了在清醒动物中采用治疗方案来监测和治疗癫痫发作。为了更好地在自由活动的动物中使用便携式双向神经接口平台,设计了一种定制的头置系统,该系统结合了 tFUS 换能器和植入式 SMCA 传感器(补充图 22 和补充说明 12 )。在该系统中,将由癫痫发作前的 HFO 检测确定的反应性 tFUS 刺激设置为在发作前针对海马区域的右侧 CA3 区。通过这种方法,我们的定制系统精确预测了随后的癫痫发作棘波并适当地执行了主动治疗措施(图 5b )。我们采用 40 Hz PRF 的 tFUS 方案作为治疗试验 42, 应用于清醒的癫痫动物(有关 tFUS 方案的基本原理和刺激脉冲工程的详细信息,请参见补充图 23 和补充说明 13 )。因此,无论是否进行连续 tFUS 神经刺激干预,清醒癫痫大鼠的 SMCA 传感器神经记录性能都能稳定维持(图 5c、d )(有关系统设置和体内实验程序的详细信息,请参阅补充图 24 和 25 )。在所有通道的代表性时间轨迹中,从同一癫痫动物记录的原始信号,我们观察到,在 tFUS 刺激的癫痫发作(称为 tFUS)期间,从癫痫发作前的 HFO 检测时刻开始的 3 分钟刺激,癫痫棘波的幅度和持续时间显著减少,刺激方案为 40 Hz PRF 和 5% 占空比(图 5d ,上图),与 tFUS 情况之前同一时间段的假性癫痫发作(称为假性癫痫)期间的发作波相比(在检测到 HFO 后 3 分钟内没有神经刺激进行记录)(图 5c ,上图)。与癫痫发作时期记录的电生理活动相对应,靠近 tFUS 神经刺激点(第 9 章)的 SMCA 传感器阵列中通道电极的归一化功率谱图支持了 tFUS 神经刺激的在线癫痫抑制效果(图 5c、d ,下图)。值得注意的是,在脑活动的任何频带(包括对应于癫痫抑制方案 PRF 的 40 Hz)中均未出现 tFUS 伪影干扰,这再次凸显了我们 SMCA 传感器平台抗超声伪影的神经信号传导性能,使我们能够评估神经刺激方案的有效性。 在此前提下,从不受伪影影响的功率谱图来看,治疗结果表明,异常神经活动的趋势得到了 tFUS 神经刺激控制方案的有效抑制,而不是像假手术病例中那样随着时间的推移而自然镇静(图 5c ,下图)(有关单通道 tFUS 调节癫痫发作活动的控制研究以及主要癫痫发作期神经记录的时空模式,请参见扩展数据图 2 ,详情见补充说明 14 和 15 )。此外,对多个动物受试者累积研究了 40 Hz PRF 刺激对癫痫发作的控制效果,以评估 tFUS 神经刺激方案的平均功效并确定其对个体体内模型的预后差异。根据从所有假手术和 tFUS 病例对的平均大脑活动主频带分类的一系列二维 z 分数地形图表明,在将由 HFO 检测触发的 tFUS 神经刺激应用于右侧 CA3 区域后(图 5f ),与假手术病例相比(图 5e ),从 delta(1-4 Hz)到 beta(13-30 Hz)振荡的振荡功率和持续时间在两个半球区域中均受到很大抑制。每个平均振荡功率密度值还表明,与同一时间间隔内的假手术病例相比,在 tFUS 刺激期间从 delta 到 beta 频带的振荡能量受到很大抑制(图 5g-j )。这些结果一致表明,40 Hz PRF 协议降低了发作振荡的幅度和癫痫样多动的持续时间,成功验证了其在线治疗效果。
图 5:tFUS 诱导的体内实时癫痫发作控制与 HFO 检测触发的前尖峰波刺激。接下来,研究了 SMCA 传感器与定制 tFUS 刺激相结合的神经记录性能,并研究了在清醒动物中采用治疗方案来监测和治疗癫痫发作。为了更好地在自由活动的动物中使用便携式双向神经接口平台,设计了一种定制的头置系统,该系统结合了 tFUS 换能器和植入式 SMCA 传感器(补充图 22 和补充说明 12 )。在该系统中,将由癫痫发作前的 HFO 检测确定的反应性 tFUS 刺激设置为在发作前针对海马区域的右侧 CA3 区。通过这种方法,我们的定制系统精确预测了随后的癫痫发作棘波并适当地执行了主动治疗措施(图 5b )。我们采用 40 Hz PRF 的 tFUS 方案作为治疗试验 42, 应用于清醒的癫痫动物(有关 tFUS 方案的基本原理和刺激脉冲工程的详细信息,请参见补充图 23 和补充说明 13 )。因此,无论是否进行连续 tFUS 神经刺激干预,清醒癫痫大鼠的 SMCA 传感器神经记录性能都能稳定维持(图 5c、d )(有关系统设置和体内实验程序的详细信息,请参阅补充图 24 和 25 )。在所有通道的代表性时间轨迹中,从同一癫痫动物记录的原始信号,我们观察到,在 tFUS 刺激的癫痫发作(称为 tFUS)期间,从癫痫发作前的 HFO 检测时刻开始的 3 分钟刺激,癫痫棘波的幅度和持续时间显著减少,刺激方案为 40 Hz PRF 和 5% 占空比(图 5d ,上图),与 tFUS 情况之前同一时间段的假性癫痫发作(称为假性癫痫)期间的发作波相比(在检测到 HFO 后 3 分钟内没有神经刺激进行记录)(图 5c ,上图)。与癫痫发作时期记录的电生理活动相对应,靠近 tFUS 神经刺激点(第 9 章)的 SMCA 传感器阵列中通道电极的归一化功率谱图支持了 tFUS 神经刺激的在线癫痫抑制效果(图 5c、d ,下图)。值得注意的是,在脑活动的任何频带(包括对应于癫痫抑制方案 PRF 的 40 Hz)中均未出现 tFUS 伪影干扰,这再次凸显了我们 SMCA 传感器平台抗超声伪影的神经信号传导性能,使我们能够评估神经刺激方案的有效性。 在此前提下,从不受伪影影响的功率谱图来看,治疗结果表明,异常神经活动的趋势得到了 tFUS 神经刺激控制方案的有效抑制,而不是像假手术病例中那样随着时间的推移而自然镇静(图 5c ,下图)(有关单通道 tFUS 调节癫痫发作活动的控制研究以及主要癫痫发作期神经记录的时空模式,请参见扩展数据图 2 ,详情见补充说明 14 和 15 )。此外,对多个动物受试者累积研究了 40 Hz PRF 刺激对癫痫发作的控制效果,以评估 tFUS 神经刺激方案的平均功效并确定其对个体体内模型的预后差异。根据从所有假手术和 tFUS 病例对的平均大脑活动主频带分类的一系列二维 z 分数地形图表明,在将由 HFO 检测触发的 tFUS 神经刺激应用于右侧 CA3 区域后(图 5f ),与假手术病例相比(图 5e ),从 delta(1-4 Hz)到 beta(13-30 Hz)振荡的振荡功率和持续时间在两个半球区域中均受到很大抑制。每个平均振荡功率密度值还表明,与同一时间间隔内的假手术病例相比,在 tFUS 刺激期间从 delta 到 beta 频带的振荡能量受到很大抑制(图 5g-j )。这些结果一致表明,40 Hz PRF 协议降低了发作振荡的幅度和癫痫样多动的持续时间,成功验证了其在线治疗效果。闭环剂量调节癫痫控制
虽然最佳选择的 tFUS 方案可以作为有效抑制癫痫发作引起的不规则发作症状的关键因素,但由于难治性癫痫是一种以发作振荡离散模式为特征的不可预见的疾病,具有固定方案的 tFUS 神经刺激仍然仅限于个性化电疗。考虑到这一关键挑战,应将闭环功能集成到双向感知刺激系统中。在这方面,我们系统地设计了一个闭环框架,该框架能够自适应反馈控制与许多个案中的各种癫痫发作状态相对应的 tFUS 神经刺激方案(图 6a、b )(闭环癫痫控制系统的设计和操作流程的细节在补充说明 16 中描述)。所提出的系统具有自主剂量调节功能,其独特之处在于使用治疗超声的完整神经反应作为反馈参数,这是通过无伪影 SMCA 传感器实现的。 图 6:带有 SMCA 传感器监测反馈的 tFUS 剂量调节的闭环癫痫控制系统。总的来说,基于通过 SMCA 传感器进行的精确 HFO 检测,在我们的闭环系统中,采用默认协议(空间峰值时间平均强度 (I spta ) 为 0.05 W cm −2 和空间峰值脉冲平均强度 (I sppa ) 为 1 W cm −2 ),tFUS 神经刺激可以有效控制诱发的癫痫振荡(扩展数据图 3 和补充说明 17 )。对于默认设置无法解决的更多不良情况,我们还演示了两种类型的闭环。“A”模式和“B”模式闭环的代表性示例说明了通过 I spta 或 I sppa 调制的三级 tFUS 协议控制癫痫(图 6c、e )。在从位于后顶叶皮质的通道记录的放大轮廓的详细神经活动轨迹中,可以在三级闭环 tFUS 神经刺激下,在从癫痫发作前(或发作间期)(阶段 I)振荡到癫痫发作期再到基线恢复范围的各个神经波形上索引闭环序列的五个不同阶段(图 6d、f )。在这两种情况下,诱发的癫痫发作模型都是顽固型,在默认设置(阶段 II)下的初始神经刺激试验(剂量 1)无法缓解,导致剂量增加。虽然随后的 I spta 和 I sppa 调节(剂量 2)肯定有效,但仍然观察到相当大的发作波幅度和持续时间(阶段 III)。 另一个剂量增量(剂量 3)最终导致残留癫痫样放电(IV 期)完全缓解(有关闭环 I spta 或 I sppa 剂量调节 tFUS 癫痫发作抑制的详细描述,请参阅补充说明 18 和 19 )。相应的功率谱图也支持剂量调节闭环系统可有效抑制不同类型的随机癫痫发作。闭环系统中使用的 tFUS 方案的最大强度满足 tFUS 刺激生物物理安全的最新指南 43 ,诱导组织温度升高低于 2°C,被认为是安全的并且不太可能导致组织损伤问题(补充图 27 )。我们使用的最强烈的声波也被证实没有不良的血脑屏障(BBB)开放问题(有关 BBB 开放验证测试的详细信息,请参阅补充图 28 和补充说明 20 )。除了单通道驱动的神经信号轨迹外,SMCA 传感器阵列还获得了 tFUS 调控的癫痫抑制全序列中三种神经动力学时空振幅地形图数据(扩展数据图 4 和图 5 、补充说明 21 和视频 6 )。值得注意的是,SMCA 传感器中多电极阵列记录的癫痫发作尖峰清楚地表明神经信号中没有电干扰,这得到了来自信号源附近通道的时间延迟发作峰值的支持(补充图 26 )。 闭环 tFUS 癫痫抑制的案例研究包括一个癫痫模型,该模型具有重复的径向动力学,由位于后顶叶皮层的通道触发,该通道可能被视为癫痫源(第 13 章)并扩散到整个右半球区域(图 4 、扩展数据图 5 和补充视频 7 )。在三级闭环 tFUS 时期,彩色图中电癫痫发作活动的二维地形图也显示出其最强烈水平(代表峰 *1 至 *3,II 期)几乎不受剂量 1 方案的影响,癫痫发作强度和振荡频率呈逐渐衰减趋势,但剂量 2 方案保持了其特征性的传播模式,剂量 3 方案抑制了残余发作波(代表峰 *8,IV 期)(有关闭环 I spta 调节癫痫发作抑制发作期间时空电图神经动力学的连续地形剪辑,请参见补充视频 6 )。关于有效抑制各种癫痫样放电和来自个体动物的每个癫痫发作案例中涉及的不同发作动力学的此类信息性发现被清晰地可视化。
图 6:带有 SMCA 传感器监测反馈的 tFUS 剂量调节的闭环癫痫控制系统。总的来说,基于通过 SMCA 传感器进行的精确 HFO 检测,在我们的闭环系统中,采用默认协议(空间峰值时间平均强度 (I spta ) 为 0.05 W cm −2 和空间峰值脉冲平均强度 (I sppa ) 为 1 W cm −2 ),tFUS 神经刺激可以有效控制诱发的癫痫振荡(扩展数据图 3 和补充说明 17 )。对于默认设置无法解决的更多不良情况,我们还演示了两种类型的闭环。“A”模式和“B”模式闭环的代表性示例说明了通过 I spta 或 I sppa 调制的三级 tFUS 协议控制癫痫(图 6c、e )。在从位于后顶叶皮质的通道记录的放大轮廓的详细神经活动轨迹中,可以在三级闭环 tFUS 神经刺激下,在从癫痫发作前(或发作间期)(阶段 I)振荡到癫痫发作期再到基线恢复范围的各个神经波形上索引闭环序列的五个不同阶段(图 6d、f )。在这两种情况下,诱发的癫痫发作模型都是顽固型,在默认设置(阶段 II)下的初始神经刺激试验(剂量 1)无法缓解,导致剂量增加。虽然随后的 I spta 和 I sppa 调节(剂量 2)肯定有效,但仍然观察到相当大的发作波幅度和持续时间(阶段 III)。 另一个剂量增量(剂量 3)最终导致残留癫痫样放电(IV 期)完全缓解(有关闭环 I spta 或 I sppa 剂量调节 tFUS 癫痫发作抑制的详细描述,请参阅补充说明 18 和 19 )。相应的功率谱图也支持剂量调节闭环系统可有效抑制不同类型的随机癫痫发作。闭环系统中使用的 tFUS 方案的最大强度满足 tFUS 刺激生物物理安全的最新指南 43 ,诱导组织温度升高低于 2°C,被认为是安全的并且不太可能导致组织损伤问题(补充图 27 )。我们使用的最强烈的声波也被证实没有不良的血脑屏障(BBB)开放问题(有关 BBB 开放验证测试的详细信息,请参阅补充图 28 和补充说明 20 )。除了单通道驱动的神经信号轨迹外,SMCA 传感器阵列还获得了 tFUS 调控的癫痫抑制全序列中三种神经动力学时空振幅地形图数据(扩展数据图 4 和图 5 、补充说明 21 和视频 6 )。值得注意的是,SMCA 传感器中多电极阵列记录的癫痫发作尖峰清楚地表明神经信号中没有电干扰,这得到了来自信号源附近通道的时间延迟发作峰值的支持(补充图 26 )。 闭环 tFUS 癫痫抑制的案例研究包括一个癫痫模型,该模型具有重复的径向动力学,由位于后顶叶皮层的通道触发,该通道可能被视为癫痫源(第 13 章)并扩散到整个右半球区域(图 4 、扩展数据图 5 和补充视频 7 )。在三级闭环 tFUS 时期,彩色图中电癫痫发作活动的二维地形图也显示出其最强烈水平(代表峰 *1 至 *3,II 期)几乎不受剂量 1 方案的影响,癫痫发作强度和振荡频率呈逐渐衰减趋势,但剂量 2 方案保持了其特征性的传播模式,剂量 3 方案抑制了残余发作波(代表峰 *8,IV 期)(有关闭环 I spta 调节癫痫发作抑制发作期间时空电图神经动力学的连续地形剪辑,请参见补充视频 6 )。关于有效抑制各种癫痫样放电和来自个体动物的每个癫痫发作案例中涉及的不同发作动力学的此类信息性发现被清晰地可视化。结论
我们报道了一种用于闭环 tFUS 神经刺激的 SMCA 传感器。该 SMCA 装置采用层状结构,由离子导电且具有黏性的 Alg-CA 聚合物和粘塑性 SHP 组成。它能够在弯曲的皮质表面上呈现保形且稳固的固定,即使在清醒啮齿动物自由活动的 tFUS 神经刺激下也能提供稳定的 ECoG 信号监测。尤其值得一提的是,我们的闭环癫痫治疗系统通过 tFUS 剂量调节神经刺激有效抑制了不规则发作波。此外,SMCA 传感器阵列获得的时空映射图揭示了即使在声波存在的情况下,tFUS 神经刺激也能对与异常神经活动相关的受损组织部位产生积极影响。我们的 SMCA 平台有望用于开发闭环 tFUS 系统,该系统可以根据超声刺激调节的完整脑活动状态,灵活地确定最佳操作。 参考文献:Lee, S., Kum, J., Kim, S. et al. A shape-morphing cortex-adhesive sensor for closed-loop transcranial ultrasound neurostimulation. Nat Electron7, 800–814 (2024). https://doi.org/10.1038/s41928-024-01240-x 审核编辑 黄宇
声明:本文内容及配图由入驻作者撰写或者入驻合作网站授权转载。文章观点仅代表作者本人,不代表电子发烧友网立场。文章及其配图仅供工程师学习之用,如有内容侵权或者其他违规问题,请联系本站处理。
举报投诉
- 相关推荐
- 热点推荐
- 传感器
-
头戴式经颅聚焦超声神经调控技术的创新与实践2025-11-11 4476
-
呼吸门控闭环经皮迷走神经刺激(taVNS)系统2025-09-27 885
-
时间干涉经颅磁刺激TI-TMS是经颅磁的未来吗2025-09-17 1219
-
经颅电刺激系列之时域相干电刺激tTIS2025-08-25 6818
-
闭环经皮耳廓迷走神经刺激(taVNS)与 EEG、HRV 的技术融合2025-07-14 2624
-
经颅电刺激系列之交叉短脉冲刺激 ISP2025-06-21 3579
-
经颅电刺激系列之调幅经颅电刺激AM-tACS2025-06-18 948
-
经颅电刺激系列之相移经颅交流电刺激Phase-shifted tACS2025-06-09 1046
-
经颅电刺激适应症系列之改善抑郁情绪2025-04-15 1262
-
经颅电刺激系列之高精度经颅电刺激HD-TES2025-02-15 3519
-
经颅电刺激系列之高强度经颅交流电刺激Hi-tACS2025-02-10 2846
-
经颅多普勒超声是什么,做检查时应注意什么2021-12-03 2716
-
经颅直流电刺激技术介绍2021-09-15 671
全部0条评论

快来发表一下你的评论吧 !

